产KPC型碳青霉烯类耐药肠杆菌对头孢他啶-阿维巴坦的体外敏感性变化的机制分析*
崔晓燕,闻奕丞,徐颖,皇甫芷如,方芊芊,张雅昕,杜鸿(苏州大学附属第二医院检验科,江苏苏州215004)
近年来,随着碳青霉烯类抗菌药物在临床治疗中的广泛使用,碳青霉烯类耐药肠杆菌(carbapenem-resistant Enterobacteriaceae,CRE)感染比例不断增加。CRE耐药的主要机制为编码产生能够水解碳青霉烯类抗菌药物的碳青霉烯酶[1]。其中,肺炎克雷伯菌碳青霉烯酶(Klebsiellapneumoniaecarbapenemase,KPC)是目前世界上流行最为广泛的碳青霉烯酶,尤其是在中国[2]。阿维巴坦(avibactam,AVI)是一种非β-内酰胺类的β-内酰胺酶抑制剂,能够有效抑制KPC、OXA-48、AmpC等丝氨酸β-内酰胺酶的水解活性,但对NDM、IMP、VIM等金属β-内酰胺酶无抑制作用[3]。传统β-内酰胺类抗菌药物与AVI组合,能够明显扩大抑菌活性范围。2015年,美国食品和药物管理局(FDA)已经批准将头孢他啶-阿维巴坦(ceftazidime-avibactam,CAZ-AVI)用于临床治疗[4]。2019年5月,中国正式批准将注射制剂CAZ-AVI (ZAVICEFTA®)应用于临床治疗多重耐药革兰阴性菌引起的复杂性腹腔内感染以及医院获得性肺炎,包括呼吸机相关性肺炎。
本次研究收集苏州大学附属第二医院非重复CRE临床菌株,旨在检测未接受过CAZ-AVI治疗的产KPC型CRE(KPC-producing CRE,KPC-CRE)对CAZ-AVI的体外敏感性,研究产KPC型肺炎克雷伯菌(KPC-producingKlebsiellapneumoniae,KPC-KP)对CAZ-AVI敏感性降低机制,为CAZ-AVI在该医院临床治疗CRE感染中的合理使用提供理论依据。
1 材料与方法
1.1菌株来源 根据美国临床和实验室标准化协会(CLSI)推荐肠杆菌耐药折点[5],以肠杆菌中碳青霉烯类抗菌药物(亚胺培南或美罗培南)最低抑菌浓度(minimal inhibitory concentration,MIC)>2 mg/L(使用Phoenix-100 全自动细菌鉴定仪配套药敏板卡进行测定),同时K-B法复核美罗培南抗菌药物纸片抑菌圈直径≤14 mm为CRE纳入标准;使用Phoenix-100全自动细菌鉴定仪进行菌种鉴定,同时PCR扩增16S rRNA[6],随后将扩增产物及扩增引物送至上海生工生物公司使用ABI测序仪(3730xl DNA Analyzer)进行Sanger测序,并将测序结果与GenBank中序列进行比对,从而验证菌种。
回顾性收集2016年10月—2018年6月苏州大学附属第二医院分离保存的所有非重复CRE临床菌株共计70株,包括肺炎克雷伯菌47株、大肠埃希菌10株、产酸克雷伯菌8株、产气肠杆菌3株、阴沟肠杆菌和黏质沙雷菌各1株;其中46株(65.7%)分离自呼吸道,10株(14.3%)分离自泌尿道,5株(7.1%)分离自血液,5株(7.1%)分离自腹腔,4株(5.8%)分离自其他部位。
实验质控菌株均为本实验室保存菌株,其中碳青霉烯酶基因、ESBLs基因、外膜蛋白基因检测及药敏试验阴性质控菌为大肠埃希菌ATCC 25922;产碳青霉烯酶表型检测阴性质控菌为肺炎克雷伯菌ATCC BAA1706,阳性质控菌为肺炎克雷伯菌ATCC BAA1705;碳青霉烯酶基因检测阳性质控菌为肺炎克雷伯菌1192(blaKPC)、大肠埃希菌1202(blaNDM)、肺炎克雷伯菌2334(blaIMP)、霍氏肠杆菌0867(blaVIM)和肺炎克雷伯菌1923(blaOXA-48);ESBLs基因检测阳性质控菌为肺炎克雷伯菌1188(blaCTX-M)、肺炎克雷伯菌1182(blaTEM)和肺炎克雷伯菌1507(blaSHV);外膜蛋白基因检测阳性质控菌为肺炎克雷伯菌1320(ompK35)和肺炎克雷伯菌1208(ompK36);CAZ-AVI药敏试验阳性质控菌为大肠埃希菌1202。
1.2主要仪器与试剂 Phoenix-100全自动细菌鉴定仪及配套药敏板卡、琼脂糖凝胶核酸电泳仪、凝胶成像系统分析仪、实时荧光定量PCR扩增仪(美国Bio-Rad公司),PCR扩增仪(美国Applied Biosystems公司),NanoDrop 2000超微量分光光度计(美国Thermo公司),麦氏比浊仪(法国生物梅里埃公司);胰蛋白胨、酵母提取物、CAMHB肉汤(美国Oxoid公司),琼脂粉(美国VETEC公司),琼脂糖凝胶粉(西班牙BIOWEST公司),DL2000分子质量标准(日本TaKaRa公司),DNA纯化试剂盒(美国AXYGEN公司),美罗培南、头孢他啶(干粉,中国BIOSHARP公司),阿维巴坦(德国LKT公司),生理盐水、氯化钠、氯仿、异丙醇、甘油(国药集团),TRIZOL试剂(美国Ambion公司),RNA逆转录试剂盒(美国Thermo公司),SYBR Green PCR Master Mix(美国Applied Biosystems公司)。
1.3药敏试验
1.3.1临床常见抗菌药物敏感性试验 用Phoenix-100全自动细菌鉴定仪配套的革兰阴性菌药敏板测定CRE临床菌株对临床常见抗菌药物的MIC值。药敏结果根据CLSI[5]和EUCAST(莫西沙星)[7]标准进行判读。
1.3.2CAZ-AVI药物敏感性试验 用微量肉汤稀释法测定CAZ-AVZ对KPC-CRE的MIC值。用生理盐水调整待测菌悬液至0.5麦氏浊度单位,随后继续用生理盐水将上述菌悬液稀释30倍;用CAMHB液体培养基将CAZ原液(浓度为1 280 mg/L)倍比稀释至5 mg/L;取等体积AVI原液(浓度为160 mg/L)加入每个稀释的CAZ管中;用CAMHB液体培养基1∶10稀释每管CAZ-AVI;取等体积菌悬液加入每个稀释的CAZ-AVI管中,则最终药物浓度为32/4 mg/L、16/4 mg/L、8/4 mg/L、4/4 mg/L、2/4 mg/L、1/4 mg/L、0.5/4 mg/L、0.25/4 mg/L、0.125/4 mg/L[5]。以ATCC 25922为阴性对照(同时测定CAZ MIC值),以1202为阳性对照,以不加入药物组为生长对照,以不加入药物和菌株组为空白对照。将上述体系置于37 ℃培养16~20 h后,无细菌生长管的CAZ-AVI(或CAZ)最低浓度即其MIC。当阴性对照CAZ MIC≤0.5 mg/L且CAZ-AVI MIC≤0.5/4 mg/L、阳性对照CAZ-AVI MIC≥16/4 mg/L、生长对照管全部浑浊且空白对照管全部澄清时,待测菌CAZ-AVI MIC结果可信,药敏结果根据CLSI标准[5]进行判读。
本次研究采用已报道过的CAZ-AVI敏感性降低菌株MIC cut-off值[8],将CAZ-AVI MIC≥4/4 mg/L的菌株定义为CAZ-AVI敏感性降低菌株。
1.4产碳青霉烯酶表型检测 采用改良碳青霉烯酶灭活试验(mCIM),根据CLSI检测步骤[5],同时设置浸没于无菌TSB肉汤的美罗培南抗菌药物纸片和干燥的美罗培南抗菌药物纸片作为空白对照;设置浸没于肺炎克雷伯菌ATCC BAA1705菌悬液的美罗培南抗菌药物纸片为阳性对照;设置浸没于肺炎克雷伯菌ATCC BAA1706菌悬液的美罗培南抗菌药物纸片为阴性对照。对所收集的CRE菌株进行产碳青霉烯酶表型检测,检测结果根据CLSI标准[5]进行判读。
1.5耐药相关基因的检测 用PCR法扩增产碳青霉烯酶表型试验阳性CRE菌株中常见的碳青霉烯酶基因blaKPC、blaNDM、blaVIM、blaIMP和blaOXA-48。使用文献[9]中引物序列,委托上海生工生物工程公司进行引物合成。PCR反应体系共15 μL,包括模板DNA 2.0 μL,上、下游引物各0.5 μL,2×PCR mixture 7.5 μL,ddH2O 4.5 μL。PCR反应参数:95 ℃预变性5 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸60 s,35个循环;72 ℃延伸7 min。取3 μL PCR扩增产物行10 g/L琼脂糖凝胶电泳,用凝胶成像分析仪显影。当阴性对照泳道无条带,实验菌株泳道出现清晰单一且与阳性对照泳道位置相同的条带时即判为阳性。
随机选取5株CAZ-AVI MIC≤2/4 mg/L的ST11型KPC-KP菌株组成敏感对照组,用PCR法扩增CAZ-AVI敏感性降低菌株及敏感菌株中blaKPC、超广谱β-内酰胺酶(extended-spectrum β-lactamases,ESBLs)基因blaCTX-M、blaTEM和blaSHV以及外膜蛋白基因ompK35、ompK36。用文献[10-12]中引物序列,委托上海生工生物工程公司进行引物合成。PCR反应体系共15 μL,包括模板DNA 2.0 μL,上、下游引物各0.5 μL,2×PCR mixture 7.5 μL,ddH2O 4.5 μL。PCR反应参数:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸90 s,35个循环;72 ℃延伸7 min。电泳分析如上所述。
将扩增产物及扩增引物送至上海生工生物公司用3730xl DNA测序仪(ABI公司)进行Sanger测序,并将测序结果与GenBank中序列进行比对。
1.6多位点序列分型(multilocus sequence typing,MLST) 用PCR法扩增KPC-CRE中高度保守的管家基因,包括rpoB、gapA、mdh、pgi、phoE、infB、tonB(克雷伯菌属)和dnaA、fusA、gyrB、leuS、pyrG、rplB、rpoB(肠杆菌属细菌)。用文献[13-14]中引物序列,委托上海生工生物工程公司进行引物合成。PCR反应体系共15 μL,包括模板DNA 2.0 μL,上、下游引物各0.5 μL,2×PCR mixture 7.5 μL,ddH2O 4.5 μL。PCR反应参数:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,35个循环;72 ℃延伸7 min。采用上述Sanger测序的方法,序列结果上传至MLST数据库网站(http://pubmlst.org/)获得等位基因编号,组合等位基因编号进而查得序列分型(sequence type,ST)结果。
1.7CAZ-AVI敏感性降低菌株中blaKPC的相关检测
1.7.1blaKPC相对拷贝数 挑取5个CAZ-AVI敏感性降低KPC-KP单克隆菌落,组成敏感性降低实验组;以上述5株CAZ-AVI MIC≤2/4mg/L的KPC-KP菌株为敏感对照组;以rpoB为内参基因。煮沸法提取并处理菌株基因组[15];使用Primer 3.0软件设计blaKPC及rpoB特异性引物序列见表1,委托上海生工生物工程公司进行引物合成。用qRT-PCR扩增每株菌中blaKPC及rpoB基因,反应体系共20 μL,包括模板DNA 1 μL,10 μmol/L上、下游引物各1 μL,2×SYBR Green qPCR Mix 10 μL,ddH2O 7 μL。反应参数:95 ℃预变性30 s;95 ℃变性5 s,56 ℃退火/延伸5 s,35个循环。根据2-△Ct计算得到每株菌中blaKPC相对拷贝数。
1.7.2blaKPC相对表达量 用TRIZOL法提取上述2组菌株总RNA;用试剂盒中随机引物配制逆转录体系,使用PCR仪设置程序25 ℃ 5 min,随后42 ℃ 60 min,将RNA逆转录为cDNA;利用表1中特异性引物,根据1.7.1中反应体系及反应参数进行qRT-PCR。根据2-△Ct计算得到每株菌中blaKPC相对表达量。

表1 qRT-PCR引物
1.7.3blaKPC启动子分析 根据参考文献[16],参照GenBank中FJ628167序列,设计blaKPC的上游启动子区域引物KPCpro-F(5′-AACGGTCGTATCAGCG
ACAT-3′)和KPCpro-R(5′-CGAGTTTAGCGAATGGT
TCC-3′),委托上海生工生物工程公司进行引物合成。PCR扩增CAZ-AVI敏感性降低菌株中blaKPC的上游启动子区域,反应体系及反应参数与1.5中碳青霉烯酶基因检测相同,并采用1.5中所述方法进行Sanger测序及序列比对分析。
1.7.4统计学分析 用GraphPad Prism 5.0软件,每株菌作3组平行对照,blaKPC相对拷贝数和相对表达量以均数±标准差表示;采用Welch′st检验进行组间比较,以P<0.05表示差异有统计学意义。
2 结果
2.1CRE菌株对临床常见抗菌药物的药敏结果 所收集的CRE菌株对亚胺培南耐药率达98.6%,对美罗培南耐药率为81.4%,另外对本次研究检测的所有β-内酰胺类抗菌药物耐药率均较高(>80%),其中哌拉西林以及头孢菌素类抗菌药物耐药率>90%;此外,大多数CRE菌株(>90%)对β-内酰胺类/β-内酰胺酶抑制剂复合物耐药。见表2。多数CRE菌株(>60%)对氨基糖苷类和喹诺酮类抗菌药物耐药,但其耐药率较β-内酰胺类抗菌药物及β-内酰胺类/β-内酰胺酶抑制复合物耐药率低。
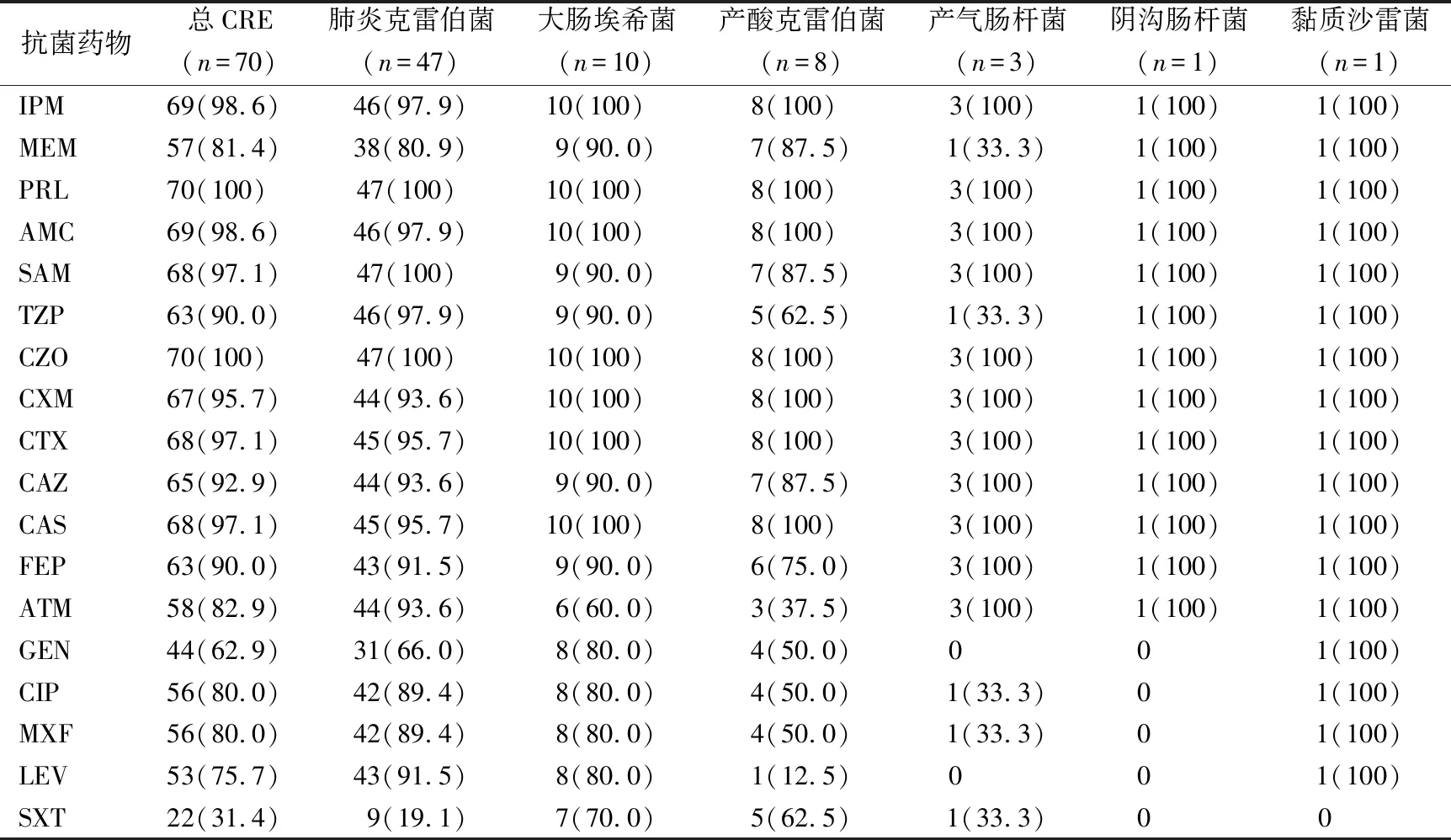
表2 CRE菌株对临床常见抗菌药物的耐药率[n(%)]
2.2CRE菌株产碳青霉烯酶表型检测 70株CRE菌株中有49株(70.0%)产碳青霉烯酶表型阳性,为产碳青霉烯酶肠杆菌(carbapenemase-producing Enterobacteriaceae,CPE)。其中42株抑菌圈直径为6 mm,其余7株抑菌圈直径为7~14 mm。CPE菌种分布见表3。
2.3产碳青霉烯酶表型阳性菌株中KPC-CRE菌株的筛选 PCR阳性扩增产物经Sanger测序及比对,结果显示正确率达100%。49株产碳青霉烯酶表型阳性菌株中,blaKPC阳性26株(占53.1%),即检测到KPC-CRE 26株,其中包括肺炎克雷伯菌25株(占96.2%)和产气肠杆菌1株(占3.8%),且上述菌株未同时携带金属类碳青霉烯酶基因。见表3。碳青霉烯酶基因检测部分电泳结果见图1。

表3 产碳青霉烯酶表型阳性CRE菌株碳青霉烯酶基因检测结果
2.4KPC-CRE菌株ST分型 经MLST测序比对,KPC-CRE中25株肺炎克雷伯菌分属于2种ST分型,其中ST11型23株(92.0%),ST12型2株(8.0%);1株产气肠杆菌属于ST418型。
2.5CAZ-AVI体外抑制KPC-CRE的MIC测定 KPC-CRE对CAZ-AVI的敏感率为100%(MIC≤4/4 mg/L),其中MIC50为1/4 mg/L,MIC90为2/4 mg/L。见表4。根据CAZ-AVI敏感性降低菌株MIC cut-off值(CAZ-AVI MIC≥4/4 mg/L),本次研究筛选出1株CAZ-AVI敏感性降低ST11型KPC-KP(MIC 4/4 mg/L)。

表4 CAZ-AVI对KPC-CRE MICs测定结果
2.6耐药相关基因检测 CAZ-AVI敏感性降低KPC-KP中携带野生型blaKPC-2以及2种ESBLs基因blaCTX-M-65和blaTEM-1,部分电泳结果见图2。此外,外膜蛋白基因ompK35/36均检测到突变,其中ompK35第82位A碱基缺失,造成早期移码突变,导致OmpK35在第63位氨基酸发生提前终止,最终导致OmpK35缺失;ompK36具有完整的编码框,但OmpK36第134位氨基酸后存在甘氨酸-天冬氨酸的插入(134-135 GD),最终导致OmpK36功能缺陷。
CAZ-AVI敏感KPC-KP中均携带野生型blaKPC-2以及数量不等的ESBLs基因,并且外膜蛋白基因型与CAZ-AVI敏感性降低KPC-KP相同。
2.7CAZ-AVI敏感性降低KPC-KP中blaKPC的相关检测 qRT-PCR结果显示,CAZ-AVI敏感性降低KPC-KP中blaKPC的相对拷贝数(3.167±0.011 8,n=5)为对照组(1.879±0.166 7,n=5)的1.69倍,差异有统计学意义(P=0.001 5);相对表达量(7.724±0.027 5,n=5)为对照组(2.624±0.182 9,n=5)的2.94倍,差异有统计学意义(P<0.000 1);PCR结合Sanger测序比对结果显示,CAZ-AVI敏感性降低KPC-KP中blaKPC-2启动子区域未检测到突变。
3 讨论
目前,中国是全球范围内CRE流行率较高的国家[17]。2018年全国细菌耐药监测网(CARSS)报告显示,近五年全国CRE检出率持续上升。其中,肺炎克雷伯菌检出率最高且持续增加,其检出率在2013年—2018年由4.9%上升至10.1%(http://www.carss.cn/)。肺炎克雷伯菌携带的主要碳青霉烯酶基因为blaKPC[1]。本次研究结果显示,本院CRE中检出率最高的同样为肺炎克雷伯菌(67.2%),其中主要为克隆性传播的ST11型KPC-KP。所收集的大多数CRE菌株对临床常用的抗菌药物耐药,因此临床治疗需要更优选择。
CAZ与AVI组合,能够明显扩大其抑菌活性范围。针对我国未接受过CAZ-AVI治疗的KPC-CRE菌株,有研究显示,CAZ-AVI的MIC50为2/4 mg/L,MIC90为4/4 mg/L[8]。而本次研究结果显示本院KPC-CRE对CAZ-AVI的MIC50为1/4 mg/L,MIC90为2/4 mg/L,均低于上述研究结果,且敏感率为100%,表明CAZ-AVI对本院分离的KPC-CRE菌株具有很强的抑制作用,提示临床可以将CAZ-AVI作为治疗KPC-CRE的新选择。
本次研究筛选出1株CAZ-AVI敏感性降低的KPC-KP,并且其携带的blaKPC-2中未检测到突变,提示存在其他机制导致菌株对抗菌药物敏感性下降。有研究显示,对CAZ的高水解活性及外膜蛋白OmpK35缺失会导致CAZ-AVI对菌株的MIC值升高[8]。在本次研究中,CAZ-AVI敏感性降低KPC-KP和CAZ-AVI敏感KPC-KP均携带ESBLs基因,并且合并外膜蛋白OmpK35的缺失及OmpK36的功能缺陷,因此提示敏感性降低的机制可能是blaKPC-2拷贝数和/或表达量增加。其中,blaKPC-2的高拷贝可能是由于菌株中携带多个编码blaKPC-2的质粒[18]或携带blaKPC-2的质粒中存在相关移动元件的多拷贝[19];blaKPC-2启动子区域未检测到突变,因此blaKPC-2的高表达量可能是blaKPC-2的高拷贝或其他调控机制。
综上所述,苏州大学附属第二医院分离的KPC-CRE主要为克隆性传播的ST11型KPC-KP;CAZ-AVI对未接受过该药物治疗的KPC-CRE具有很强的体外抑制作用,可为临床治疗相关细菌感染提供新的选择;blaKPC-2拷贝数和/或表达量增加可能会导致KPC-KP对CAZ-AVI敏感性降低。

