新型冠状病毒IgM/IgG抗体在病程监测中的临床意义*
李闻,郑宝璐,于爱萍,张维,张咏梅,刘广文,刘小畅,苏旭,李晓燕(天津市疾病预防控制中心病原生物实验室,天津 300011)
在国家卫生健康委员会发布的《新型冠状病毒肺炎诊疗方案(试行第七版)》中,新型冠状病毒肺炎(COVID-19)的确诊标准在原有核酸检测的基础之上增加了抗体检测[1]。理论上特异性IgM抗体升高通常提示急性感染,表明机体已经暴露于病原体,产生对急性感染的首次应答。IgM抗体多在发病3~5 d后开始出现阳性,一般存在2~3周,可用于感染的早期筛查。特异性IgG抗体升高通常提示既往感染。IgG抗体出现较IgM晚,可以存在较长时间,恢复期IgG抗体滴度较急性期有4倍及以上增高[2-3]。本研究基于链霉亲和素-磁微粒的间接法化学发光免疫分析技术,定量检测COVID-19患者血清/血浆样本中的新型冠状病毒(SARS-CoV-2) IgM和IgG抗体,评估特异性IgM和IgG抗体的临床应用价值。
1 材料和方法
1.1研究对象 收集2020 年1月20日至2020 年3月1日天津市疾病预防控制中心333例患者的血清样本(血清样本共360份),其中,疾病组包括COVID-19确诊患者88例(血清样本115份),男性38例,女性50例,平均年龄40岁;对照组245例(血清样本245份),男性130例,女性115例,平均年龄37岁。入组及排除标准:疾病组为核酸检测阳性;对照组为排除SARS-CoV-2感染的患者(核酸检测阴性)。
1.2试剂与仪器 新型冠状病毒IgM和IgG抗体检测试剂(磁微粒化学发光法,天津丹娜生物公司),新型冠状病毒2019-nCoV核酸检测试剂盒(荧光PCR法,上海伯杰公司);SMART 6500全自动化学发光测定仪(科斯迈公司),7500 FAST型荧光定量PCR仪(ABI公司)。
1.3标本采集 以COVID-19确诊患者开始出现临床症状(发热或咳嗽)计为发病。采集不同病程血清样本,包括早期(发病后1~7 d)血清样本38份,中期(发病后8~14 d)血清样本27份,后期(发病≥15 d)血清样本50份。其中有25例患者收集2~3个病程的血清样本进行SARS-CoV-2 IgM和IgG抗体的连续监测。
1.4方法 用磁微粒化学发光法检测SARS-CoV-2 IgM和IgG抗体,检测的抗原位点是SARS-CoV-2核衣壳蛋白和棘突蛋白,按试剂盒说明书进行操作,每次实验均同时检测阳性质控品和阴性质控品。计算待测样本的指数(I)=待测样本发光强度值/(阳性质控品发光强度值的平均值×0.2+阴性质控品发光强度值的平均值)。阳性质控品的I值为4.0~5.5,如I<1.0,则判定为阴性;如I≥1.0,则判定为阳性。
1.5统计学分析 用SPSS 24.0软件对资料进行正态性检验,用GraphPad Prism 7.0软件进行二项式数据拟合,计量资料组间比较采用秩和检验(Mann-WhitneyU检验)。以P<0.05为差异有统计学意义。
2 结果
2.1SARS-CoV-2 IgM和IgG抗体在COVID-19不同病程中的阳性率 SARS-CoV-2 IgM和IgG抗体检测对处于COVID-19病程早期的确诊样本阳性率为65.79%和52.63%,病程中期和后期的样本IgM和IgG抗体阳性率分别为92.59%、88.89%和96.00%、98.00%,见表1。
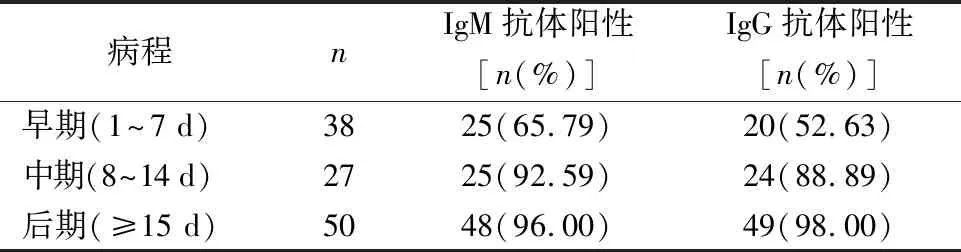
表1 IgM和IgG抗体检测在COVID-19不同病程中的阳性率
2.2SARS-CoV-2 IgM和IgG抗体及联合检测的临床检测性能 按照病例数统计分析抗体的临床检测性能,同一受试者不同病程的多个样本仅取一次阳性结果进行统计时,IgM和IgG抗体在COVID-19患者中检测的敏感性分别为90.91%(80/88)和88.64%(78/88),特异性均为100%。IgM和IgG抗体联合检测敏感性和特异性可高达96.59%(85/88)和100%,与核酸检测的总符合率为99.10%(330/333)。
2.3SARS-CoV-2 IgM和IgG抗体水平在不同病程间的比较 病程中期、后期IgM、IgG抗体水平(I值)与早期相比,差异均有统计学意义(P均<0.01),中期、后期之间IgG抗体水平差异有统计学意义(P<0.01),而中期和后期IgM抗体水平差异无统计学意义(P=0.086 6),见表2。

表2 不同病程间IgM和IgG抗体水平的比较
2.4COVID-19患者SARS-CoV-2 IgM和IgG抗体连续监测的临床价值 观察COVID-19患者IgM和IgG抗体水平动态变化,发现SARS-CoV-2 IgM抗体水平在患者32 d的病程中呈现先升高、后下降的趋势;而IgG抗体水平随着病程的发展逐渐升高,并长时间维持在一个较高的水平,见图1A。
对3个不同病程均有采样的2例患者进行IgM和IgG抗体水平分析,1号患者早期IgM和IgG抗体检测均为阴性,中期和后期为阳性,IgM抗体水平在中期最高,后期下降,而IgG抗体水平在后期显著升高。2号患者早期、中期、后期IgM和IgG抗体检测均为阳性,IgM和IgG抗体水平均呈缓慢升高,在中期和后期IgG抗体水平均高于IgM抗体,见图1B。
连续观察25例COVID-19患者IgM和IgG抗体水平随病程的变化趋势,7例患者在中期和后期进行了IgM抗体的检测,其中有4例患者IgM抗体水平在病程后期相比于中期呈下降的趋势,见图1C。25例患者IgG抗体水平在病程后期相比于早期和中期均呈上升的趋势,见图1D。
3 讨论
徐万洲等[4]研究SARS-CoV-2 IgM和IgG抗体对COVID-19检测的敏感性分别为70.24%和96.10%,特异性分别为96.20%和92.41%,抗体与核酸检测的总符合率为88.03%。其中,19例核酸阴性但临床诊断的COVID-19患者中,16例IgM抗体检测阳性,阳性率达84.21%,18例IgG抗体检测阳性,阳性率达94.74%。由此可见,抗体检测可以有效地弥补核酸检测的不足,两者联合检测提高检出率。在本研究中有4例患者在发病后1周内同时进行核酸和抗体检测,核酸检测均为阴性,但2例患者IgM抗体检测阳性,2例患者IgG抗体检测阳性。随后4例患者又进行1~3次不等的核酸复测,最后均核酸检测阳性,确诊为COVID-19。分析前期出现核酸多次检测阴性可能受检测窗口期、样本采集、运输、保存等因素影响。抗体联合检测可以有效地弥补核酸检测的局限性,显著提高COVID-19患者检测的敏感性。
Zhao等[5]观察核酸和抗体检测在COVID-19不同病程的临床价值,结果显示病程早期核酸检测的敏感性最高,达66.7%,而抗体检测敏感性仅有38.3%;在病程中期,IgM和IgG抗体检测的敏感性为73.3%和54.1%,高于核酸检测的敏感性54.0%;在病程后期,IgM和IgG的敏感性分别为94.3%和79.8%,相比之下,核酸检测的阳性率只有45.5%。本研究与其一致,COVID-19患者SARS-CoV-2 IgM抗体的阳性率在病程早期和中期为65.79%和92.59%,均高于IgG抗体阳性率(52.63%和88.89%),当COVID-19患者处于病程的后期时,IgG阳性率显著升高,达到98.00%。
进一步分析不同病程患者 IgM和IgG的抗体水平,结果显示IgM抗体水平在病程早期和中期呈上升趋势,在中期时I值最高(4.25±2.90),当病程进入后期,IgM抗体水平呈下降趋势,I值为3.23±2.20。而IgG抗体水平在病程早期、中期及后期呈逐渐升高的趋势,尤其在病程的后期时I值最高为9.22±4.62,与早期(0.94±0.7)相比呈现大于4倍以上升高。观察COVID-19患者32 d病程中IgM和IgG抗体水平的动态变化,发现SARS-CoV-2 IgM抗体水平呈现先升高、后下降的趋势;随着病程的发展IgG抗体水平逐渐升高,并可长时间维持在一个较高的水平。这与机体免疫应答规律相一致:IgM抗体先升高后降低,IgG抗体出现晚于IgM抗体,但可较长时间存在。3个不同病程均有采样的2例患者抗体水平分析结果提示,不同患者抗体产生可能存在差异,1号患者在病程早期无抗体产生,此时核酸检测更有价值,2号患者在病程早期就产生抗体,这可能因为患者临床症状不明显,实际病程要长于主诉病程,在入院时体内已产生抗体。本研究中有4例COVID-19患者IgG和IgM抗体检测始终为阴性,这可能与患者自身的免疫状态有关。COVID-19患者伴有免疫缺陷或低下(长期使用免疫抑制剂)时,抗体的产生可能会受影响,这些患者的诊断需结合临床和其他诊断方法综合考虑[6]。
目前,已获批的SARS-CoV-2 IgM和IgG抗体试剂盒主要包括胶体金法和化学发光法2种方法。武汉大学中南医院对化学发光法和胶体金法检测SARS-CoV-2特异性抗体进行了研究比较,发现化学发光法具有较高的临床特异性,能达到100%[7],这与本文的研究结果一致。
综上,SARS-CoV-2 IgM和IgG抗体化学发光法联合检测敏感性高,可作为COVID-19有效的辅助诊断,弥补核酸检测的不足。抗体与核酸联合检测可显著提高COVID-19患者的检出率,降低漏诊率,在病程监测和转归方面具有重要意义。

