马铃薯晚疫病菌卵孢子形成与萌发条件研究
张铉哲,姜 萌,陈 梅,周子豪,李媛媛,赵 雪,任雪琦,徐浩然,陈苏慧
(东北农业大学农学院,哈尔滨 150030)
马铃薯作为第四大粮食作物,已成为重要经济作物之一[1]。马铃薯晚疫病是影响马铃薯产量的严重病害之一[2-3],与其他病害相比,其危害程度和防治难度更大,是一种爆发急、可循环发生的毁灭性病害[4]。马铃薯晚疫病菌(Phytophthora infestans)是半活体营养型异宗配合卵菌,大多数为二倍体[5-6],而真菌以单倍体形式存在;卵菌细胞壁成分为葡聚糖、纤维素,无几丁质,真菌细胞壁共有成分为几丁质[7]。
马铃薯晚疫病存在有性生殖和无性繁殖两种生殖方式,田间多以无性繁殖方式为主[8],有性生殖方式为异宗配合,为完成有性生活史需正反交配型,即A1和A2[9],两种交配型同时存在可通过有性生殖发生基因重组[10]。在有性生殖阶段,A1和A2交配型晚疫病菌交配后产生厚壁球形卵孢子,卵孢子能在土壤和植物残体中越冬,在适宜条件下卵孢子萌发后侵染寄主[11],造成下一年种植季节马铃薯晚疫病发生与流行。因此研究马铃薯晚疫病菌卵孢子形成及萌发条件尤为重要。
有性生殖是马铃薯晚疫病菌生命周期的重要特征,也是引起马铃薯晚疫病因素之一[12]。当A1和A2交配型菌株同时存在时,两种菌丝体受激素刺激,菌丝顶端肿胀,分别分化为卵原细胞(产生雌配子)和雄器(产生雄配子),通过受精管雄配子进入卵原细胞,与雌配子核融合形成卵孢子[13]。卵孢子萌发产生游动孢子囊,随后释放游动孢子,游动孢子可渗入土壤,感染与土壤接触的茎和叶[14]。
卵孢子在其他疫霉菌引起的病害中也发挥重要作用,包括异宗配合卵菌引起的病害,如辣椒疫霉[15]和同宗配合卵菌引起的病害。卵孢子萌发时产生芽管,芽管生长到一定程度时产生单个孢子囊,孢子囊可产生芽管,芽管再次产生孢子囊,芽管可从雄器上产生,也可从藏卵器壁上产生,藏卵器内原生质逐渐流向芽管[16]。
卵孢子具有厚壁,可抵御寒冷、微生物降解或化学熏蒸等恶劣环境条件。Cohen等发现在一定温度范围内,马铃薯和番茄离体叶片上卵孢子数量随温度下降而增多,卵孢子在植物体内形成的最适温度为10℃,当温度过高时,卵孢子活性受抑制[17]。Han等将采集于甘肃地区的自育型晚疫病菌接种至马铃薯叶片上,30 d后在叶片上发现具有活力卵孢子,经MTT法染色发现接种叶片内产生的卵孢子有生物活性[18]。菌株组合、温度、湿度、寄主组织部位、寄主抗性水平等均影响卵孢子数量。
在国内外研究中,影响致病疫霉菌卵孢子萌发的重要条件有菌株组合、保存和培养时间、温度、光照、营养物质、化学处理和酶处理等。Stromberg等将无菌水和土壤浸出液以1∶10混合培养卵孢子,将其萌发率提高至16%[19]。KMnO4和H2O2均刺激卵孢子萌发,在卵孢子形成过程中,黑暗培养效果优于光照培养,在卵孢子萌发阶段,光照培养优于黑暗培养,蓝光培养显著促进卵孢子萌发[20]。Pittis等研究发现,在18℃条件下用NovoZym234处理卵孢子36 h以消解孢子囊,然后在无菌水中以白光为背景的蓝光,18℃、16 h条件下培养,萌发率达20.6%[21]。
马铃薯晚疫病在无性阶段可维持子代遗传稳定性,但近年来田间晚疫病菌交配型具有多样性,有性生殖发生几率极大提高,有性生殖产生的卵孢子为病原菌越冬主要形式,感染马铃薯晚疫病植株开始枯萎时,大量卵孢子进入土壤中越冬,次年播种季节,卵孢子作为初侵染源,在适宜条件下萌发产生孢子囊继续侵染马铃薯,加大晚疫病防治难度,且卵孢子萌发加速晚疫病群体变异,使群体结构更为复杂。研究马铃薯晚疫病菌卵孢子有助于深入了解晚疫病菌变异规律,为生产上防治及药剂开发等提供理论依据。因此,近年来卵孢子萌发研究成为植物病理学家关注的热点,但目前并未形成完整的体系,确定影响疫霉菌卵孢子萌发的因素。因此,本研究旨在探索卵孢子形成及影响其萌发条件,为深入研究晚疫病菌遗传变异规律及病害流行趋势提供理论基础。
1 材料与方法
1.1 供试培养基
马铃薯晚疫病菌培养采用20%番茄汁琼脂培养基和选择性培养基。
20%番茄汁琼脂培养基:200 mL蒸馏水,50 mL番茄汁,5 g琼脂,1.2 g碳酸钙。
选择性培养基:在20%番茄汁琼脂培养基基础上添加氨苄青霉素500 mg·L-1,利福平50 mg·L-1,万古霉素200 mg·L-1,匹马霉素100 mg·L-1,PCNB 35 mg·L-1,苯菌灵10 mg·L-1。
1.0%水琼脂培养基:在1 000 mL蒸馏水中加入10 g琼脂,121℃高温灭菌。
RSA(黑麦培养基)配方为:称取60 g黑麦,洗净后加入适量蒸馏水,榨汁机榨成糊状,双层纱布过滤,收集滤液,加水定容至1 000 mL,倒入锅中,加入20 g蔗糖和20 g琼脂,分装于锥形瓶中,121℃高温灭菌。
1.2 供试菌株
本试验所用马铃薯晚疫病菌均采集于黑龙江省[克山(KS)、依安(YA)],内蒙古[牙克石(YKS)、室韦(SW)]等地。本试验中卵孢子形成、活力和萌发中所用供试菌株表现型(瑞毒霉敏感性、交配型)和基因型(mtDNA单倍型、SSR基因型)信息见表1。

表1 马铃薯晚疫病菌株基因型和表现型Table 1 Genotype and phenotype of Phytophthora infestans
1.3 不同处理对卵孢子活力的影响
1.3.1 卵孢子收集
选择不同交配型、瑞毒霉抗性、mtDNA单倍型、SSR基因型菌株对峙培养。
将同一时间在番茄培养基上活化培养的A1、A2交配型菌株,21℃黑暗条件下培养10 d后,分别用灭菌蓝色枪头沿菌丝边缘打孔,将两菌株菌饼接种至同一番茄培养基上,菌饼间隔2 cm,21℃黑暗条件培养。
取两菌株菌落交界处(菌丝融合区域)培养基块(4 cm×2 cm),灭菌刀刮除其表面菌丝,并放入灭菌小烧杯中,加入20 mL无菌水,高速匀浆机匀浆3 min,匀浆依次经孔径为76 μm(200目),40 μm(300目)、20 μm(600目)尼龙网过滤,20 mL无菌水冲洗孔径为20 μm(600目)尼龙网于小烧杯中,收集卵孢子。
1.3.2 卵孢子活力测定
MTT染色法:MTT是活体染色剂,利用活细胞琥珀酸脱氢酶将MTT染色剂还原为不可溶性甲瓒,根据所呈现颜色反映活细胞代谢水平。若卵孢子已进入萌发期,则被染成蓝色;若卵孢子存活,但处于休眠期,则被染成玫瑰红或紫色;若卵孢子无活力,则被染成黑色或不被染色。
将收集的卵孢子悬浮液与0.05%MTT溶液1∶1混合,在36℃下培养48 h,电子显微镜下观察,统计不同颜色卵孢子数量,计算卵孢子活力率,每个菌株组合统计3次数据。
1.3.3 培养时间对卵孢子活力的影响
综合各菌株组合菌落融合情况,分别于15、18、21和24 d后收集卵孢子,测定卵孢子活力及数量。
1.3.4 菌株组合对卵孢子活力的影响
选择不同交配型,不同瑞毒霉抗性,不同mtDNA单倍型和SSR基因型菌株作为亲本,测定不同菌株组合培养15 d后产生的卵孢子数量和活力。
1.3.5 卵孢子保存温度及保存时间对卵孢子活力的影响
取1 mL卵孢子悬浮液(菌株组合对峙培养15 d)测定卵孢子活力,并将剩余卵孢子悬浮液分别置于-20、4、21℃冰箱内保存,分别于0、15和30 d后测定卵孢子活力。
1.4 不同复合处理对卵孢子萌发的影响
1.4.1 Novozyme 234消解孢子囊
将0.005 g·mL-1Novozyme 234溶液与卵孢子悬浮液(菌株组合对峙培养15 d)等量混合,21℃恒温箱中静置36 h,以消除卵孢子悬浮液中混有的菌丝和孢子囊。
1.4.2 不同浓度H2O2及混合培养时间对卵孢子萌发的影响
将经Novozyme 234处理的卵孢子悬浮液离心(8 000 r·min-1)10 min,弃上清,加入适量无菌水,反复离心3次(去除残留的Novozyme 234),将最终获得的卵孢子悬浮液,分别与0.3%、0.5%、0.7%H2O2溶液于离心管中等量混合,将混合后卵孢子悬浮液放入21℃恒温箱中,16 h交替蓝光培养。分别于5、10和15 d后MTT染色,统计蓝色卵孢子(卵孢子已度过休眠期)比率。
1.4.3 混合培养基质对卵孢子萌发的促进作用
在多年栽培马铃薯的大田中收集马铃薯根际土壤,将土壤过滤后与蒸馏水等量混匀,摇床上振荡23.5 h(135 r·min-1)静置0.5 h,经尼龙网粗过滤,再滤纸过滤,收集滤液。将滤液分别与蒸馏水和黑麦培养基以1∶1混合,分别加入琼脂粉(含量为混合溶液总量1.0%),高温灭菌,分别作为培养基质①、②。收集马铃薯根、茎和叶,分别将根、茎、叶与蒸馏水1∶10混合,榨汁机榨浆,经尼龙网粗过滤,再滤纸过滤,收集滤液。将根、茎和叶滤液以2∶1∶1混合后,分别与蒸馏水和黑麦培养基以1∶4混合,加入琼脂粉(含量为混合溶液总量1.0%),高温灭菌,作为培养基质③、④。琼脂含量为1.0%水琼脂培养基和黑麦培养基分别作为培养基质⑤、⑥。以上混合培养基制作方法参照文献[22]。
将与0.7%H2O2溶液1∶1混合的卵孢子,21℃16 h交替蓝光培养5 d后,将卵孢子悬浮液离心(8 000 r·min-1)10 min,弃上清,加入适量无菌水,反复离心3次(洗净残留的H2O2),调节卵孢子悬浮液浓度为100个·mL-1,将上述6种培养基分别倒入培养皿中,将每皿划分为10个区域,每个区域滴入10 μL卵孢子悬浮液,并用涂布器涂匀,倒置显微镜镜检,标记卵孢子位置,每个处理10次重复。21℃16 h交替蓝光培养,待卵孢子萌发长出菌落后,调查其萌发率。
2 结果与分析
2.1 培养时间对卵孢子活力的影响
测定黑暗条件下,在培养基上不同交配型对峙培养15、18、21和24 d后卵孢子数量及活力(见表2)。测定结果表明,不同菌株组合和自育型菌株产生卵孢子的数量和活力均不同,但卵孢子数量和活力变化趋势接近。随培养时间延续,卵孢子数量逐渐增多,但卵孢子活力逐渐下降。
此测定过程中,显微镜观察MTT染色后卵孢子中,有紫色、豆沙红、黑色卵孢子及未被染色的卵孢子(见图1),未发现蓝色卵孢子。
以上结果说明所测定卵孢子存活但处于休眠期。在黑暗条件下,A1和A2交配型菌株对峙培养15 d后卵孢子活力最高,培养24 d后卵孢子活力下降显著。下一步试验中统一收集对峙培养15 d卵孢子悬浮液,对其复合处理,以提高卵孢子萌发率。
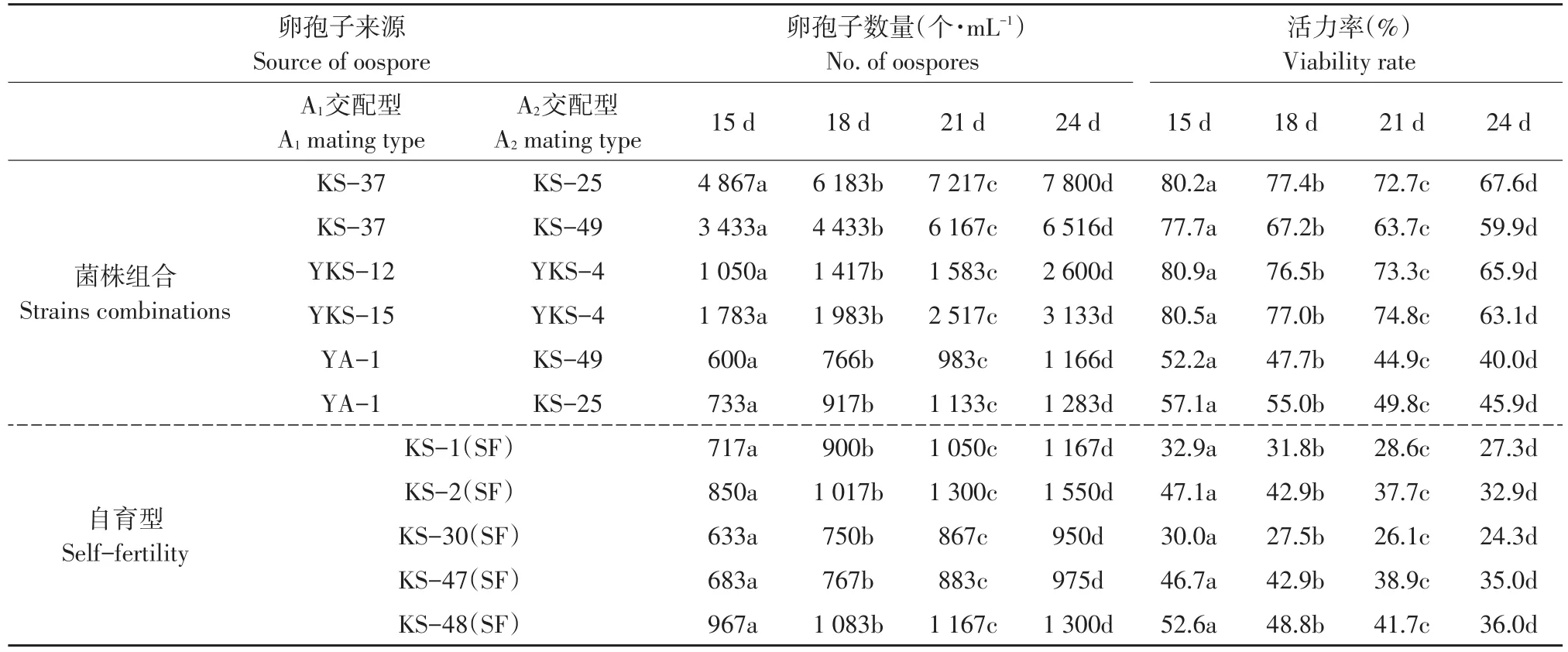
表2 不同菌株组合对峙培养产生卵孢子的数量与活力Table 2 Number and viability of oospores produced by different combinations of Phytophthora infestans strains
2.2 菌株组合对卵孢子活力的影响
测定不同菌株组合培养15 d后产生的卵孢子数量和活力(见表3)。测定结果表明,在相同条件下培养,不同菌株组合产生的卵孢子数量和活力差异较大,活力率0~80.9%,卵孢子数量0~4 867个·mL-1,同一菌株组合卵孢子数量与活力之间无相关性。产生卵孢子活力最高菌株组合为YKS-12×YKS-4,对峙培养15 d后活力率达80.9%。在所有供试菌株中,仅发现5个自育型菌株,自育型菌株产生的卵孢子活力普遍较低。菌株培养15 d后,卵孢子活力率最高达52.6%(见表2)。
综合以上结果,选择菌株组合KS-37×KS-25、KS-12×KS-49、KS-37×KS-49、YKS-12×YKS-4,YKS-15×YKS-4,自育型菌株KS-2、KS-48。分别收集每对菌株组合对峙培养15 d后及自育型菌株培养15 d后产生的卵孢子,用于下一步萌发试验。
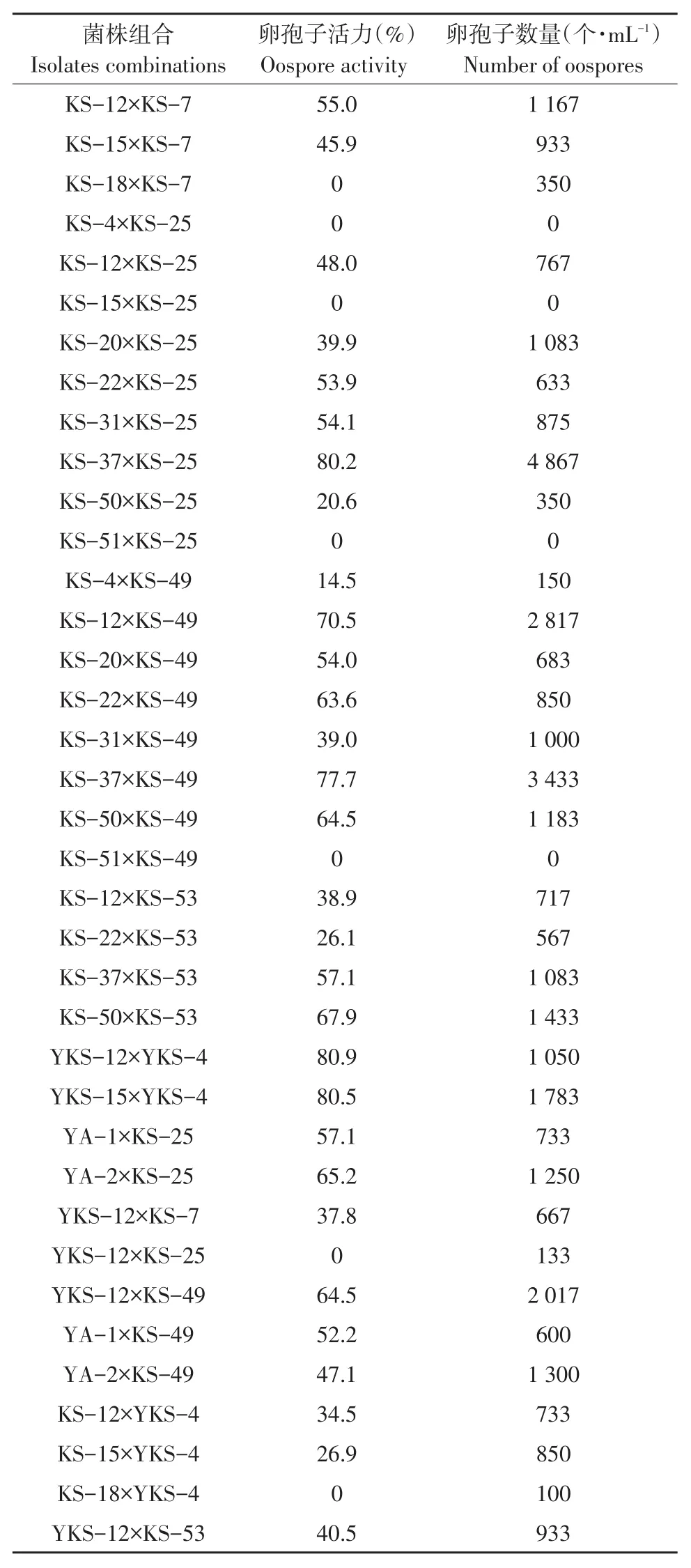
表3 菌株组合对峙培养15 d后卵孢子活力及数量测定Table 3 Strain combinations were used to determine activity and the number of oospores cultured for 15 d
2.3 保存温度及保存时间对卵孢子活力的影响
测定不同温度下YKS12×YKS4杂交组合产生的卵孢子活力(见图2),结果表明,0~15 d,卵孢子活力随保存时间延续而下降,15~30 d,卵孢子活力随保存时间延续而上升。-20、4、21℃保存15 d后,与对照相比(0 d),卵孢子活力均下降,-20、4、21℃保存的卵孢子活力率依次下降9.9%、26.6%、28.0%,且卵孢子仍处于休眠期,相比之下,-20℃保存15 d后卵孢子活力最高,21℃保存的卵孢子活力下降最多。30 d后,仍是-20℃保存的卵孢子活力最高,与对照相比(0 d),-20℃保存的卵孢子活力提高11.2%,但未发现度过休眠期的卵孢子,4℃保存的卵孢子活力比-20和21℃保存的卵孢子活力低且卵孢子均处于休眠期,21℃保存30 d的卵孢子活力略低于0 d卵孢子活力,但部分卵孢子进入萌发期。与保存15 d后卵孢子相比,3个温度保存30 d的卵孢子活力均显著提高。
综合以上结果,-20℃可保持卵孢子活力,21℃培养可促进卵孢子进入萌发期。因此,获得卵孢子后可放置-20℃冰箱里保存,处理后用于萌发的卵孢子可放置21℃恒温箱里培养。
2.4 不同复合处理对卵孢子萌发的影响
2.4.1 不同浓度H2O2溶液对卵孢子萌发的促进作用
不同浓度H2O2溶液对卵孢子萌发的促进作用结果见表4。采用MTT染色法,对不同浓度H2O2溶液处理后卵孢子作MTT染色,进入萌发期卵孢子经MTT溶液染色后变为蓝色(见图3A)。结果表明,不同浓度H2O2溶液打破卵孢子休眠,卵孢子进入萌发期比率随H2O2溶液浓度增加而提高,21℃蓝光培养5 d后,0.3%H2O2溶液对卵孢子萌发无促进作用,0.7%H2O2溶液对卵孢子萌发促进作用最佳,与对照相比,卵孢子进入萌发期比率最高可增至95.9%,且部分卵孢子在0.7%H2O2溶液作用下,细胞壁变薄(变为1层),原生质外流,部分卵孢子在雄器上产生芽管(见图3B)。随培养时间延续,0.3%和0.5%H2O2溶液对卵孢子促进作用略增加,但0.7%H2O2溶液对卵孢子萌发具有促进作用,H2O2溶液对不同菌株组合卵孢子促进作用不同,对KS-37×KS-25卵孢子促进作用最佳。
综合以上结果,本试验将0.7%H2O2溶液与卵孢子悬浮液1∶1混合,21℃蓝光条件下培养5 d,再作下一步萌发处理。

表4 不同浓度H2O2及处理时间对不同杂交组合和自育型菌株产生的卵孢子萌发的影响Table 4 Effects of germination of different concentration and treatment time of H2O2to oospores produced by cross of different hybrid combinations and self-fertility strains of Phytophthora infestans
2.4.2 混合培养基质对卵孢子萌发的促进作用
培养基中琼脂粉含量为1.0%,为卵孢子萌发提供充足水分,与对照(培养基⑤、⑥)相比,混合培养基对于提高卵孢子萌发率效果显著,萌发率测定结果表明(见表5),土壤和组织浸出液均为卵孢子萌发提供所需营养物质,优于琼脂培养基促进作用,其中土壤浸出液与黑麦培养基以1∶1混合的培养基对卵孢子萌发促进效果最佳,最高萌发率为19%,与杂交组合产生的卵孢子相比,自育型菌株产生的卵孢子萌发率相对较低。
不同菌株组合杂交产生的卵孢子萌发率不同,部分菌株组合卵孢子即使经一系列萌发处理卵孢子仍未萌发,如菌株组合KS-12×KS-49,自育型菌株KS-2,菌株组合KS-37×KS-49、YKS-15×YKS-4萌发率虽有所提高,但卵孢子萌发后成活率较低,后代菌丝生长薄弱,无法开展下一步研究。
以上研究结果显示,菌株组合对卵孢子萌发的影响较大,筛选优势菌株组合也是提高卵孢子萌发率的关键。
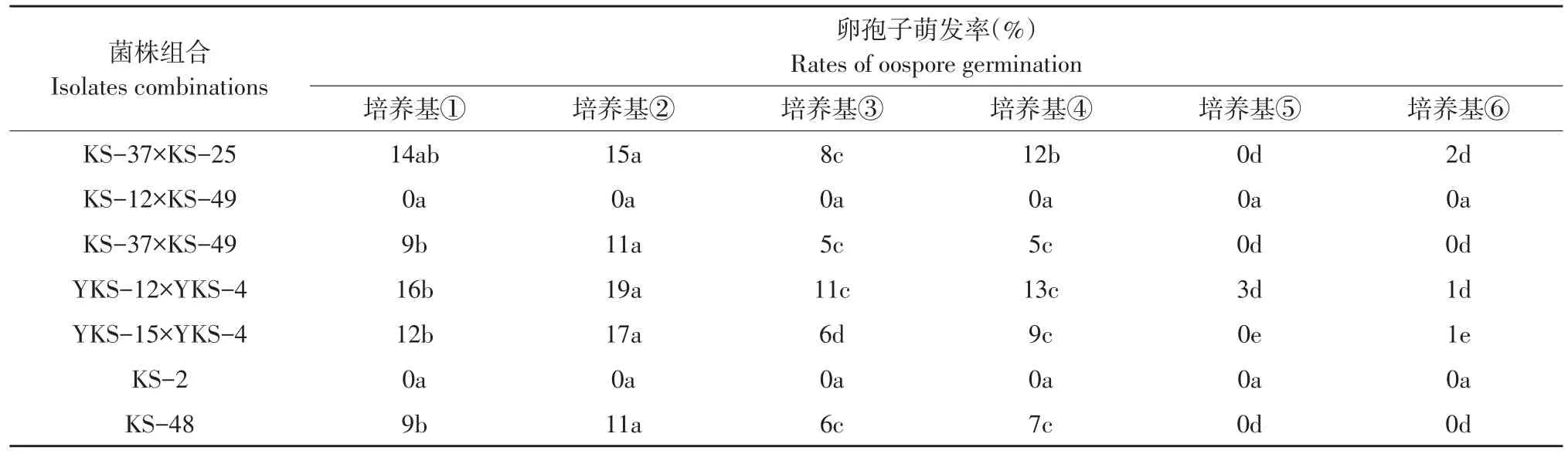
表5 不同菌株组合在混合培养基上的卵孢子萌发率Table 5 Oospore germination rates of different strain combinations on mixed medium
3 讨论与结论
本试验在卵孢子形成过程研究中,采用MTT染色法分别测定马铃薯晚疫病菌培养时间、菌株组合、保存温度及保存时间对卵孢子活力的影响,计算卵孢子活力率。试验结果表明,不同菌株组合和自育型菌株产生的卵孢子数量和活力均不同。随杂交时间延续,卵孢子数量逐渐增多,但卵孢子活力逐渐下降。菌株组合对峙培养15 d或自育型菌株培养15 d后,卵孢子活力最高。卵孢子活力率随培养时间延续而降低,与杨芮等测定晚疫病菌卵孢子活力趋势一致[23]。不同菌株组合产生的卵孢子活力不同,与Median等研究结果一致[24]。梁静思等认为这种差异源自A2交配型亲本的差异性[25]。在活力测定过程中并未发现被染成蓝色的卵孢子,方志国研究中发现相同现象[26],并认为这与培养时间短,或者卵孢子活力随培养时间延续而完全失去活力有关。
在卵孢子萌发条件探索试验中,试验结果表明不同温度对卵孢子活力影响不同,在0~15 d,卵孢子活力随培养时间延续而下降,在15~30 d,随培养时间延续,卵孢子活力升高,-20℃可保持卵孢子活力,21℃培养可促进卵孢子进入萌发期。土壤和组织浸出液配制而成的混合培养基均促进卵孢子萌发,其中土壤浸出液与黑麦培养基以1∶1混合而成的培养基对卵孢子萌发促进作用最佳,卵孢子最高萌发率为19%。卵孢子悬浮液分别置于-20、4、21℃条件下培养0~15 d,卵孢子活力随时间推移显著下降,与Mayton等结果一致[27]。H2O2溶液促进卵孢子进入萌发期,卵孢子进入萌发期比率随H2O2溶液浓度增大而提高,这表明H2O2打破卵孢子休眠,与张艳菊等研究结果一致[28],卵孢子经0.7%H2O2溶液处理后,卵孢子进入萌发期比率最高可达95.9%。卵孢子萌发率和菌株组合密切相关,与Pittis等报道一致[21]。土壤和组织浸出液配制而成的混合培养基均促进卵孢子萌发,其中土壤浸出液与黑麦培养基以1:1混合而成的培养基对卵孢子萌发促进作用最佳,通过一系列复合处理,卵孢子最高萌发率为19%,与杂交组合产生的卵孢子相比,自育型菌株产生的卵孢子萌发率相对较低。不同菌株组合对卵孢子形成、活力及萌发均有影响,主要原因是在本试验所用亲本菌株活力和不同交配型菌株之间亲和性密切相关。但这种影响与亲本菌株基因型间无相关性。
综上所述,研究明确培养时间、菌株组合、保存温度及保存时间、不同浓度H2O2溶液、混合培养基质等因素对马铃薯晚疫病菌卵孢子形成及萌发的影响,为进一步开展晚疫病菌遗传变异奠定基础。

