副鸡禽杆菌外膜囊泡的生物学活性分析
梅 晨 , 孙爱华 , 李淑芳 , 龚玉梅 , 王宏俊
(北京市农林科学院畜牧兽医研究所 畜禽疫病防控技术北京市重点实验室 , 北京 海淀 100097)
副鸡禽杆菌(Avibacteriumparagallinarum, Apg)是鸡传染性鼻炎(IC)的病原[1],为革兰阴性菌,主要引起育成鸡生长停滞及蛋鸡产蛋率下降[2],给养鸡业造成了重大经济损失[3]。目前控制鸡传染性鼻炎的方法主要是采用全菌灭活疫苗[4-6]配合抗生素治疗或预防的综合措施。
外膜囊泡(Outer membrane vesicles,OMVs)是细菌特有的一种生理结构,革兰阴性菌及少量革兰阳性菌都可以产生OMVs[7]。OMVs是一种双层膜球状囊泡状结构,其大小在20~250 nm[8]。OMVs在细菌的生长、生存、毒力等生理活动中扮演重要角色,由于OMVs不能复制且含有脂多糖、外膜蛋白、磷脂及少量DNA等成分,能有效激活免疫系统,被认为是极具潜力的新型疫苗之一[8],但其作用机制尚不明确。本试验拟探讨副鸡禽杆菌外膜囊泡的相关生物活性,为鸡传染性鼻炎新型疫苗研究奠定基础。
1 材料与方法
1.1 菌种 副鸡禽杆菌A型hp8株, B型BJ株和C型668株由本实验室保存。
1.2 囊泡的提取及纯化 常规兼性厌氧条件下培养hp8株副鸡禽杆菌,挑取单菌落于TSB培养基中,37 ℃温箱震荡厌氧培养12 h,按1∶50转接,37 ℃温箱震荡厌氧培养4~6 h,4 ℃,8 000 r/min离心10 min。取上清,0.45 μmol/L滤膜过滤,4 ℃,35 000 r/min超速离心3 h,弃上清。用2 mL 20 mmol/L的Tris-HCl缓冲液 (pH值7.5)重悬沉淀,存放于-20 ℃。即为粗提的外膜囊泡。
用HEPES溶液将Optiprep配置成不同梯度浓度(60%、40%、35%、30%、25%、20%),取上述粗提外膜囊泡与60%的Optiprep溶液按1∶3体积比稀释至45%,吸取2 mL置于离心管底部,再依次加入上述40%及更低浓度的Optiprep溶液各 2 mL。4 ℃,35 000 r/min离心3 h。离心后吸取肉眼可见的黄色层,即为目标囊泡所在溶液。重悬富含囊泡溶液样品于10倍体积DPBSS,4 ℃,35 000 r/min离心3 h,去除溶液中Optiprep,以2 mL的DPBSS悬浮囊泡,即为纯化的外膜囊泡。BCA法计算OMVs的浓度,透射电镜观察其形态及结构。
1.3 OMVs对HD-11细胞NO生成量的影响 一氧化氮(Nitricox-ide,NO)是一种生物信使分子,其生成依赖于诱导型一氧化氮合酶(Inducible nitric oxide synthase,iNOS),在抵抗入侵的细菌、真菌等微生物及在炎症反应中起着十分重要的作用[10-11]。试验分为OMVs处理组(5 μg/mL)和对照组,两组细胞分别在处理后24 h、48 h时取培养上清液,根据NO试剂盒说明书操作步骤及计算公式[12],测定并计算各组OD550值,利用SPSS比较各组NO产生水平。
1.4 荧光定量PCR(qPCR)检测OMVs对HD-11细胞相关炎症因子表达的影响 在25 cm2培养瓶中常规培养鸡巨噬细胞(HD-11),使细胞生长至85%。6瓶细胞分为囊泡组、脂多糖(LPS)组和对照组,每组2瓶。囊泡组加入5 μg OMVs,脂多糖组加入1 μg/mL LPS, 对照组不做任何处理,之后共培养24 h和48 h。分别用TRIzol法提取细胞总RNA[9],溶于20 μL DEPC水。反转录按照说明书进行,具体反应体系如下:RNA 1 μg,随机引物1 μL,5×M-MLV TR Buffer 4 μL,核糖核酸酶抑制因子1 μL,M-MLV反转录酶1 μL,dNTP(2.5 mmol/L)8 μL。混匀后按以下程序进行反转录:42 ℃ 50 min,70 ℃ 15 min,反应结束后立即置于-20 ℃保存备用。
根据GenBank上鸡炎症因子相对保守区域序列,用Primer 5软件设计基因的特异性上下游引物(见表1),并由生工生物工程(上海)股份有限公司合成。反应体系如下:1 μL cDNA,上、下游引物各1 μL,12.5 μL Brilliant SYBR Green QPCR Master Mix,0.375 μL ROX,9.125 μL DEPC水。反应条件:95 ℃预变性 10 min; 95 ℃变性 30 s,60 ℃退火1 min,72 ℃延伸60 s,循环40次;72 ℃再延伸8 min。 溶解曲线反应条件如下:95 ℃ 1 min,58 ℃ 30 s,95 ℃ 30 s。所有试验组样本重复3次独立试验,利用SPSS比较各组炎症因子水平。
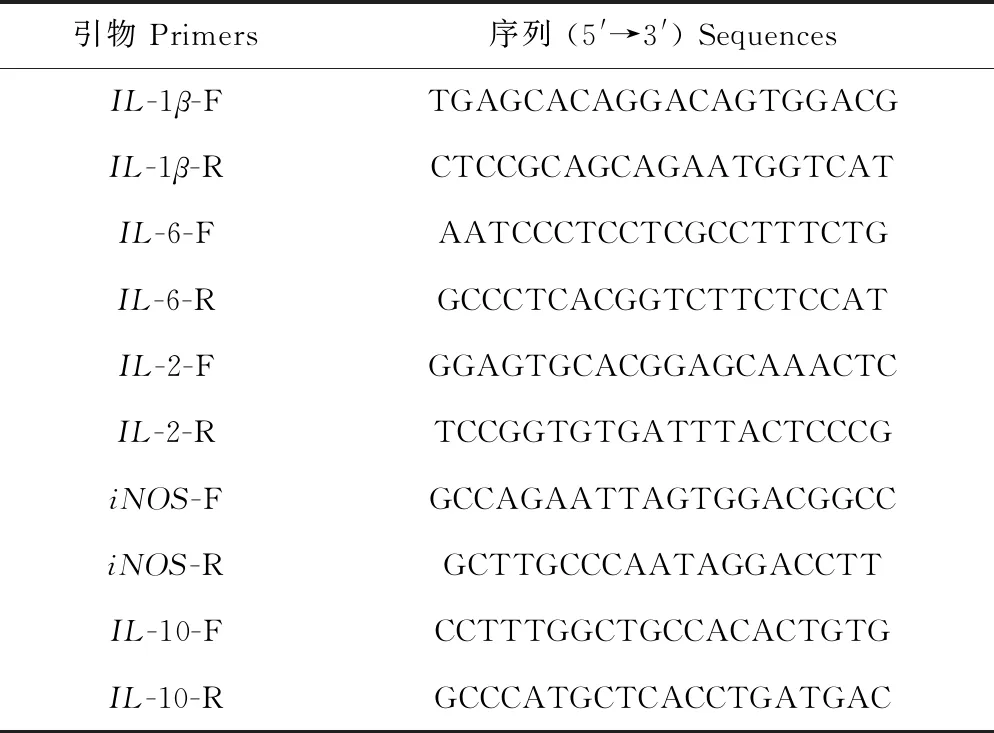
表1 相关炎症因子引物序列
1.5 OMVs疫苗的制备与免疫 纯化的OMVs与MONTANIDETMISA 71 VG佐剂(SEPPIC公司产品)按3∶7的质量比(抗原∶佐剂)混合乳化,所制备的疫苗命名为V-OMVs-A,其中OMVs蛋白浓度为100 μg/mL。将42日龄SPF试验鸡分为OMVs免疫组(30只)和PBS对照组(30只)。OMVs组试验鸡胸部肌肉注射V-OMVs-A疫苗,0.5 mL/只,间隔2周后二免;对照组接种PBS替代OMVs后制成的疫苗,0.5 mL/只,间隔2周后再同剂量接种1次。
1.6 血清IgG的测定 首次免疫后每周进行鸡静脉窦采血并分离血清,根据参考文献[13],采用间接ELISA测定抗OMVs的血清IgG抗体水平;将全菌抗原用包被液稀释至1 μg/μL,包被于96孔酶标板,4 ℃过夜,以1∶100稀释的血清作为一抗,1∶10 000稀释的山羊抗鸡IgG-HRP (Sigma公司)作为二抗,通过TMB底物显色测定OD450值。
1.7 免疫保护试验 二免4周后,试验鸡分别用3个血清型的副鸡禽杆菌眶下窦接种攻击。A型(hp8株)、B型(BJ株)和C型(668株),剂量依次为A型5×105CFU/0.2 mL,B型2×105CFU/0.2 mL,C型5×105CFU/0.2 mL。连续观察1周,记录试验鸡的临床发病情况,包括流鼻涕、眼睑肿、溢泪等。
2 结果
2.1 外膜囊泡电子显微结构 以乙酸双氧铀负染后,用透射电镜观察外膜囊泡形态。经BCA方法测得提取的外膜囊泡的蛋白质浓度为1.03 mg/mL,结果如图1和图2所示:可见多数形态呈现圆球状,有膜状结构,OMVs直径介于20~300 nm。

图1 副鸡禽杆菌(Apg)及其外膜囊泡(OMN)
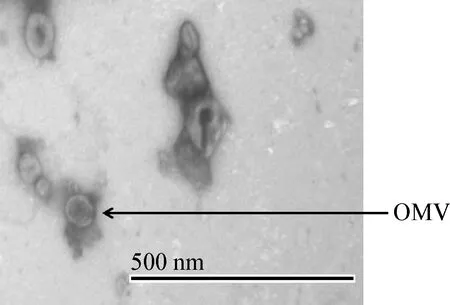
图2 纯化的副鸡禽杆菌外膜囊泡
2.2 OMVs对HD-11细胞NO生成量的影响 结果如图3可知,24 h时OMVs组生成的NO量急速增加,为10.5 μmol/L;而对照组生成的NO量为2.5 μmol/L,差异极显著(P<0.01)。48 h时,OMVs组生成的NO量为11 μmol/L,对照组NO量为4 μmol/L,差异极显著(P<0.01)。表明OMVs可以刺激HD-11细胞产生NO,且随时间推移生成量有所增高。
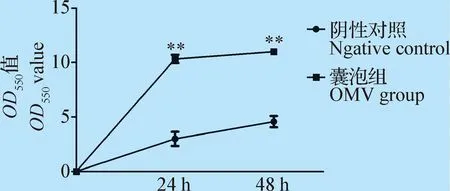
图3 OMVs作用不同时间对HD-11细胞NO生成影响
2.3 q-PCR检测多因子的表达 结果如图4所示,24 h时,与对照组相比,IL-1β、IL-10、iNOS囊泡组及脂多糖组差异极显著(P<0.01),IL-6囊泡组与对照组相比差异显著(P<0.05),脂多糖组与对照组相比差异极显著(P<0.01),IL-2囊泡组与对照组相比差异显著(P<0.05)。48 h时,以上5种细胞因子囊泡组及脂多糖组与对照组相比,均差异极显著(P<0.01)。
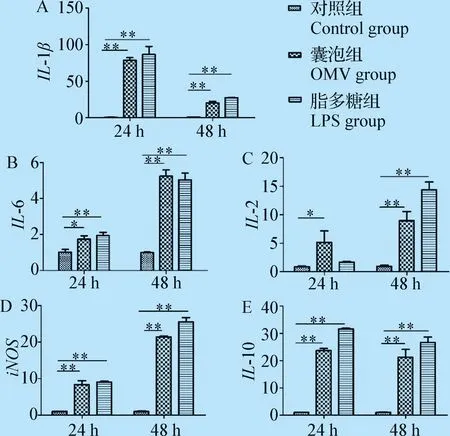
图4 OMVs影响HD-11细胞相关炎症因子表达
2.4 血清IgG抗体水平的测定 二免后第4周分别测定各组鸡血清IgG水平,结果如图5所示,OMVs免疫组的IgG抗体水平极显著高于对照组(P<0.01),推断OMVs免疫鸡后可刺激机体产生较强的体液免疫。

图5 OMVs对鸡血清IgG抗体水平的检测结果
2.5 OMVs免疫保护试验 二免后第4周,试验鸡用副鸡禽杆菌A、B、C三个血清型强毒攻击,结果显示,对照组所有的试验鸡陆续发病,都表现出严重的鼻炎症状,发病率为100%。OMVs组A型攻毒后仅有3只试验鸡表现出鼻炎症状,保护率为7/10,B型及C型攻毒保护率分别为1/10和3/10,提示囊泡免疫原性具有型特异性(表2)。
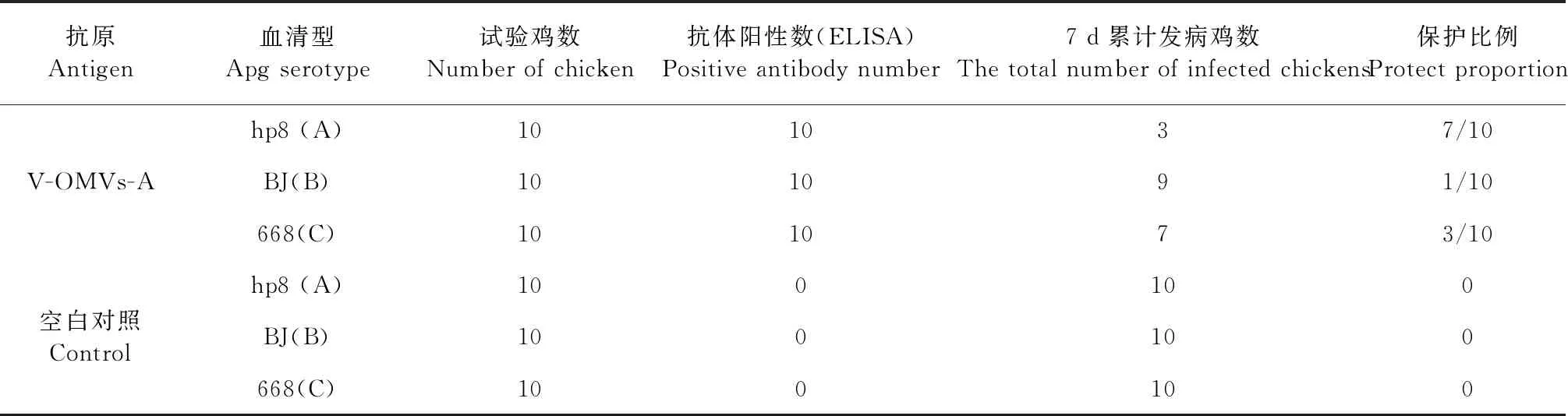
表2 免疫鸡对Apg菌株攻毒的保护效果
3 讨论
外膜囊泡(OMVs)是革兰阴性菌普遍存在的一种生理结构,部分革兰阳性菌也会产生。对副鸡禽杆菌的OMVs各个方面的研究还不够深入,目前仍处于探索的过程中。本文通过提取、纯化副鸡禽杆菌A型菌(hp8)外膜囊泡OMVs,探索其对鸡巨噬细胞HD-11相关炎症因子表达的影响。NO作为一类小分子细胞调节因子,在炎症反应过程中发挥重要的指示作用。结果显示,OMVs与HD-11细胞共培养后,细胞产生NO的水平极显著升高,提示OMVs可增强HD-11细胞免疫活性。生成的NO可以进一步促进巨噬细胞释放IL-6和TNF-α等炎性因子,增强细胞免疫反应。IL-lβ、IL-6等主要由巨噬细胞释放,通过qPCR检测相关炎症因子的表达,结果显示,OMVs可促进HD-11细胞IL-1β、IL-2、IL-6、IL-10、iNOSmRNA表达升高,提示巨噬细胞被极显著激活,能够明显促进炎症反应[14]。另外,囊泡组血清IgG与对照组相比差异显著,说明OMVs可以调节鸡体液免疫。攻毒保护试验结果显示,OMVs免疫后能够提高鸡对副鸡禽杆菌攻击的耐受力,表明该OMVs含有部分关键保护性抗原成分。
目前,已有研究探索了多种细菌OMVs作为亚单位疫苗候选抗原的可行性[15],本研究也进行了初步尝试。攻毒试验结果显示,A型副鸡禽杆菌的OMVs接种后的鸡只可以产生较好的免疫保护作用,耐受同型菌株的攻击。但对B型和C型交叉保护效果较差,这可能与不同亚型的副鸡禽杆菌分泌囊泡中携带外膜蛋白成分不同有关,外膜囊泡中免疫保护性抗原成分具有型特异性。在后续试验中,笔者将通过比较不同亚型副鸡禽杆菌囊泡外膜成分,筛选免疫保护的有效成分,并在后续试验中采取不同免疫方式及免疫剂量研究囊泡的保护效果,借此研究鸡传染性鼻炎亚单位疫苗。

