急性缺血性脑血管病患者颅内动脉钙化与脑小血管病MRI特征性表现的相关性研究
高 强,王 剑,张波绪
(1.青岛大学附属威海市立第二医院放射科,山东 威海 264200;2.解放军970医院放射科,山东 威海 264200)
脑小血管病(cerebral small vessel disease,CSVD)是由大脑的小动脉、穿支动脉、毛细血管及小静脉等小血管的各种结构或功能性病变导致的临床、认知、影像学及病理表现的综合征[1]。CSVD发病隐匿,临床表现多样,可使患者日常生活能力下降[1]。其MRI特征性表现有近期皮质下小梗死、脑白质高信号(white matter hyperintensity,WMH)、腔隙灶、脑微出血、扩大的血管周围间隙(enlarged perivascular space,EPVS)及脑萎缩[2]。多项研究[3-7]发现颅内动脉钙化与CSVD密切相关。本研究探讨急性缺血性脑血管病患者颅内动脉钙化与CSVD的MRI特征性表现的关系。
1 资料与方法
1.1 一般资料 回顾性分析2015年9月至2019年1月于威海市立第二医院行CTA和MRI检查的急性缺血性脑血管病患者的临床及影像学资料。纳入标准:短暂性脑缺血发作或急性缺血性脑卒中患者;发病7 d内;接受CTA和MRI检查;无重症表现,无头部外伤史,无肿瘤病史,无其他炎性、血管或结缔组织疾病等。最终276例连续病例纳入研究,其中男162例(58.7%),女114例(41.3%);年龄32~80岁,平均(65.5±6.3)岁,首次卒中201例(72.8%),复发性卒中75例(27.2%)。
1.2 仪器与方法
1.2.1 CTA检查 采用GE Discovery 750 HD宝石能谱CT。扫描参数:120 kV,150 mA,螺距0.6,层距0.5 mm,层厚1 mm。使用高压注射器以流率3.5~4.0 mL/s静脉注射碘帕醇120 mL。
1.2.2 MRI检查 使用GE Singa HDe 1.5 T MRI扫描仪,与听眶线平行进行图像采集。扫描序列及参数:DWI TR/TE 5 120 ms/62 ms,层厚4 mm,视野220 mm×220 mm,b值=0、1 000 mm2/s;FLAIR TR/TE 7 500 ms/81 ms,层厚4 mm,视野220 mm×220 mm;T2WI TR/TE 4 730 ms/72 ms,层厚4 mm,视野220 mm×220 mm;SWI TR/TE 28 ms/20 ms,层厚1 mm,视野220 mm×220 mm。
1.3 图像分析 由2名经验丰富的影像学医师独立盲法读片。在颅内动脉钙化程度分级,以及在急性梗死区以外区域的WMH、EPVS、脑微出血和腔隙灶分级方面,两者一致性良好(K=0.948、0.944、0.936、0.928、0.901,均P<0.05)。
1.4 钙化评估 在GE ADW 4.3工作站上采用Agatston积分法计算钙化积分,积分值是钙化斑块的面积与最高CT值HU系数相乘所得。HU系数被定义为:1(130~199 HU)、2(200~299 HU)、3(300~399 HU)、4 (>400 HU)。计算每例患者每支颅内动脉(包括前、后循环动脉)密度≥130 HU区域的积分,总和为颅内动脉总钙化积分。根据冠状动脉钙化积分分级方法,将颅内动脉钙化分为4个等级:无(0分),轻度(1~100分),中度(101~400分),重度(>400分)[14]。
1.5 CSVD的MRI特征表现 ①近期梗死定义为DWI高信号区,伴或不伴T2WI或FLAIR上信号增高,有典型的血管供血区域与之对应;近期皮质下小梗死定义为位于半卵圆中心、内囊、基底节或脑干的卵圆形或圆形小病灶病变(直径3~20 mm),信号特征与近期梗死相似,需与WMH仔细鉴别[8]。②WMH定义为T2WI或FLAIR上白质高信号区,根据Fazekas量表对深部和脑室旁WMH进行分级(0~3级)[9](图1)。③腔隙灶定义为位于半卵圆中心、内囊、基底节或脑干的卵圆形或圆形小病灶病变(直径3~20 mm),T2WI和FLAIR上与脑脊液信号相似,一般在FLAIR图像上可见高信号环、DWI无信号增高[10](图2)。④脑微出血定义为位于小脑、脑干、基底节区、皮质-皮质下交界区的类圆形小病灶(直径<5 mm),梯度回波图像上呈均匀低信号,应与血管流空信号和苍白球矿物质沉积鉴别[10]。⑤EPVS定义为半卵圆中心或基底节区小病灶(<3 mm),T2WI上的小点状和线状高信号,根据半定量量表分为0~4级[11]。由于基底节区的脑微出血和EPVS与CSVD关系密切[12-13],故本研究仅观察该区域。
1.6 统计学方法 采用SPSS 17.0软件进行统计学分析。连续变量行方差分析,分类变量行χ2检验;采用非参数检验、趋势χ2检验及Spearman秩相关检验分析颅内动脉钙化程度与CSVD各项表现严重程度的关系;Logistic回归分析用于分析颅内动脉钙化与CSVD各项MRI表现的相关性,结果以优势比(OR)及其95%置信区间(95%CI)表示。以P<0.05为差异有统计学意义。
2 结果
2.1 颅内动脉钙化分布情况 276例中,200例(72.5%)存在颅内动脉钙化,其中颈内动脉178例(64.5%),椎动脉83例(30.1%),基底动脉53例(19.2%),大脑中动脉17例(6.2%),大脑前动脉5例(1.8%),大脑后动脉3例(1.1%)。
2.2 颅内动脉钙化与CSVD的MRI表现相关性分析 WMH、EPVS、脑微出血、腔隙灶的总体发生率分别为73.2%(202/276)、74.3%(205/276)、54.0%(149/276)和45.7%(126/276)。非参数检验、趋势χ2检验表明,颅内动脉钙化程度与WMH、腔隙灶及脑微出血存在相关性(均P<0.001),而与EPVS相关性不明显(P=0.058)。非参数检验表明,钙化积分在WMH不同分级组间及有无腔隙灶、脑微出血组间比较差异均有统计学意义(均P<0.05),在EPVS组间差异无统计学意义(P>0.05)。Spearman秩相关检验表明,钙化积分与WMH、腔隙灶、脑微出血的rs分别为0.350、0.285、0.251(表1)。颅内动脉钙化与CSVD的MRI表现的单因素Logistic分析见表2。
3 讨论
本研究采用Agatston方法半定量分析颅内动脉钙化(包括前、后循环动脉)与CSVD 4种典型MRI表现之间的关系,揭示了急性缺血性脑血管病患者颅内动脉钙化的分布规律及其与CSVD的MRI表现的相关性。
CHUNG等[3]运用CT定性评估颈动脉颅内段钙化程度,发现钙化与WMH相关。但本研究发现两者相关性低于该报道,可能由于其研究仅纳入了急性缺血性卒中患者,而本研究同时纳入了短暂性脑缺血发作患者,后者往往较少发生脑实质改变。ERBAY等[15]研究发现,颈动脉颅内段钙化与腔隙灶独立相关,本研究使用Agatston方法对钙化进行量化分级,得到了相似结果。动脉钙化可损害血管内皮功能,导致血管张力和舒张反应调节受损[16-17]。因此,动脉粥样硬化引起的血管舒张受限和内皮依赖性血管舒张损伤是引起WMH和腔隙灶的2种潜在机制,其通过导致穿支动脉供血区域脑组织的低灌注,从而引起脑实质病变[3]。

表1 CSVD的MRI表现与颅内动脉钙化积分的Spearman相关性分析

表2 CSVD的MRI表现与颅内动脉钙化相关性的Logistic分析
此外,本研究发现颅内动脉钙化与脑微出血亦存在相关性,与CHUNG等[4]发现颈动脉颅内段钙化与深部脑微出血有一定关联的研究结果相似。研究[12-13]表明,深部脑微出血与CSVD存在特异相关性,因此本研究仅分析了基底节区的脑微出血。颅内动脉钙化可能损害内皮功能,引起血-脑脊液屏障通透性增加[17],红细胞自脑小血管壁的薄弱处外渗引起脑微出血。SABA等[18]发现颈动脉的粥样硬化与脑微出血相关,可能是由于动脉粥样硬化可同时累及大血管和小血管,且具有相同病理过程,受损小血管发生血液外渗致脑微出血发生。
以往研究[19-22]提出不同机制解释动脉粥样硬化与EPVS之间的关系,包括动脉僵硬度增加、颅内小血管腔内压力变化、慢性脑低灌注或仅EPVS和动脉粥样硬化共存。DEL等[22]定性评估钙化程度,发现颅内动脉粥样硬化与基底节区EPVS间存在相关性,但研究对象年龄较高,平均(71.2±8.4)岁,而EPVS被认为与年龄有密切相关[19]。本研究使用CT增强扫描,定量分析钙化程度与EPVS的相关性,并未得到与DEL等[22]相似的结果。由此推断,颅内动脉钙化的主要危害是损害内皮功能并导致血-脑脊液屏障通透性增加[17],而其在EPVS的形成过程中可能并不起主导作用。因此,有必要进一步探讨EPVS发病的潜在机制。
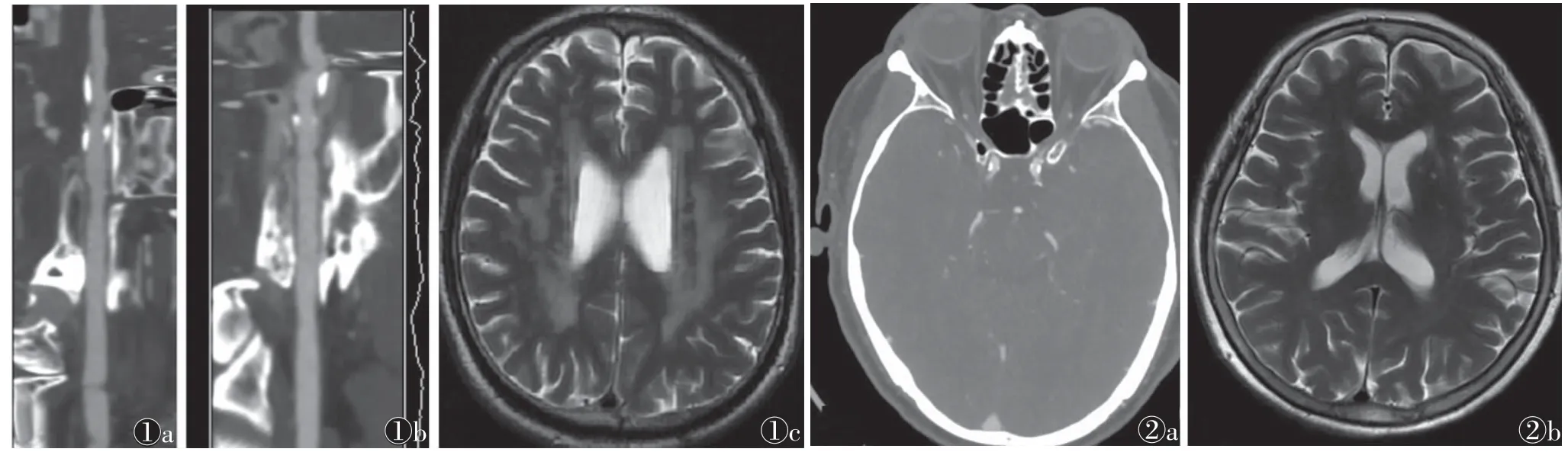
图1 男,68岁图1a,1b CPR示颅内动脉多发钙化,钙化积分457分图1c T2WI示侧脑室旁脑白质高信号,Fazekas分级3级图2 男,61岁图2a 颅脑CTA示双侧颈内动脉钙化,钙化积分334分图2b T2WI示左侧基底节区多发腔隙灶
以往研究报道颅内动脉钙化的发生率差异较大,一项研究[23]表明在急性脑血管病患者中,颅内及颈部血管钙化的发生率为40%~87%;另一项关于我国人群CT检查的研究[24]发现,69%的患者存在颈内动脉钙化。本研究发现颅内动脉钙化普遍存在于急性缺血性脑血管病患者中(72.5%,200/276),其中以颈内动脉最常见(64.5%,178/276);高患病率可能是由于MSCT的高敏感性和使用Agatston方法自动检测钙化所致。
综上所述,急性缺血性脑血管病患者颅内动脉钙化普遍存在,以颈内动脉为著。颅内动脉钙化与WMH、腔隙灶及脑微出血高度相关,可作为CSVD的预测指标,具有一定临床价值,也可为探究CSVD的病理生理学提供更多信息。

