内质网应激对肝细胞过氧化物酶体增殖物激活受体α表达的影响
徐 玲, 田 原, 张向颖, 王慧娟, 任 锋
1.首都医科大学附属北京佑安医院肝病研究所,北京 100069; 2.山西医科大学第二临床医学院
内质网是哺乳动物真核细胞中的一种重要细胞器,不仅参与蛋白质的合成、储存、加工修饰,也参与脂类和糖类的合成代谢,同时,内质网也是非常重要的钙离子储存库,调控钙离子的储存和释放。在人体各组织、器官细胞中,肝细胞中含内质网最丰富[1]。当机体发生缺氧、钙离子代谢紊乱、病毒感染等不利因素时,内质网这些重要的功能将会紊乱,导致未折叠或错误折叠的蛋白质在内质网中堆积,从而引发内质网应激[2]。糖调节蛋白78(glucose regulated protein 78,GRP78)是内质网应激的标志性蛋白,在细胞稳态的情况下表达很少,而在细胞内质网应激时大量表达,参与下游信号通路的激活。早期轻度的内质网应激通过启动未折叠蛋白反应(unfolded proteins response,UPR),调节分子伴侣的表达,增强蛋白质的折叠能力及错误折叠蛋白质的降解,改善内质网应激状态,促进细胞生存;持续严重的内质网应激导致UPR的保护作用转变为促损伤作用,激活CHOP、JNK、Caspase-12等分子,启动细胞凋亡通路[3]。其中,CHOP是内质网应激诱导细胞凋亡的关键分子。目前,对于内质网应激的功能由保护作用向损伤作用转变的分子机制,还尚未明确。
过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors, PPARs)是一类由配体激活的核转录因子,属Ⅱ型核受体超家族成员,存在3种亚型,即PPARα、PPARδ和PPARγ。三种亚型的组织分布、配体特异性、生物学功能各不相同[4]。其中,PPARα是参与血糖调节、脂肪酸氧化、脂质代谢和炎症反应的重要分子[5]。已有研究表明,激活PPARα对内质网应激诱导的HepG2细胞凋亡具有保护性作用[6];CHOP是内质网应激诱导细胞凋亡途径的关键分子[7]。我们由此猜想,PPARα或许是内质网应激过程中功能转化的一个重要分子。本研究旨在探讨PPARα分子在不同严重程度内质网应激中的表达变化。
1 材料与方法
1.1 材料AML-12细胞购自美国ATCC公司。内质网应激诱导剂衣霉素(Tunicamycin,TM)购自美国Sigma公司(货号M9281);CHOP鼠抗单克隆抗体、GRP78、β-actin兔抗单克隆抗体和辣根过氧化酶(horseradish peroxidase,HPR)偶联的羊抗兔多克隆抗体均购自美国Cell Signaling公司;PPARα多克隆抗体购自美国Abcam公司;增强化学发光试剂盒购自美国Thermo公司(货号32209),BCA蛋白定量试剂盒购自北京博迈德公司(货号PA101-01);逆转录试剂盒(货号18080)和实时荧光定量PCR(quantitative real-time polymerase chain reaction,qRT-PCR)试剂盒(货号12594100)均购自美国Invitrogen公司。
1.2 方法
1.2.1 实验分组:细胞实验分组:TM(40 μg/ml)分别刺激AML-12细胞3、6、12、24 h及正常对照组;不同浓度TM(2.5、5、10、20、40 μg/ml)分别刺激AML-12细胞12 h。
1.2.2 qRT-PCR检测:用Trizol试剂提取细胞总RNA,具体操作按照说明书进行;测定总RNA浓度,用SuperScript Ⅲ Platinum Two-Step qRT-PCR试剂盒合成cDNA,随后进行qRT-PCR检测,具体操作按试剂盒说明书进行,以次黄嘌呤磷酸核糖基转移酶(hypoxanthine phosphoribosyl transgerase,HPRT)作为内参,分别检测肝组织中PPARα、GRP78、CHOP mRNA表达水平。
1.2.3 蛋白印迹检测:收集细胞加入100 μl预冷的组织裂解液,在-80 ℃反复冻融3次;于1 000 r/min,4 ℃离心5 min,取上清液,使用BCA蛋白定量试剂盒测定蛋白浓度;每孔加蛋白样品30 μg,经12%十二烷基苯磺酸钠-聚丙烯酰胺凝胶电泳分离,4 ℃转膜(聚偏二氟乙烯膜)过夜,4 ℃孵育一抗(PPARα、GRP78、CHOP、β-actin,1∶1 000),Tris缓冲盐溶液漂洗3次,孵育二抗(1∶2 000稀释),洗膜3次后,电化学发光试剂A液、B液混匀孵育,压片曝光。
1.2.4 免疫荧光检测:TM刺激的AML-12细胞多聚甲醛固定过后,加入0.5%的Triton x-100破膜,加入封闭液(3%BSA溶液加入质量浓度为100 g/L的羊血清)封闭非特异性结合位点,再加入PPARα多克隆抗体4 ℃过夜,加入Alexa Fluor 568羊抗兔IgG(1∶200稀释)孵育60 min,PBS漂洗3次,DAPI染核10 min。Leica共聚焦免疫荧光显微镜下观察。

2 结果
2.1 PPARα mRNA在TM不同时间诱导细胞内质网应激的表达变化检测结果表明,在TM诱导3、6、12、24 h的细胞内质网应激过程中,GRP78与CHOP随着时间延长表达逐渐升高;在早期轻度内质网应激过程中PPARα的表达逐渐升高,而晚期严重内质网应激PPARα的表达反而下降。随着TM刺激时间的延长,细胞的内质网应激程度逐渐加重,PPARα的表达呈现出先升高后降低的变化(见图1)。
2.2 PPARα蛋白在TM不同时间诱导细胞内质网应激的表达变化免疫印迹的结果表明,在TM诱导3、6、12、24 h的细胞内质网应激过程中,GRP78与CHOP的表达随时间延长逐渐升高;PPARα在早期轻度内质网应激中表达升高,晚期严重的内质网应激中表达下降(见图2)。与基因的检测结果一致,在内质网应激程度逐渐加重的过程中,PPARα的表达呈现先升高后降低的趋势。

注:在TM不同时间诱导内质网应激过程中,与0 h组比较,*P<0.0001。
2.3 PPARα mRNA在TM不同浓度诱导细胞内质网应激的表达变化TM分别以2.5、5、10、20、40 μg/ml的浓度诱导细胞发生内质网应激,GRP78与CHOP mRNA随着TM浓度增加表达逐渐升高;在较低浓度TM诱导内质网应激过程中,PPARα的表达逐渐上升,随着TM浓度的增加,PPARα的表达反而下降。在不同TM浓度诱导不同严重程度的内质网应激过程中,随着内质网应激程度的加重,PPARα的表达呈现出先升高后降低的变化(见图3)。
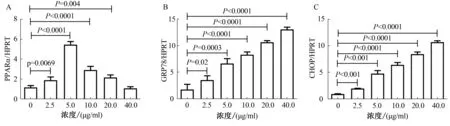
注:A:PPARα的表达情况;B:GRP78的表达情况;C:CHOP的表达情况。
2.4 PPARα蛋白在不同浓度TM诱导细胞内质网应激的表达变化TM分别以2.5、5、10、20、40 μg/ml的浓度诱导细胞发生内质网应激,GRP78与CHOP蛋白随着TM浓度增加表达逐渐升高;在较低浓度TM诱导内质网应激过程中,PPARα蛋白的表达逐渐上升,而较高浓度TM诱导内质网应激时,PPARα蛋白的表达反而降低。在不同TM浓度诱导的内质网应激过程中,随着内质网应激程度的加重,PPARα蛋白的表达呈现出先升高后降低的趋势(见图4)。

注:与0 μg/ml组比较,*P<0.0001。
2.5 PPARα在TM不同时间诱导细胞内质网应激过程中的细胞位置变化为进一步探讨在不同严重程度的内质网应激进程中PPARα分子的表达情况,在TM不同时间刺激细胞内质网应激的过程中,利用荧光抗体染色对PPARα进行检测。结果发现,在细胞的内质网应激早期,PPARα分子高表达且在细胞质与细胞核中均有表达;而随着TM刺激细胞时间延长,PPARα的表达逐渐降低且主要在细胞核内表达。随着内质网应激时间的延长,PPARα的位置由细胞质向细胞核转移(见图5)。

图5 TM不同时间诱导内质网应激对PPARα表达位置的影响(放大400倍)
2.6 PPARα在TM不同浓度诱导细胞内质网应激过程中的细胞位置变化在TM浓度由低到高刺激AML-12细胞发生内质网应激的过程中,低浓度TM刺激细胞发生轻度内质网应激时,PPARα的表达较高,细胞质与细胞核中均有分布;高浓度TM刺激细胞发生严重内质网应激时,PPARα表达下降,且主要集中分布在细胞核内。随着内质网应激程度的加剧,PPARα分子的分布从细胞浆向细胞核转移(见图6)。
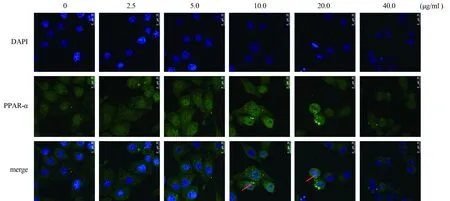
图6 TM不同浓度诱导内质网应激对PPARα 表达位置的影响(放大400倍)
3 讨论
内质网的蛋白质合成、折叠和加工修饰过程很易受到外界因素的干扰而发生错误,如基因突变、钙离子水平的改变、感染等不利因素的发生,会造成错误折叠的蛋白质在内质网腔中的积累,干扰正常的蛋白质合成,引发内质网应激。当细胞发生内质网应激时,为实现内质网蛋白合成系统的平衡,恢复内质网的正常功能,就会启动UPR。UPR主要在三个方面调节内质网内的蛋白合成:(1)通过上调分子伴侣的表达促进蛋白质的折叠;(2)在转录水平降低蛋白质的合成以缓解内质网应激;(3)通过内质网相关降解作用(endoplasmic reticulum associated degradation, ERAD)降解未折叠或错误折叠的蛋白。这些过程主要通过活化转录因子6(ATF6)、跨膜蛋白激酶1(IRE1)、激活蛋白激酶R样内质网激酶(PERK)三个转录因子进行调节[8]。在非内质网应激的状态下,这三种转录因子与GRP78结合,处于非活性状态[9]。细胞发生内质网应激时,GRP78与ATF6、IRE1、PERK解离,GRP78作为分子伴侣与腔内未折叠的蛋白质相结合,三种跨膜蛋白启动UPR信号通路。因此,GRP78是内质网应激反应的主要标志性蛋白[10]。当内质网应激过于强烈或持续时间过长,不能恢复内质网的稳态,UPR则会启动细胞的凋亡通路,通过激活JNK、Caspase-12、CHOP信号分子诱导细胞凋亡[11]。许多研究表明,PERK、ATF4、CHOP在细胞内质网应激诱导的凋亡中发挥了重要作用[12]。内质网应激时,UPR的适应途径和凋亡途径的平衡对细胞的命运起着关键作用[13]。内质网应激在许多肝脏疾病中起到了重要作用,如非酒精性脂肪肝、酒精性肝病、病毒性肝炎等[14]。内质网应激在疾病中表现出双重作用,短暂的、轻微的内质网应激通过启动UPR促进细胞恢复稳态,使病情缓解;长期的、严重的内质网应激会激活细胞凋亡通路,导致细胞死亡,最终产生不利影响。进一步认识并发现内质网应激由保护作用向损伤作用的功能转换机制是本研究的目的。
PPARα是一种配体激活的转录因子,属于核受体超家族成员,主要在肝脏、肾脏、心脏组织中表达,对于调节脂肪酸代谢、过氧化物酶体增殖、肝脏毒性有至关重要的作用[15]。PPARα被激活后,结合到靶基因的特定过氧化物酶体增殖物反应元件(peroxisome proliferator response element,PPRE)来调节基因的表达[16]。调节PPARα是限制多种疾病发生、发展的重要靶点,PPARα参与炎症反应的调节,激活PPARα可以明显减弱炎症反应的损伤[17];PPARα通过调控细胞的增殖与凋亡进程参与肝癌的疾病进程[18];激活PPARα对酒精性脂肪肝发挥有效的保护作用[19]。有文献表明,PPARα通过调节内质网应激对D-氨基半乳糖联合脂多糖诱导的小鼠急性肝损伤有保护作用[20];PPARα的激活减少了内质网应激诱导的细胞凋亡[6]。在细胞内质网应激过程中,由保护作用向损伤作用的功能转换是一个复杂又精密的调节网络,PPARα在内质网功能转化过程中的表达变化,提示PPARα是在内质网功能转化过程中的一个重要调节分子。
在TM诱导内质网应激的不同阶段,我们检测到PPARα的表达谱呈现出先升高后降低的趋势。在TM短时间、低浓度刺激诱导细胞发生早期,轻度的内质网应激时,通过启动UPR促进内质网功能恢复,内质网应激发挥保护作用,PPARα mRNA表达升高,蛋白表达升高,并在细胞质中大量表达,最终细胞恢复稳态;当TM长时间、高浓度诱导细胞发生晚期,严重的内质网应激时,UPR无法调节细胞恢复稳态,触发细胞凋亡通路启动,内质网应激发挥促损伤作用,PPARα mRNA与蛋白的表达均下降,免疫荧光结果显示蛋白位置由细胞质转移到细胞核内,CHOP的表达明显升高,最终细胞凋亡。在内质网应激的不同阶段PPARα的表达变化提示我们,在内质网应激的功能转化过程中,PPARα可能是关键的调节分子之一。
综上所述,PPARα是内质网功能由保护作用向损伤作用转换的一个关键分子。内质网应激的功能转换是一个复杂而精密的过程,阐明其中的具体机制,为多种疾病找到有效治疗靶点,仍需我们不断努力。

