Yes相关蛋白在脓毒症患者PBMC中的表达及意义
吴双华 谢璨灿 李峥嵘 曾维忠 王婷
【摘要】目的 探讨Yes 相关蛋白(YAP)在脓毒症患者外周血单个核细胞(PBMC)中的表达情况及临床意义。方法 检测65例脓毒症患者(脓毒症组)和36名健康志愿者(对照组)PBMC中YAP mRNA的表达水平。根据28 d临床结局将脓毒症组分为死亡亚组(26例)和存活亚组(39例),比较2个亚组的急性生理学及慢性健康状况评分系统(APACHE Ⅱ)评分和PBMC中YAP mRNA的表达水平,采用Pearson相关分析两类指标的相关性,并用受试者工作特征(ROC)曲线分析YAP mRNA表达水平预测脓毒症患者预后的效果。结果 脓毒症组和对照组一般情况具可比性(P > 0.05)。脓毒症组PBMC中YAP mRNA表达水平高于对照组(P < 0.05)。死亡亚组患者入院时的APACHE Ⅱ评分及PBMC中YAP mRNA表达水平均高于存活亚组(P < 0.05)。脓毒症患者PBMC中YAP mRNA表达水平与APACHEⅡ评分呈正相关(r = 0.660,P < 0.05),YAP mRNA表达水平预测脓毒症患者预后的ROC曲线的曲线下面积为0.691,灵敏度和特异度均为0.692。结论 脓毒症患者PBMC中的YAP表达水平高于健康者且与病情严重程度呈正相关,有助于判断患者的病情严重程度与预测预后。
【关键词】Yes相关蛋白;脓毒症;外周血单个核细胞
【Abstract】Objective To investigate the expression and clinical significance of Yes-associated protein (YAP) in peripheral blood mononuclear cells (PBMC) of sepsis patients. Methods The expression levels of YAP mRNA in PBMC were detected in 65 sepsis patients (sepsis group) and 36 healthy volunteers (control group). According to the clinical outcome at day 28, the sepsis group was divided into death subgroup (26 cases) and survival subgroup (39 cases). The acute physiology and chronic health status scoring system (APACHE Ⅱ) score and YAP mRNA expression level in PBMC were compared in two groups. Pearson correlation was used to analyze the correlation between two types of indices. Receiver-operating characteristic curve (ROC) was used to analyze the effect of YAP mRNA expression levels in predicting prognoses of sepsis patients. Results The general conditions of sepsis group and control group were comparable (P > 0.05). The expression level of YAP mRNA in PBMC in sepsis group was higher than that in control group (P < 0.05). Patients in death subgroups had higher APACHEⅡ scores and YAP mRNA expression levels in PBMC on admission to hospital than those in survival subgroup (P < 0.05). The expression level of YAP mRNA in sepsis patients was positively correlated with the APACHE Ⅱ score (r = 0.660, P < 0.05). The area under the curve of ROC that predicts prognoses of sepsis patients based on YAP mRNA expression levels was 0.691. Both the sensitivity and the specificity were 0.692. Conclusion The YAP expression levels in PBMC were higher in sepsis patients than in healthy subjects and possitively correlated with the severity of sepsis, which was helpful to judge the severity of sepsis and predict the prognoses of patients.
【Key words】Yes-associated protein;Sepsis;Peripheral blood mononuclear cells
膿毒症是目前临床上急危重症患者死亡的主要原因之一[1]。Yes相关蛋白(YAP)作为一种转录辅激活因子,能与多种蛋白质相互作用并激活对细胞存活、趋化、分化和增殖起重要作用的靶基因的表达,是哺乳动物的细胞中 Hippo 信号转导通路的关键效应分子[2]。近年来的研究显示有部分革兰阳性菌通过 Toll 依赖性途径激活果蝇中的Hippo信号转导,提示YAP在炎症的发生发展过程中也发挥一定的调控效应[3-4]。在本研究中,笔者通过观察脓毒症患者外周血单个核细胞(PBMC)中YAP的表达水平及其与患者急性生理学及慢性健康状况评分系统(APACHE Ⅱ)评分的相关性,探讨YAP是否参与脓毒症的发生过程及其能否作为判断患者病情严重程度与预后的指标。
对象与方法
一、研究对象
将2018年1月至2019年12月我院收治的65例脓毒症患者设为脓毒症组,其中男51例、女14例,年龄(51.5±16.9)岁,其中腹腔感染25例、泌尿系统感染21例、肺部感染15例、皮肤软组织感染4例。根据28 d临床治疗结局又将65例患者分为死亡亚组和存活亚组,其中死亡26例、存活39例。全部病例符合2016年国际脓毒症与感染性休克治疗指南制订的诊断标准[5]。全部病例均排除以下情况:住院时间小于72 h;年龄< 18岁或> 80岁;孕期或哺乳期妇女;合并有恶性肿瘤、原有免疫功能缺陷性疾病、慢性肾脏疾病、终末期肝衰竭、心肺复苏后、持续感染性疾病如HIV感染、结核感染及长期使用免疫抑制药物和细胞毒性药物;放弃治疗及其他原因导致病历资料收集不完整。将同时期的36名健康志愿者设为对照组,其中男28名、女8名,年龄(46.1±13.3)岁。本研究通过了我院医学伦理委员会审核批准,并取得了所有参与研究的患者或家属及志愿者的知情同意。
二、方 法
1.主要试剂与仪器
TRIzolTM LS Reagent(美国Thermo Fisher Scientific)、YAP引物[生工生物工程(上海)股份有限公司]、人外周血单个核细胞分离液试剂盒P8680(北京Solarbio科技有限公司)、2,3二羥基丙醛3磷酸脱氢酶(GAPDH)[生工生物工程(上海)股份有限公司]、逆转录PCR(RT-PCR)试剂盒(日本TaKaRa公司);PCR扩增仪SLAN-96S(上海宏石医疗科技有限公司)。
2.操作步骤
采集脓毒症患者(入院时)及健康志愿者外周静脉血10 ml,加入乙二胺四乙酸二钠(EDTA)抗凝管,按照人外周血单个核细胞分离液说明书分离单个核细胞,加入RNA稳定剂中保存,再置于-70℃冰箱保存待检。按照TRIzolTM LS Reagent的使用说明书提取单个核细胞总RNA,提取的总RNA用紫外分光光度计测量波长260 nm和280 nm的光密度(A)值,并计算A260/A280以估测RNA的纯度,若A260/A280值≥1.8,表明RNA样品没有蛋白质的残留,可以备用,获取RNA浓度值。稀释后的总RNA根据逆转录试剂盒使用说明书进行逆转录,具体反应体系如下:5×PrimeScript Buffer 4 μl,PrimeScript RT Enzyme Mix 1 μl,Oligo dT Primer 1 μl,Random 6 mers 1 μl,稀释后的RNA 13 μl(总共20 μl体系);逆转录反应条件为37℃15 min,85℃15 s。依据 Gen Bank数据库提供的 GAPDH及YAP序列,采用Pmerremier 5.0软件设计人源引物,引物序列如下:GAPDH:上游5-GATTTGGTCGTATTGGGCGC-3,下游5-T TCCCGTTCTCAGCCTTGAC-3;YAP引物:上游5-TTGGCTAGACCCAAGGCTTG-3,下游5-GTTGCTGCTGGTTGGAGTTG-3。将逆转录得到的反向转录DNA(cDNA)稀释之后,用PCR扩增仪SLAN-96S测定其扩增表达。其反应体系总共20μl(cDNA 2 μl、灭菌水 6 μl、基因前引物0.8 μl、基因后引物0.8 μl、TB Green Premix Ex Tap Ⅱ 10 μl、ROX Reference Dye Ⅱ 0.4 μl)。PCR反应条件为:95℃预变性30 s,95℃变性5 s,60℃退火30 s,共40个循环,GAPDH作为内参。最后结果采用2-△△Ct(△Ct = Ct目的基因-Ct内参基因,-△△Ct=△Ct对照组基因-△Ct脓毒症组基因)计算基因相对表达量。
3.观察指标
计算患者的APACHE Ⅱ评分。检测脓毒症组和对照组PBMC YAP mRNA表达情况。
三、统计学处理
应用 SPSS 20.0进行统计学分析。正态分布计量资料采用表示,2组间比较采用两独立样本t检验,计数资料采用χ2检验,相关性采用Pearson相关分析,并用受试者工作特征(ROC)曲线分析YAP mRNA表达水平预测脓毒症患者预后的效果。P < 0.05 为差异有统计学意义。
结果
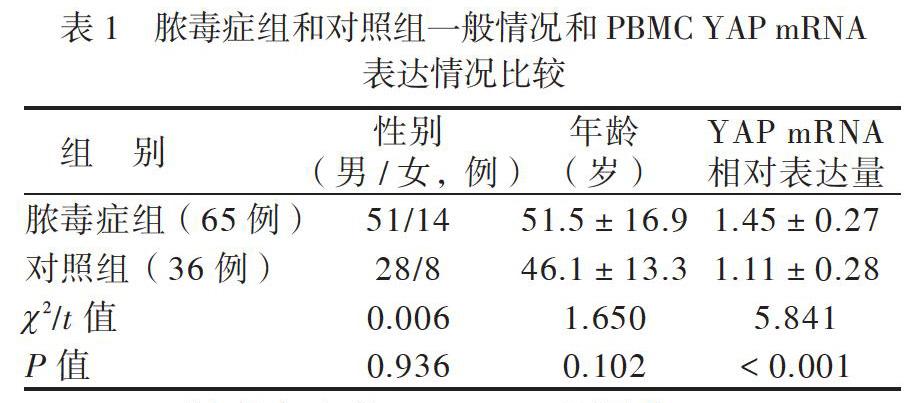
一、脓毒症组和对照组一般情况和PBMC YAP mRNA表达情况比较
脓毒症组和对照组的性别、年龄比较差异无统计学意义(P均> 0.05)。2组的外周血单个核细胞YAP mRNA相对表达量分别为1.45±0.27和1.11±0.28,比较差异有统计学意义(P < 0.05),见表1。
二、脓毒症患者APACHE Ⅱ评分、YAP mRNA表达及两者的相关性
死亡亚组和存活亚组患者入院时的APACHE Ⅱ评分分别为(21.89±5.63)分与(15.64±5.21)分,差异有统计学意义(t = 4.581,P < 0.001);2亚组患者外周血单个核细胞YAP mRNA相对表达量分别为1.54±0.28、1.38±0.24,差异亦有统计学意义(t = 2.468,P = 0.016)。脓毒症患者外周血单个核细胞YAP mRNA表达水平与APACHEⅡ评分呈正相关(r = 0.660,P < 0.05)
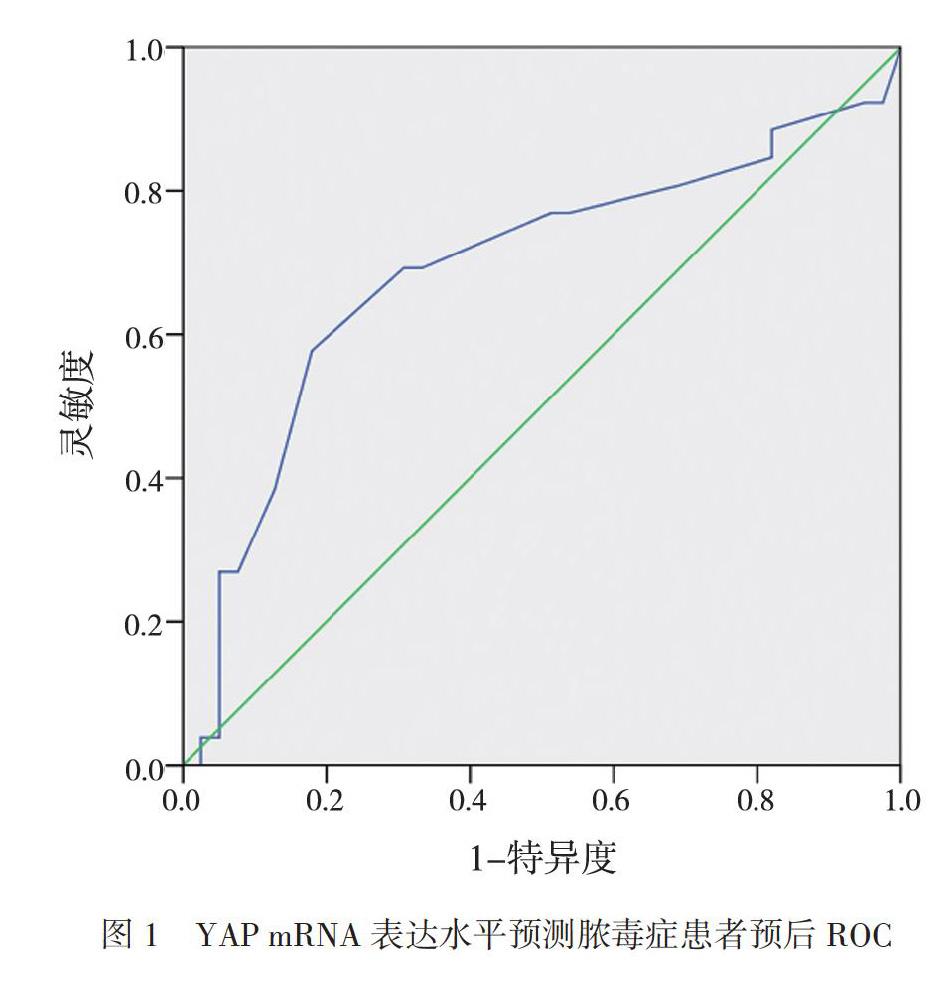
三、YAP mRNA表达水平预测脓毒症患者预后的ROC
YAP mRNA预测脓毒症患者预后的ROC曲线的曲线下面积为0.691 (95%CI为 0.549 ~ 0.832,P < 0.01),Cut-off值为1.485,灵敏度和特异度均为0.692,见图1。
讨论
脓毒症已成为当前急危重症医学临床救治过程中面临的最主要的和最棘手的情况之一,是感染致死的主要原因。随着现代医学的发展进步,新的诊疗方案、手段和药物不断被提出,但是在临床治疗中脓毒症的发病率仍在上升,病死率高达20% ~ 30%[6]。而经过积极救治幸存下来的患者中又有300余万例存在着不同程度的认知功能障碍致其生活不能完全自理[6]。因此尽早识别、积极诊治和早期评估疗效及预后并提高脓毒症救治的成功率和有效率是医务人员和患者及家属共同关注的问题[6-7]。
Hippo信号通路主要由一系列相对高度保守的激酶所构成,是一条主要抑制细胞生长分化的信号通路,其主要作用在于调控机体干细胞的自我分化更新的能力和调节机体脏器的形态大小的变化[8]。YAP是近年来研究者新发现的一种蛋白,是Hippo信号通路的主要下游效应物。该蛋白主要与非受体酪氨酸激酶 YES 的 SH3片段紧密结合发挥生物学效应,其富含脯氨酸成分,估计分子量约为65 kD,人类YAP主要位于染色体11q22区[9]。作为调控 Hippo信号转导通路中的关键蛋白,YAP在调控细胞的增殖、分化、迁徙、趋化和凋亡、坏死等过程中均起着至关重要的作用[10]。以往YAP研究的热点多聚焦于肿瘤相关领域,研究显示YAP在肝癌、肺癌、肾癌及妇科肿瘤等的发生发展过程中扮演着极其重要的角色[11]。近年来越来越多的研究显示YAP在调控炎症的发生发展过程中也起相当重要的作用。
本课题组主要通过研究脓毒症患者外周血单个核细胞的YAP基因表达以了解其变化及临床意义。本研究中的脓毒症患者以男性为主,年龄以中老年为多,这与国内外相关研究结果类似[3]。而本研究中的患者主要在综合ICU中接受治疗,其病种较广泛,以腹腔感染、泌尿系统感染和肺部感染最常见,这与大多数综合ICU收治病种相似[5]。
本研究中脓毒症组患者外周血单个核细胞YAP mRNA相对表达量高于对照组。胡迎春等[12]通过盲肠结扎穿孔术构建大鼠脓毒症模型,建模 48 h后,与正常组和假手术组相比,脓毒症组大鼠肝脏组织中 YAP1 基因及蛋白表达水平增加(P < 0.05)。初步验证了Hippo信号通路中的YAP 因子可能参与了脓毒症肝脏病变的发生发展过程。左文等[13]通过内毒素刺激小鼠巨噬细胞构建脓毒症细胞模型,发现巨噬细胞向M1型巨噬细胞分化,并通过蛋白免疫印迹检测发现去磷酸化的YAP表达水平升高,磷酸化的YAP表达水平降低,所以他们推测去磷酸化的YAP可能与脓毒症的发生发展有关。
YAP在脓毒症中升高的原因和具体机制尚未完全明确。有研究表明YAP是血管内皮细胞活化和炎症的基本调节剂,炎症介质可以诱导内皮细胞YAP的高表达[3-4]。YAP与肿瘤坏死因子受体相关因子6(TRAF 6)相互作用,通过K48泛素化促进TRAF 6的降解,抑制K63连接的泛素化,从而阻止核转录因子(NF) -κB的激活。Yi等[14]发现内毒素通过激活岩石使YAP进入ECs核团并与
Egr-1结合。Song等[15]证明内毒素可激活巨噬细胞/
肝脏庫普弗细胞中的YAP与炎症细胞因子启动子区的Tead结合,从而进一步诱导促炎细胞因子的表达,引起多个器官功能发生障碍,导致感染加重和脓毒性休克的发生。
通过追踪观察脓毒症患者28 d的临床结局,我们发现死亡亚组与存活亚组外周血单个核细胞YAP mRNA和APACHE Ⅱ评分比较差异有统计学意义,进一步的Pearson相关分析显示两者呈正相关。APACHE Ⅱ是目前国际上公认最权威、最实用、临床应用最为广泛的急危重症患者病情评估评分系统,随着分值的升高,患者的病情越危重,死亡的风险越高,APACHE Ⅱ评分能够较为全面地反映患者机体状况和评估危重症患者的预后[16]。本研究结果提示YAP的表达可能与患者预后有关,高YAP表达预示不良预后,患者的死亡可能性更大。ROC曲线分析结果也显示YAP在脓毒症患者预后方面具有较好的预测效能。
综上所述,脓毒症患者外周血单个核细胞YAP mRNA表达水平升高,YAP与脓毒症患者病情的严重程度及预后存在着一定的相关性,YAP有助于临床上早期评估脓毒症患者的预后,从而为治疗提供参考,具有较好的临床意义和推广价值。
参 考 文 献
[1] 陈伟栋,徐嘉,黄振华,古钎林,廖瑾莉,韦秋霞,詹红. EPC、FMD与脓毒症患者病情严重程度的相关性研究.新医学,2019,50(5) :361- 365.
[2] Hu C, Sun J, Du J,Wen D, Lu H, Zhang H, Xue Y, Zhang A, Yang C, Zeng L, Jiang J. The hippo-YAP pathway regulates the proliferation of alveolar epithelial progenitors after acute lung injury. Cell Biol Int,2019,43(10):1174-1183.
[3] 吕阳. Yes相关蛋白(YAP)在脓毒症发病中的作用及其机制研究.南京:南京医科大学,2018.
[4] Lv Y, Kim K, Sheng Y, Cho J, Qian Z, Zhao YY, Hu G, Pan D, Malik AB, Hu G. YAP controls endothelial activation and vascular inflammation through TRAF6. Circ Res, 2018, 123 (1):43-56.
[5] Rhodes A, Evans LE, Alhazzani W,Levy MM, Antonelli M, Ferrer R, Kumar A, Sevransky JE, Sprung CL, Nunnally ME, Rochwerg B, Rubenfeld GD, Angus DC, Annane D, Beale RJ, Bellinghan GJ, Bernard GR, Chiche JD, Coopersmith C, De Backer DP, French CJ Fujishima S, Gerlach H, Hidalgo JL, Hollenberg SM, Jones AE, Karnad DR, Kleinpell RM, Koh Y, Lisboa TC, Machado FR, Marini JJ, Marshall JC, Mazuski JE, McIntyre LA, McLean AS, Mehta S, Moreno RP, Myburgh J, Navalesi P, Nishida O, Osborn TM, Perner A, Plunkett CM, Ranieri M, Schorr CA, Seckel MA, Seymour CW, Shieh L, Shukri KA, Simpson SQ, Singer M, Thompson BT, Townsend SR, Van der Poll T, Vincent JL, Wiersinga WJ, Zimmerman JL, Dellinger RP. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016. Intensive Care Med, 2017,43(3):304-377.
[6] 何问理,温海东,罗云.结石梗阻致尿源性脓毒血症的影响因素及早期诊治策略分析. 新医学,2019,50(12):928-932.
[7] Prescott HC, Angus DC. Postsepsis morbidity. JAMA, 2018, 319(1):91.
[8] Van Soldt BJ, Cardoso WV. Hippo-Yap/Taz signaling:complex network interactions and impact in epithelial cell behavior. Wiley Interdiscip Rev Dev Biol,2019,12(11):e371.
[9] Hsu PC,Jablons DM,Yang CT,You L.Epidermal growth factor receptor (EGFR) pathway, yes-associated protein (YAP) and the regulation of programmed death-ligand 1 (PD-L1) in non-small cell lung cancer (NSCLC).Int J MolSci, 2019,20(15):E3821.
[10] Koo JH, Plouffe SW, Meng Z,Lee DH, Yang D, Lim DS, Wang CY, Guan KL. Induction of AP-1 by YAP/TAZ contributes to cell proliferation and organ growth. Genes Dev, 2019, 34(1-2):72-86.
[11] Taha Z, JvR HJ, Yang X. The Hippo pathway:immunity and cancer. Cancers (Basel), 2018, 10(4):E94.
[12] 胡迎春,張千,钟武,陈睦虎,周凯. YAP1基因在脓毒血症大鼠中表达的实验研究. 内科急危重症杂志, 2016, 22 (5):377-379.
[13] 左文,王海清,钟武,胡迎春,陈睦虎. YAP及P-YAP在RAW264.7细胞脓毒症模型中的表达.西部医学,2018,30(4):489-492.
[14] Yi L, Huang X, Guo F, Zhou Z, Dou Y, Huan J. Yes-associated protein (YAP) signaling regulates lipopolysaccharide-induced tissue factor expression in human endothelial cells.Surgery, 2016, 159(5):1436-1448.
[15] Song K, Kwon H, Han C, Chen W, Zhang J, Ma W, Dash S, Gandhi CR, Wu T. Yes-associated protein in Kupffer cells enhances the production of pro-inflammatory cytokines and promotes the development of non-alcoholic steatohepatitis. Hepatology, 2019,10:30990
[16] Falc?o ALE, Barros AGA, Bezerra AAM, Ferreira NL, Logato CM, Silva FP, do Monte ABFO, Tonella RM, de Figueiredo LC, Moreno R, Dragosavac D, Andreollo NA. The prognostic accuracy evaluation of SAPS 3, SOFA and APACHEⅡ scores for mortality prediction in the surgical ICU: an external validation study and decision-making analysis. Ann Intensive Care, 2019, 9 (1):18.
(收稿日期:2020-03-31)
(本文编辑:洪悦民)

