膜分离技术在氨基葡萄糖生产中的应用
柳文广,赵士明,熊福军,彭文博
(江苏久吾高科技股份有限公司,江苏 南京 210061)
氨基葡萄糖(C6H13NO5)又称葡萄糖胺、葡糖胺或氨基葡糖,是葡萄糖的一个羟基被氨基取代后的化合物。氨基葡萄糖是蛋白质或脂类糖基化反应中的重要前体。氨基葡萄糖是人体内合成的物质,是形成软骨细胞的重要营养素,是健康关节软骨的天然组织成分。随着年龄的增长,人体内的氨基葡萄糖合成量越来越低,满足不了人体的正常需要,关节软骨不断退化和磨损。美国、欧洲和日本的大量医学研究表明,氨基葡萄糖可以帮助修复和维护软骨,并能刺激软骨细胞的生长,是一类治疗骨关节炎的特异性药物[1-3]。
陶瓷膜是无机膜的一种,属于膜分离技术中的固体膜材料。主要以不同规格的氧化铝、氧化钛、氧化锆以及氧化硅等无机陶瓷材料作为支撑体,经表面涂膜,高温烧制而成,是用于对液态、气态混合物进行过滤分离的高科技新材料[4]。商品化的陶瓷膜通常具有三层结构[5],即分离层、过渡层及支撑层,呈非对称分布[6],其孔径规格为0.8~1 000 nm不等,过滤精度涵盖微滤、超滤甚至纳滤[7],随着人们对发酵产品品质的不断追求,陶瓷膜在该领域的应用不断获得用户的认可。
针对发酵法生产的氨基葡萄糖发酵液,目前全国普遍采用传统的过滤工艺对其进行处理除杂,其中存在产品收率低、过滤精度不够且耗时耗力的问题。无机陶瓷膜技术具有操作温度高、分离效率高、不添加化学试剂,非常适用于食品与保健行业中高热敏性、易挥发和对化学试剂敏感的操作体系[8]。同时发酵液中蛋白质的存在对氨基葡萄糖的后续提取不利,不利于氨基葡萄糖的结晶,影响氨基葡萄糖的纯度,因此氨基葡萄糖中可溶蛋白的去除,成为氨基葡萄糖生产工艺过程中非常关键的一步。传统的过滤方式对该发酵液中的可溶蛋白几乎没有任何截留能力,需要在后续加入大量的有机溶剂沉淀蛋白质,不仅会消耗大量的有机溶剂,而且不利于氨基葡萄糖的后续纯化[9],该研究采用陶瓷膜过滤,对氨基葡萄糖发酵液中的可溶蛋白进行去除,以减少生产成本、提高产品品质。
1 材料与方法
1.1 材料与试剂
氨基葡萄糖发酵液:山东润德生物科技有限公司;乙腈-磷酸缓冲液(65∶35):北京迈瑞达科技有限公司。
1.2 仪器与设备
JW-T-0.2陶瓷膜设备:江苏久吾高科技股份有限公司;CN61M/P200II液相色谱仪:北京中西远大科技有限公司;UV757 紫外分光光度计:上海精密仪器仪表有限公司。
1.3 方法
1.3.1 陶瓷膜工艺流程
膜分离设备示意图见图1[10],该设备由泵提供动力,物料在设备中连续循环,清液不断由渗透侧排出,被截留住的杂质不断被浓缩,当固含值达到一定量时,浓缩液由设备底端排污阀门排出,单组件陶瓷膜设备,膜有效过滤面积为0.23 m2,膜通道为19孔,通道直径为4 mm,长度为1 016 mm,孔径为200 nm、50 nm和8 nm。

图1 膜设备示意图Fig.1 Schematic diagram of membrane equipment
1.3.2 分析方法与计算公式
(1)氨基葡萄糖的检测
采用高效液相色谱法进行测定[11-12]:采用Hedera NH2色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈-磷酸缓冲液(65∶35,V/V),流速为1.0 mL/min,可变波长紫外检测器,检测波长为195 nm。
(2)蛋白质浓度的测定[13]
可利用在波长280 nm及260 nm处的吸光度值差进行测定。
Cd=1.45 A280nm-0.74 A260nm
式中:Cd为蛋白质质量浓度,g/L;A280nm为蛋白质溶液在波长280 nm处的吸光度值;A260nm为蛋白质溶液在波长260 nm处的吸光度值。
(3)陶瓷膜通量的计算

式中:X为通量,L/(m2·h);Vt为一定时间内渗透液的体积,L;t为取样时间,h;S为陶瓷膜的膜面积,m2。
(4)回收率的计算

式中:η为回收率,%;C1为渗透液中氨基葡萄糖有效物质的质量浓度,g/L;V1为渗透液的体积,L;C2为原液中氨基葡萄糖有效物质的质量浓度,g/L;V2为渗透液的体积,L。
(5)截留率的计算

式中:R为截留率,%;Cp为渗透液质量浓度,g/L;Cb为原料液质量浓度,g/L。
(6)浓缩倍数计算方法

式中:C为浓缩倍数;My为原液质量,g;Mn为浓缩液质量,g。
(7)纯水恢复系数计算

式中:r表示纯水恢复系数,%;JQ为清洗过后纯水的通量,L/(m2·h);J0表示陶瓷膜初始纯水通量,L/(m2·h)。
1.3.3 运行参数对陶瓷膜实验的影响
陶瓷膜设备运行的主要的影响因素为主要表现为膜孔径、温度、pH、膜面流速和浓缩倍数,具体表现如下:
(1)膜孔径:本次实验中膜孔径的选择根据江苏久吾高科实际生产的孔径进行选型,考察了8 nm、50 nm、200 nm孔径的陶瓷膜在该发酵液中的应用;
(2)温度:考察的温度分别为25~65 ℃之间,每隔5 ℃设定一个参数,考察不同温度对过滤效果的影响;
(3)pH:该发酵液出锅pH约为2,因此在未进行考察合适pH值前,不对其进行调酸操作,后续考察的pH范围主要是:2.0~6.0每隔0.5设定一个参数,考察不同pH对过滤效果的影响;
(4)膜面流速:考察3.5 m/s、4.5 m/s和5.5 m/s三种不同的膜面流速对过滤效果的影响;
(5)浓缩倍数:根据陶瓷膜设备的运行能力,湿固含量需要控制在50%以下,设定浓缩2倍、3倍和4倍,考察不同浓缩倍数对过滤效果的影响。
2 结果与分析
2.1 不同孔径对氨基葡萄糖的过滤效果
以氨基葡萄糖发酵液为本次实验原料,分别用8 nm、50 nm和200 nm陶瓷膜实现发酵液的分离纯化,本次实验同取50 kg物料,设定浓缩倍数为3倍,物料温度恒定在55 ℃,设定膜面流速为3 m/s,pH保持原料pH值约为2,考察不同孔径的陶瓷膜的通量稳定性以及对氨基葡萄糖发酵液的蛋白截留效果,结果见图2和表1。
由图2可以得出,陶瓷膜除杂过程中随着浓缩倍数的增加通量却逐渐下降,下降的原因是陶瓷膜表面的浓差极化以及对部分杂质的吸附污染,从而导致其过滤阻力增大。200 nm陶瓷膜平均通量为149.1 L/(h·m2),对发酵液中可溶蛋白截留率为33.1%;50 nm陶瓷膜平均通量为145.8 L/(h·m2),对发酵液中可溶蛋白的截留率为45.6%;8 nm陶瓷膜平均通量139 L/(h·m2),对发酵液中可溶蛋白的截留率为45.9%。通过对比可知,200 nm陶瓷膜的通量虽然较高,但对杂蛋白截留率偏低;8 nm、50 nm陶瓷膜对氨基葡萄糖发酵液的蛋白截留以及平均通量相差不大,故后续实验可继续考察这两种孔径陶瓷膜的过滤效果。

图2 8 nm、50 nm、200 nm孔径的陶瓷膜对通量的影响Fig.2 Effect of 8 nm,50 nm and 200 nm ceramic membrane on fluxes

表1 8 nm、50 nm、200 nm陶瓷膜对可溶蛋白截留率的影响Table 1 Effect of 8 nm,50 nm and 200 nm ceramic membranes on retention rates of soluble protein
2.2 操作参数对陶瓷膜过滤的影响
2.2.1 最佳过滤pH值的选择
pH值直接影响氨基葡萄糖发酵液中蛋白质的电离度和电荷特性,适当调节发酵液的pH使该氨基葡萄糖发酵液达到等电点,使蛋白质、核酸等大分子物质沉降而析出[13],通过陶瓷膜过滤可以明显增加蛋白质的截留率,有利于后期氨基葡萄糖成品的结晶,提高产品品质。
采用50 nm和8 nm的陶瓷膜对设置的不同梯度的pH值的发酵液进行实验,每批次过滤物料均为50 kg,平均压力均设定为0.26 MPa,浓缩倍数均为3倍,设定膜面流速为3 m/s,每批次实验分别记录平均通量的变化和蛋白截留率的变化,结果如图3。pH值对8 nm及50 nm陶瓷膜蛋白截留率的影响见表2。
由于发酵液pH值越接近等电点蛋白质分子在膜表面的凝聚倾向越大,且pH值会影响陶瓷膜表面的特性[13],由图3可知,不同pH值,8 nm和50 nm陶瓷膜的通量变化趋势几乎相同,具体表现在pH值在2.0~3.5之间其平均通量呈现下降的趋势,pH值在4.0~6.5之间其通量呈现逐渐上升的趋势,再结合表2可以得出,8 nm陶瓷膜和50 nm陶瓷膜在pH值为3.5~4.0时对蛋白的截留率最高,由此可以看出,该发酵液的等电点在pH为3.5~4.0时,发酵液中的可溶蛋白的溶解度最低,蛋白质表面带的电荷最少,有利于陶瓷膜对该发酵液中可溶蛋白的截留,而此时膜表面运行的阻力增大,因此pH值为3.5~4.0时的陶瓷膜的通量较低。

图3 pH值对8 nm和50 nm陶瓷膜平均通量的影响Fig.3 Effect of pH on average flux of 8 nm and 50 nm ceramic membranes

表2 pH值对8 nm及50 nm陶瓷膜蛋白截留率的影响Table 2 Effect of pH value on protein retention rates of 8 nm ceramic membrane
2.2.2 温度对陶瓷膜过滤的影响
温度的高低对陶瓷膜过滤的通量影响较大,温度越高分子的热运动越快,且黏度越低,通量越大[14-15],但是相应的能耗越高,且过高的温度会使氨基葡萄糖发酵液中的部分有效物质变性,同时增大部分可溶蛋白的透过性,影响产品品质,如果温度过低则陶瓷膜过滤通量较低,需要增加陶瓷膜过滤面积,明显增大了生产的投资成本,本次实验重点考察温度对其过滤通量和蛋白截留率的影响,结果见图4和表3。
8 nm和50 nm陶瓷膜运行时均保持物料pH值为3.5~4.0,设备平均压力为0.26 MPa,膜面流速为3 m/s,每次过滤物料50 kg,浓缩倍数为3倍。由图4和表3可知,其陶瓷膜的通量和蛋白截留率变化趋势相似,由于温度上升,分子的热运动速度加快,同时温度升高发酵液的黏稠度降低,故陶瓷膜过滤通量逐渐上升,但是当温度上升到60 ℃后,陶瓷膜对蛋白质的截留率下降约10%,且过滤过后的陶瓷膜透过液颜色变深,考虑到工业化生产的实用性和品质的可靠性,最佳温度应控制在50~55 ℃。

图4 温度对8 nm和50 nm陶瓷膜通量的影响Fig.4 Effect of temperature on flux of 8 nm ceramic membrane

表3 温度对50 nm和8 nm陶瓷膜蛋白截留率的影响Table 3 Effect of temperature on protein retention rates of 50 nm and 8 nm ceramic membranes
2.2.3 膜面流速对陶瓷膜过滤的影响
用8 nm、50 nm陶瓷膜分别采用3.5 m/s、4.5 m/s、5.5 m/s膜面流速,该三种膜面流速对应的物料重量均为100 kg,温度为55 ℃,pH值控制在3.5,过滤时间控制在150 min,考察其在不同膜面流速的情况下其通量的变化趋势,结果见图5和表4。

图5 膜面流速对陶瓷膜瞬时通量的影响Fig.5 Effect of membrane velocity on instantaneous flux of ceramic membrane

表4 膜面流速对陶瓷膜蛋白截留率的影响Table 4 Effect of membrane velocity on protein retention rates of ceramic membrane
由图5可以看出,不同的膜面流速其瞬时通量的大小为3.5 m/s<4.5 m/s<5.5 m/s,由于发酵液体系中对膜形成的污染源:多糖、胶体、细胞碎片、淀粉、油脂、无机盐垢等[16]。在一定的膜面流速范围内,膜面流速增加,膜通量略有增大这是因为膜面流速的增加,会减缓膜表面的浓差极化,减少料液组分对膜表面的污染程度,使得膜通量增大[17]。从图5中可以得出,4.5 m/s的膜面流速终点通量比3.5 m/s的膜面流速高约30%,其效果显著,但是5.5 m/s的膜面流速比4.5 m/s的膜面流速的终点通量高3%左右,提升速度明显减缓,从表4可以得出,膜面流速的改变对杂蛋白截留率的影响不大,考虑到膜面流速越大,生产的能耗越高,综合以上各种分析该实验过程中选定的膜面流速为4.5 m/s。
2.3 不同浓缩倍数和透析水量对陶瓷膜收率的影响
取100 kg氨基葡萄糖发酵液,调酸至pH为3.5~4.0,物料过滤温度控制为55 ℃,膜面流速控制为4.5 m/s,设备运行平均压力控制为0.26 MPa,用8 nm和50 nm陶瓷膜分别进行实验,已知该发酵液固含量为16%,故分别设定浓缩倍数为2、3、4倍,达到浓缩倍数,向浓缩液中添加透析水,透析水的添加量以浓缩液的倍数来进行计算,添加透析水的目的是让浓缩液中的有效物质最大量的透过,提高产品回收率,按实验要求添加透析水后的浓缩液中总的有效物质含量≤250 g,实验结果见图6和表5。

图6 浓缩倍数对陶瓷膜平均通量的影响Fig.6 Effect of concentration multiple on average flux of ceramic membrane

表5 不同浓缩倍数和加水量对回收率和蛋白截留率的影响Table 5 Effect of different concentration multiple and water addition on recovery rate and protein retention rates
由图6和表5可知,当物料的浓缩倍数为2倍时,将该物料的收率提升至96%以上,则添加的透析水量为5倍浓缩液的水量,三组数据的平均通量为162.3 L/(h·m2),当浓缩倍数为3倍时,添加的透析水量为浓缩液水量的2.5倍,通量为152 L/(h·m2),当浓缩倍数为4倍时,其添加的透析水量为3.3倍浓缩液水量,通量为122.3 L/(h·m2),因为当浓缩倍数较低其物料的浓缩液中的固含量低,对膜通量的污染程度较低,同时后期添加的透析水量较多有利于减缓膜孔的堵塞,通量较大,对应的浓缩倍数越高,固含量也会逐渐增加,较大的固含量加剧了陶瓷膜的浓差极化[18],因此其通量较低,但是从表5可以得知,当浓缩倍数为2倍时想要做到目标收率值,其添加的透析水量较多,透析水量的成倍增加会增大后期工艺处理的压力,不利于后期的生产,同时浓缩倍数高,添加的透析水量会逐渐减少,但是陶瓷膜的通量也较低,会增加陶瓷膜的投资成本,且该实验中当浓缩倍数为4倍时通量下降约30%,收率变化不大,从表5中可以得出随着浓缩倍数的增加其陶瓷膜对该发酵液的杂蛋白截留率呈现逐渐下降的趋势,浓缩3倍相对浓缩2倍下降0.2%,当浓缩4倍后,蛋白截留率下降3.4%,分析其原因为随着浓缩倍数的上升,浓缩液的蛋白浓度逐渐变浓,更容易透过膜孔径。
综上实验数据的分析可得:选定陶瓷膜浓缩倍数为3倍,添加3.3倍浓缩液质量的透析水量可将氨基葡萄糖的收率达到97%以上。
2.4 与传统工艺对比
板框压滤需要经常对其进行密封性检查,一旦密封性出现问题则会出现过滤压力不足进而导致过滤效率下降,过滤产品不达标等一些列问题[19-20],与传统板框过滤方式对比,陶瓷膜过滤效率高,自动化程度高,产品效果好,陶瓷膜设备过滤收率通过对比可提高约10%,对杂蛋白的截留率达到49%,提高约14%,且板框需要添加助滤剂,浓渣利用率低,陶瓷膜处理后的浓缩液可进行动物饲料的制作,对环境和企业收益也大有帮助。
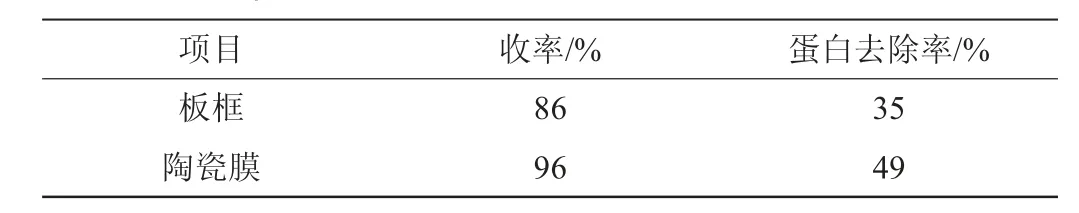
表6 陶瓷膜与板框运行效果对比Table 6 Comparisons of the operating effect of ceramic membrane and plate frame
3 结论
陶瓷膜在氨基葡萄糖上的应用具体优化结果如下:选用50 nm或者8 nm的陶瓷膜,调节物料pH为3.5~4.0,过滤温度为50~55 ℃,膜面流速控制为4.5 m/s,浓缩倍数为3倍,且添加3.3倍浓缩液质量的透析水可使氨基葡萄糖有限物质的回收率达到97%以上。
陶瓷膜在氨基葡萄糖上的应用与传统的板框对比不仅会提高产品的收率而且会提升产品的品质,同时陶瓷膜具有良好的耐高温,耐酸碱,性能易恢复等优点,因此在氨基葡萄糖过滤领域陶瓷膜值得大力推广。

