锁掷孢酵母产胞外多糖发酵条件优化
裴芳艺,薛 迪,马岩石,刘宇超,刘得水,李 慧,刘 韩
(齐齐哈尔医学院 科研处,黑龙江 齐齐哈尔 161000)
酵母胞外多糖(exopolysaccharide,EPS)是酵母在生长代谢过程中产生并分泌到细胞外的长链、高分子聚合物[1-2]。相比酵母发酵生成的胞内多糖和胞壁多糖而言,合成的EPS更易与菌体分离,能通过深层发酵实现工业化生产,且具有生产周期短、不受季节气候影响等优点[3]。酵母EPS可作为凝固剂、乳化剂和抗氧化剂等被广泛应用于食品、化工、制药等多种领域,具有较强的市场竞争力和广阔的发展前景[4-5]。但目前的研究显示,酵母EPS产量不高,不能达到大规模生产的要求,因此提高酵母EPS的产量是目前急需解决的问题[6-7]。
微生物发酵产EPS不仅受自身性质影响,而且发酵培养条件(如培养应温度、培养时间、培养基初始pH值)也对微生物产EPS影响显著[8]。微生物只有在特定环境下,生长到稳定期才开始逐渐积累EPS,同一种微生物在不同环境下可以产生不同种类和产量的EPS。因此,研究微生物产EPS的培养条件就显得格外重要[9]。微生物产EPS的最佳温度和pH值通常与其生长所需的最适温度和pH值有所不同,为最大限度的提高EPS产量,需通过控制不同的理化参数[10]。随着研究的不断深入,多种产EPS的酵母菌被分离鉴定出来,如赭色掷孢酵母(Sporobolomyces salmonicolor)AL1[11]、胶红酵母(Rhodotorula mucilaginosa)GUMS16[12]、黄色隐球菌(Cryptococcus flavus)A51[13]、罗伦隐球酵母(Cryptococcus laurentii)AL100[14]、斯达油脂酵母(Lipomyces starkeyi)VITMN03[15]。并且通过对产糖条件的优化,大幅度提高EPS产量。其中近粉红锁掷孢酵母(Sporidiobolus pararoseus)属于锁掷孢酵母属,作为一类非常规酵母,早期研究主要集中在分类学、环境治理和生物防治等方面[16-17]。但目前对S.pararoseus产EPS的研究相对较少,因此,筛选出新型能够高产EPS的S.pararoseus是本研究重点。
本研究以近粉红锁掷孢酵母(Sporidiobolus pararoseus)PFY-Z1为供试菌株,通过测定其在4种产糖培养基中合成EPS的含量,筛选出一种最适发酵产糖培养基。并以此为基础,通过单因素试验、Plackett-Burman(PB)试验和中心组和设计(central composite design,CCD)试验,优化菌株产EPS的最佳发酵条件。为S.pararoseusPFY-Z1 EPS的分离纯化以及工业化生产提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
近粉红锁掷孢酵母(Sporidiobolus pararoseus)PFY-Z1:分离自齐齐哈尔地区葡萄园土壤。
1.1.2 试剂
葡萄糖、蔗糖、硫酸铵、硫酸镁、氯化钙、磷酸氢二钾、硫酸二氢钾、氯化钠、苯酚、硫酸、三氯乙酸(均为分析纯):天津市江天化工技术有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)琼脂培养基、YPD液体培养基、WL营养琼脂:青岛高科技工业园海博生物技术有限公司。
产糖1号培养基:蔗糖60 g/L,蛋白胨2 g/L,硫酸铵1 g/L,硫酸镁0.35 g/L,磷酸二氢钾1 g/L,蒸馏水1 L,pH值6,115 ℃灭菌20 min[18]。
产糖2号培养基:葡萄糖15 g/L,硫酸铵15 g/L,硫酸镁1.8 g/L,氯化钙0.28 g/L,磷酸氢二钾0.24 g/L,氯化钠0.6 g/L,蒸馏水1 L,pH值7.0,121 ℃灭菌15 min[19]。
产糖3号培养基:葡萄糖20 g/L,蛋白胨10 g/L,硫酸铵15 g/L,磷酸氢二钾2.5 g/L,蒸馏水1 L,pH值6.6,121 ℃灭菌15 min[20]。
产糖4号培养基:葡萄糖50 g/L,硫酸铵2 g/L,磷酸二氢钾1 g/L,酵母浸粉1 g/L,蒸馏水1 L,pH值6,115 ℃灭菌20 min[21]。
1.2 仪器与设备
5804R台式高速大容量冷冻离心机、22331Hamburg高速离心机:德国艾本德公司;V-5000可见分光光度计:上海元析仪器有限公司;FE28 pH计、AL204电子天平:梅特勒-托利多集团;HZQ-211C落地振荡器、DHP-9162电热恒温培养箱:上海一恒科学仪器有限公司;CX31光学显微镜:日本奥林巴斯公司。
1.3 实验方法
1.3.1 菌株生长特性
将活化后的菌株按2%(V/V)的接种量分别接种于4种产糖培养基中,28 ℃、140 r/min培养5 d,每隔12 h取样,测定菌株在波长600 nm处的吸光度值和pH值,探究菌株的生成及pH值变化情况,设置三组平行样。
1.3.2 胞外多糖的提取
多糖的提取参照DU R P等[22]的方法。将活化后的菌株按2%(V/V)接种量接种至产糖培养基,28 ℃140 r/min培养5 d。发酵液4 ℃、11 000 r/min离心20 min。上清液中加入3倍体积分数95%的乙醇,4 ℃静置24 h后,4 ℃、11 000 r/min离心20 min,用适量去离子水溶解多糖沉淀,获得粗EPS。
1.3.3 胞外多糖含量的测定
通过乙醇沉淀法获得EPS,以葡萄糖为标准制作标准曲线[23],利用苯酚-硫酸法[24]测定菌株在4种培养基中发酵产EPS的含量。取EPS溶液1 mL与1 mL 6%的苯酚溶液、5 mL浓硫酸混匀,静置冷却至室温后,于波长490 nm处测定吸光度值。
1.3.4 单因素试验优化产糖条件
将菌株接种于最适产糖培养基中,在不同培养条件下测定菌株产EPS的含量,确定其最佳发酵条件。
分别考察不同温度(22 ℃、25 ℃、28 ℃、31 ℃、34 ℃)、转速(0、70 r/min、140 r/min、210 r/min、280 r/min)、接种量(1%、2%、3%、4%、5%、6%、7%,V/V)、装液量(50 mL/250 mL、75 mL/250 mL、100 mL/250 mL、150 mL/250 mL、200 mL/250 mL)、培养时间(1 d、3 d、5 d、7 d、9 d)、初始pH值(2、3、4、5、6、7、8)对菌株产胞外多糖的影响。
1.3.5 PB试验设计
EPC模式的最主要优势在于建设单位只需要进行一次招标,只需与施工总承包方签订合同。因此,招标和合同管理的工作量将会大大减少,简化了许多流程,同时责权分明。
根据单因素试验结果,选择影响EPS产量的6个因素(温度、转速、接种量、装液量、培养时间、初始pH值)为评价因素,以EPS产量Y为响应值,将每个因素分为高(+1)、低(-1)2个水平。PB试验设计因素与水平见表1,共进行15组试验。
1.3.6 CCD试验设计
根据PB试验结果,以EPS产量(Y)为响应值,选择对结果影响较大的因素培养温度、培养时间、初始pH值,进行CCD试验,得到最优方案。CCD试验设计因素与水平见表2。

表2 中心组合试验设计因素与水平Table 2 Factors and levels of central composite design
1.3.7 验证试验
将活化后的菌株接种于最适产糖培养基中,按优化后的发酵条件培养。通过乙醇沉淀法获得EPS,利用苯酚-硫酸法测定EPS含量。
1.3.8 数据统计分析
响应面试验设计使用Design Expert 8.0;统计分析和绘图使用Excel 2016。
2 结果与分析
2.1 菌株生长特性分析及培养基的选择
菌株S.pararoseusPFY-Z1在4种产糖培养基中的生长曲线及pH变化见图1。

图1 菌株PFY-Z1生长曲线和pH变化曲线Fig.1 Growth curve and pH variation curve of strain PFY-Z1
由图1可知,菌株在产糖2号培养基中生长情况优于其余3种培养基,在发酵24 h时进入对数生长期,72 h时OD600nm值达最大,为1.123±0.006,之后进入稳定期,随着菌株生长速度的增加,pH值下降速度增加,pH值由初始7.0降至2.74,说明菌株在发酵过程中产生酸性物质。4种产糖培养基中,菌株在产糖1号培养基中生长较差,最大OD600nm值为0.730±0.003,仅为产糖1号培养基的65%。可能是该培养基的碳源与其他3种培养基不同,这也说明以蔗糖为单一碳源进行S.pararoseusPFY-Z1发酵可能不利于菌株自身生长。这与菌株生理生化试验相一致,即菌株对蔗糖的利用能力较弱。生长比较产糖2号培养基和3号培养基发现,菌株的生长的最大OD600nm值相差不大,但产糖3号培养基菌株生长进入对数期的时间较长,会延长培养时间。4种培养基发酵终止时pH值相差不大,在2.7~3.2范围内,说明菌株在4种培养基内均发酵产酸。这与赵英杰等[25-27]的研究相一致。因此,综合菌株生长状况、发酵时长、成本节约等因素考虑,产糖2号培养基最适宜用作S.pararoseusPFY-Z1的培养。
2.2 最适产糖培养基的选择
通过苯酚-硫酸法制作葡萄糖标准曲线,得到葡萄糖标准曲线方程为:y=9.855x+0.009,R2=0.999。菌株S.pararoseusPFY-Z1在不同培养基中EPS产量分别为(1.13±0.06)g/L(产糖1号培养基)、(3.31±0.06)g/L(产糖2号培养基)、(2.71±0.11)g/L(产糖3号培养基)、(0.60±0.09)g/L(产糖4号培养基)。其中菌株在产糖2号培养基产糖能力最强,与其生长特征相符合。不同酵母菌发酵产EPS,在碳源的选择上有所不同。本研究选择产糖2号培养基进行发酵产糖条件优化试验。
2.3 单因素试验优化菌株产EPS分析
2.3.1 培养温度对EPS的影响
培养温度对菌株S.pararoseusPFY-Z1的产EPS影响结果见图2。由图2可知,培养温度在22~31 ℃时,菌株PFY-Z1上清液中EPS含量相差不大,在3.0 g/L左右,其中在培养温度为28 ℃时,EPS含量最高,为(3.36±0.08)g/L。当培养温度为34 ℃时,EPS含量明显低于其他温度,可能是高温影响菌株的生长速度,影响合成EPS的酶活性,从而降低菌株合成EPS的含量。大量研究表明,酵母菌的最适产糖培养温度为20~30 ℃[27],本研究中菌株的最适培养温度为28 ℃。

图2 培养温度对菌株PFY-Z1胞外多糖产量的影响Fig.2 Effect of culture temperature on exopolysaccharide production of strain PFY-Z1
2.3.2 摇床转速对EPS的影响
摇床转速对菌株PFY-Z1的影响见图3。由图3可知,摇床转速可以影响发酵液中的溶氧量,当摇床转速较低时,单位时间内培养液的溶氧量也随之降低,降低菌体的生长速度和EPS生成速率,随着摇床转速的不断增加,菌体生长速度和EPS合成速度增加,但摇床速度过大时,由于剪切力过大,不利于菌株生长,使菌体过早衰亡,从而降低EPS产量。当摇床转速为210 r/min时,菌株PFY-Z1产EPS的含量最高,为(3.77±0.11)g/L。因此,选择最佳摇床转速为210 r/min。

图3 转速对菌株PFY-Z1胞外多糖产量的影响Fig.3 Effect of rotation speed on exopolysaccharide production of strain PFY-Z1
2.3.3 接种量对EPS的影响
接种量对菌株PFY-Z1产EPS含量的影响见图4。由图4可知,随着接种量的增加,菌株产EPS的含量呈现先升高后降低的趋势。接种量过低时,菌株生长到对数生长期所需时间较长。接种量过大,使得培养基内的营养物质过早消耗,不利于菌株积累合成EPS。当接种量为5%时,EPS含量最高为(4.10±0.08)g/L。因此,菌株的最适接种量为5%。

图4 接种量对菌株PFY-Z1胞外多糖产量的影响Fig.4 Effects of inoculum on exopolysaccharide production of strain PFY-Z1
2.3.4 装液量对EPS的影响
装液量对菌株PFY-Z1产EPS含量的影响见图5。

图5 装液量对菌株PFY-Z1胞外多糖产量的影响Fig.5 Effects of loading liquid volume on exopolysaccharide production of strain PFY-Z1
由图5可知,装液量较低对发酵液中EPS含量影响较大,这可能是由于营养物质较少导致的,大部分营养物质用于菌体生长,导致发酵后期营养物质不足,减小了EPS积累。当装液量为100 mL/250 mL时,EPS含量相对较高,为(4.12±0.07)g/L。因此,选择装液量100 mL/250 mL进行后续试验。
2.3.5 培养时间对EPS的影响
培养时间对菌株PFY-Z1产EPS含量的影响见图6。由图6可知,培养前3 d,菌株主要利用营养物质进行生长,产EPS的能力较低,培养5 d时,菌株生长进入稳定期,开始积累大量EPS,培养9 d时EPS产量最高,但培养5 d(4.14±0.09)g/L和培养9 d(4.17±0.10)g/L时EPS的产量变化不大,出于节约时间和成本的考虑,选择培养时间5 d进行后续试验。

图6 培养时间对菌株PFY-Z1胞外多糖产量的影响Fig.6 Effects of culture time on exopolysaccharide production of strain PFY-Z1
2.3.6 初始pH值对EPS的影响

图7 初始pH值对菌株PFY-Z1胞外多糖产量的影响Fig.7 Effects of initial pH value on exopolysaccharide production of strain PFY-Z1
菌株生长和分泌EPS都需要在最适的pH值条件下进行,pH值影响细胞膜功能、细胞形态和营养物质的代谢[28],而影响EPS的合成。初始pH值对菌株产EPS影响见图7。由图7可知,当初始pH值为2、3、8时,菌株EPS的合成受阻积累,这说明过酸或过碱的环境不仅不利于菌体生长,也会降低菌体产EPS的产量。初始pH值为4~7时,EPS产量呈现先上升后保持平稳,当pH值为5时,EPS产量最高,为(4.53±0.09)g/L,说明菌株在偏酸性环境下有利于EPS的积累。PAVLOVA K等[29]通过8株产糖酵母发酵产EPS前后的pH值测定发现,发酵24 h后,pH值从最初的5.3降至1.7~2.0,直至发酵结束,一直维持在这个水平上,说明EPS的积累需要在较低的pH值水平上。因此,选择初始pH值为5进行后续试验。
2.4 PB试验分析
在单因素试验的基础上,PB试验设计及结果见表3,回归分析结果见表4。

表3 PB试验设计及结果Table 3 Design and results of PB experiments

表4 PB试验回归分析结果Table 4 Regression analysis results of PB experiments
由表4可知,模型F值为62.98,两水平析因试验模型项显著(P=0.000 2<0.01),表明该模型具有重要意义,决定系数R2=0.986 9,说明存在98.69%的试验数据可用该模型解释,调整R2adj=0.971 3,二者均接近1,信噪比=23.621(>4),证明该模型可以很好的拟合试验数据。各变量对EPS影响显著程度依次为X5>X1>X6>X4>X3>X2,即培养温度、培养时间和初始pH对菌株产EPS影响显著(P<0.01)。根据PB试验结果,得到模型拟合方程如下:Y=4.26-0.17X1+0.014X2+0.039X3-0.042X4+0.27X5+0.11X6。
2.5 CCD试验分析
在PB试验的基础上,CCD试验设计水平及响应值EPS含量见表5,回归分析见表6。
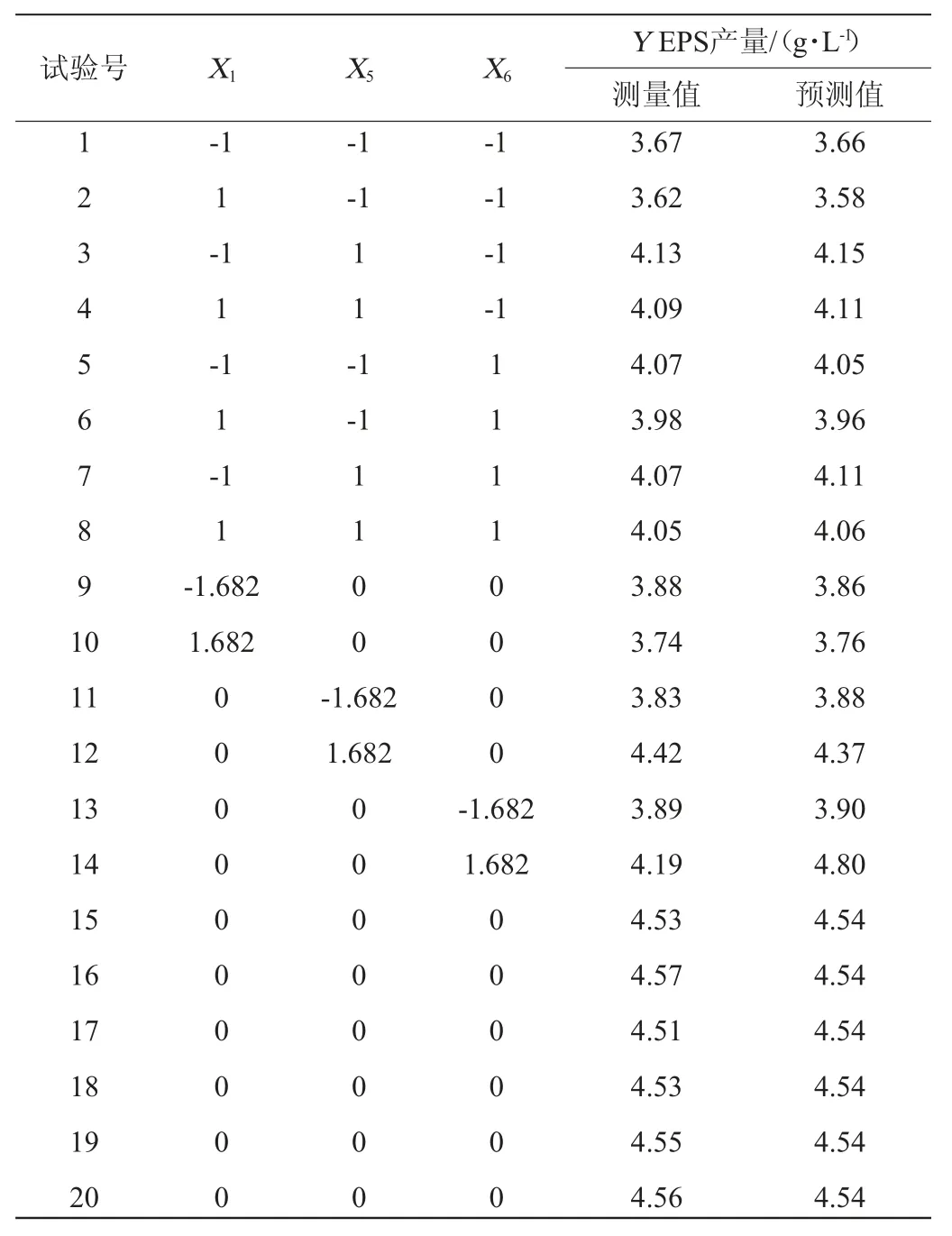
表5 中心组合设计试验设计及结果Table 5 Design and results of central composite design experiments

表6 中心组合设计试验回归分析结果Table 6 Results of the regression analysis of central composite design experiments

续表
由表6可知,该模型项差异极显著(P<0.000 1),决定系数R2=0.993 7,说明存在99.37%的试验数据可用该模型解释,调整决定系数R2adj=0.988 0,二者均接近1,信噪比=38.526(>4),变异系数CV=0.85%,表明试验结果所得模型能够较好的拟合试验数据。模型失拟项无显著性差异(P=0.077 1>0.05),说明所选模型拟合性较好,无其它显著性影响因素。因此,可以判断CCD试验设计是可靠的,该模型可以较好的应用于S.pararoseusPFY-Z1合成EPS的理论预测。各变量(X1、X5、X6)、交互项(X5X6)和各变量二次项(X12、X52、X62)对菌株产EPS有极显著影响(P<0.01),交互项(X1X5、X1X6)对菌株产EPS无显著影响(P>0.05)。根据CCD试验结果,得到模型拟合方程如下:EPS含量=4.54-0.032X1+0.15X5+0.085X6+0.010X1X5-0.002 5X1X6-0.11X5X6-0.26X12-0.15X52-0.18X62。模型方程中二次项系数均为负,可知该方程拟合的曲面开口朝下,方程有极大值。预测培养温度、培养时间和初始pH值分别为27.84 ℃、5.91 d和5.10时,方程有极大值,EPS的预测产量为4.58 g/L。
2.6 响应面交互作用分析
各因素及交互作用对S.pararoseusPFY-Z1产EPS影响如图8所示。变量间的相互作用关系可从等高线图和曲面图形状看出,椭圆形表明变量间的相互作用有显著影响,圆形则表明无显著影响。由图8可知,发酵时间和初始pH交互作用的等高线呈椭圆形,表明其交互作用显著(P<0.05)。

图8 各因素交互作用对菌株PFY-Z1胞外多糖产量影响的响应面和等高线Fig.8 Response surface plots and contour lines of effects of interaction between each factor on exopolysaccharide production of strain PFY-Z1
2.7 验证试验
CCD试验中预测最佳产EPS试验条件为培养温度、培养时间和初始pH值分别为27.84 ℃、5.91 d和5.10。根据实际条件,将其分别调整为28 ℃、6 d和5.10进行验证试验,在此条件下,S.pararoseusPFY-Z1的EPS含量实际值为(4.60±0.13)g/L,与预测值4.58 g/L无显著差异(P>0.05)。响应面法优化后,菌株PFY-Z1产EPS水平是优化前(3.31±0.06)g/L的1.40倍。
3 结论
本研究从4种酵母产糖培养基中选择出一种最适培养基(葡萄糖15 g/L,硫酸铵15 g/L,硫酸镁1.8 g/L,氯化钙0.28 g/L,磷酸氢二钾0.24 g/L,氯化钠0.6 g/L)。在此培养基的基础上,通过单因素试验和响应面试验优化,得到菌株最佳产糖发酵条件为培养温度28 ℃、培养时间6 d和初始pH值5.10,此时EPS含量为(4.60±0.13)g/L,是优化前(3.31±0.06)g/L的1.40倍。本研究为今后利用S.pararoseusPFY-Z1产EPS奠定了基础,同时也为S.pararoseus工业化制备和生产提供了理论依据。

