西南喀斯特峰丛洼地木本植物群落结构与多样性变化
张 芳,杜 虎,曾馥平,彭晚霞,宋同清,*
1 中国科学院亚热带农业生态研究所亚热带农业生态过程重点实验室, 长沙 410125 2 中国科学院环江喀斯特生态系统观测研究站, 环江 547100
物种组成是群落最基本的特征,是形成群落结构的基础。物种多样性对生态系统功能具有促进作用[1- 2],物种多样性是生物多样性在物种水平上的表现形式,可反映生物群落结构的复杂性,可作为判断生物群落结构变化或生态系统稳定性的指标[3- 4],是生态学领域研究的热点[5],同时物种多样性也是群落生态学的核心问题[6]。不同植物群落组成的生态系统功能和过程各不相同。长期固定样地监测生物多样性动态变化,获取树种组成和群落结构等动态特征数据,了解森林变化规律[7],可为森林保护、经营管理和研究提供理论依据[8]。对长期固定样地的研究已成为生物多样性研究领域的重点方向之一。
我国西南喀斯特地区生态系统的稳定性和抗干扰性差,产生了生境高度异质性、岩石裸露、土壤瘠薄且不连续、土壤总量和容量低、水土流失和岩溶干旱严重等自然胁迫环境,其适生植物具有嗜钙性、耐瘠性、耐旱性和石生性等限制特点[9],各种人为干扰导致喀斯特生态系统的严重退化和生物多样性严重丧失[10]。在不同的人为干扰强度下,植被形成了原生林、次生林、灌丛等3个不同的演替阶段[11]。喀斯特地区的石漠化和严重的生态退化一直以来是植被恢复和生态重建的难点地区。研究喀斯特地区不同恢复阶段植物群落结构和多样性变化,揭示物种的替代规律及群落结构的变化规律是喀斯特地区植被恢复的重要基础性工作[12]。盛茂银等[13]研究表明人为干扰严重破坏了物种组成从而直接影响植物群落演替进程。近年来,学者对不同植物群落结构变化进行了大量研究[14-16],西双版纳样地中物种组成和群落结构总体没有明显的变化,处于动态平衡中[17];其他样地群落种间竞争激烈,物种更替频繁,群落组成和结构不稳定。目前对喀斯特植被群落结构与多样性的动态变化研究较少[18- 21]。本研究基于灌木林、次生林、原生林动态监测样地于2007、2012、2017年的3次植被调查,探讨了喀斯特不同植被类型群落结构及多样性随时间的变化特征,为进一步探索3种植被类型群落结构特征、物种多样性共存机制、森林更新及其长期动态变化提供基础数据和资料。
1 研究区概况
研究区选择地处云贵高原南部边缘斜坡地带上的典型喀斯特峰丛洼地—广西环江毛南族自治县(全国石漠化综合治理县),地理坐标为107°51′—108°43′E,24°44′—25°33′N,喀斯特洼地的最高峰为1028.0 m。属亚热带季风气候区,年平均气温15.7℃,1月平均气温10.1℃,7月平均气温28℃,历年最低气温-5.2℃,无霜期290 d,年平均日照时数145.1 h,年平均降水量1389.1 mm,降雨集中于4—9月,占全年降雨量的70%,平均蒸发量为1571.1 mm,相对湿度平均为70%[19]。以典型喀斯特峰丛洼地为尺度,选择大才木连灌木林(1985年撂荒,2003年建立中国科学院环江喀斯特生态系统观测研究站)、下南古周次生林(1996年实施生态移民50%,退耕还林、还草、种果和封山育林等措施)和木论原生林(目前世界上喀斯特地区保存最完好、面积最大的原生林,1996年建设为国家自然保护区)为研究对象,3种植被类型相互距离≤80 km。
2 研究方法
2.1 植被调查
2007年在木连灌木林、古周次生林和木论原生林,分别选择坡度(整体坡度35°)、坡向、土壤母质、土壤类型(棕色石灰土)等立地条件基本一致的坡面和洼地连续体,从洼地向坡顶建立动态监测样地,投影面积为200 m × 40 m,其中坡面为160 m ×40 m,洼地为40 m × 40 m。用全站仪将整个样地划分为 20 m × 20 m 的样方,四角用PVC 管标记。将 20 m × 20 m 样方再划分为5 m × 5 m 样方,按CTFS标准(http://www. ctfs.si.edu)进行植被调查,即以5 m × 5 m 微型样方为基本单元,按顺时针挂牌标记每个胸径(DBH)≥ 1cm 的木本植物个体,记录树种名称、胸径、树高、冠幅和生长状况等,并进行挂牌标记[22]。每隔5年复查,即2012年和2017年分别进行第一次和第二次复查。
2.2 重要值计算
物种重要值的计算式为:重要值IV=(RF相对频度十RD相对显著度+RA相对多度)/3[23]。RF为相对频度、RD为相对显著度、RA为相对多度。依据物种的重要值的大小确定样地优势种。
2.3 物种多样性的计算方法
2.3.1 α多样性指数
式中,Pi=Ni/N,Pi为第i个物种的个体多度在样地中占所有物种多度之和的比例;N为样地内所有物种的个体总数;Ni为第i个物种的个体数[24];S为样方内物种数。
2.3.2 β多样性指数:群落相似系数
Sorensen指数:
Cs=2j/(a+b)
式中,j为2个对比群落中的共有种数;a和b分别为2个群落中各自包含的物种数。
2.4 生物量的计算
物种生物量采用本课题组前期研究所得的广西喀斯特森林乔木生物量回归拟合方程进行估算[25]。
2.5 数据处理
数据统计分析通过SPSS 19.0的Duncan′s进行多重比较,R 3.3.1软件完成;制图通过Origin 2018软件完成。
3 结果与分析
3.1 科、属、种变化
灌木林2007年共记录木本植物53种,隶属于26科42属,总个体数为4280株。2012年较2007年减少1个种,总个体数减少1639株。2017年较2012年减少了7属5种,其中减少13个种,新增8个种,总个体数减少了917株(表1)。
次生林2007年共记录木本植物62种,隶属于28科49属,总个体数为2611株。2012年较2007年减少了1属,其中减少1个种,新增1个种,种的数量不变,总个体数减少463株。2017年较2012年增加了4科7属6种,其中减少8个种,新增加了14个种,总个体数减少了107株(表1)。
原生林2007年共记录木本植物107种,隶属于41科81属,总个体数3224株。2012年较2007年减少了1科4属6种,总个体数减少693株。2017年较2012年增加了1科3属3种,其中新增10种,减少7种,总个体数减少了384株(表1)。
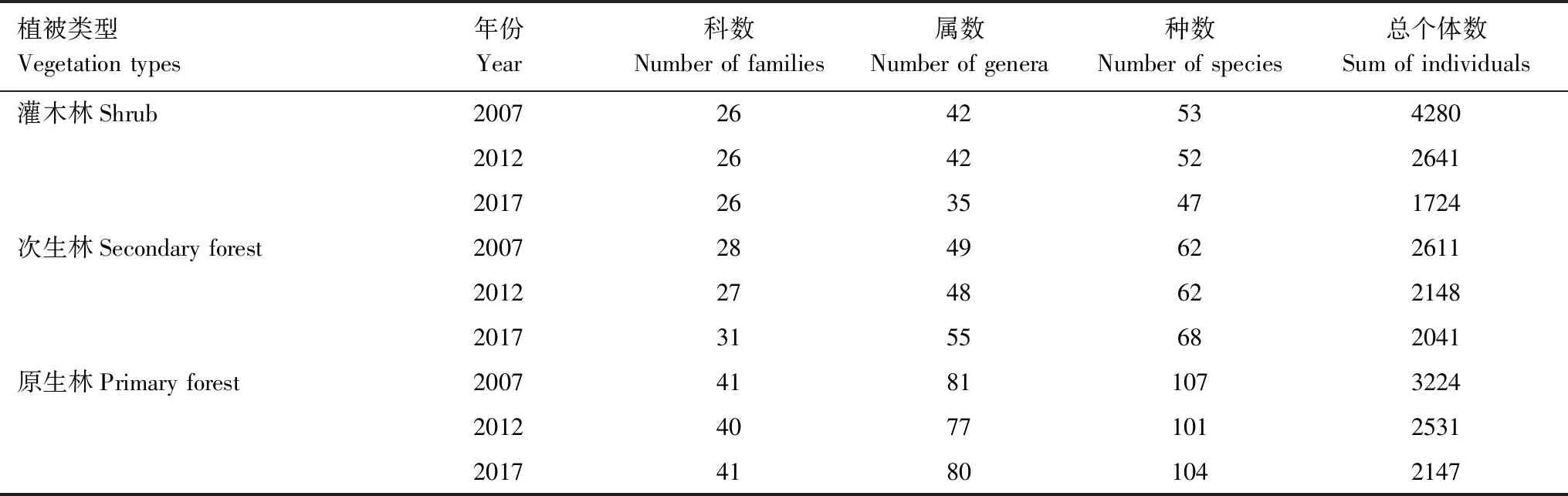
表1 三种植被类型科属种及个体数的变化
3.2 三种植被类型重要值的变化
灌木林2007、2012、2017年木本植物的重要值排名前五的物种均为黄荆、八角枫、小叶女贞(Ligustrumquihoui)、野桐(Mallotusjaponicus)、小巴豆(Crotontiglium)。黄荆和八角枫的重要值均大于10,其中黄荆占绝对优势。2007、2012、2017年重要值≥1的木本植物分别有22、20、22种,占总重要值的86.81%、85.38%、86.04%。2007—2017年,小叶女贞重要值增加最多;黄荆减少最多(表2)。
次生林2007、2012、2017 年木本植物的重要值排名前五的物种均为菜豆树、灰毛浆果楝、香椿、刀果鞍叶羊蹄甲(Bauhiniabrachycarpa)。菜豆树、灰毛浆果楝、香椿的重要值>10,占主要优势。2007、2012、2017 年重要值≥1的木本植物分别有23、23、24种,占总重要值的84.01%、85.15%、83.49%。2007—2017 年刀果鞍叶羊蹄甲重要值增加最多;菜豆树减少最多(表2)。
从原生林优势种重要值看,群落各物种优势度不突出,为多优势种种群。铁榄(Sinosideroxylonpedunculatum)保持优势地位。2007、2012、2017年重要值≥1的物种分别有31、31、32种,占总重要值的74.1%、75.11%、75.69%。2007—2017年枫香树重要值增加最多,小叶栾树减少最多(表2)。
3.3 三种植被类型群落结构变化
由图1可知,3种植被类型的胸径和树高均随恢复时间的增加而增加。胸径各年份差异显著,灌木林2007、2012、2017年平均胸径分别为3.08、3.76、3.98cm;次生林分别为3.22、4.20、6.21cm;原生林分别为4.71、5.87、6.60cm。2017年胸径、树高显著高于2007年,与2012年差异不显著。灌木林2007、2012、2017年平均树高分别为2.52、3.49、3.69m;次生林分别为2.81、4.08、4.98m;原生林分别为4.71、6.05、6.41m。
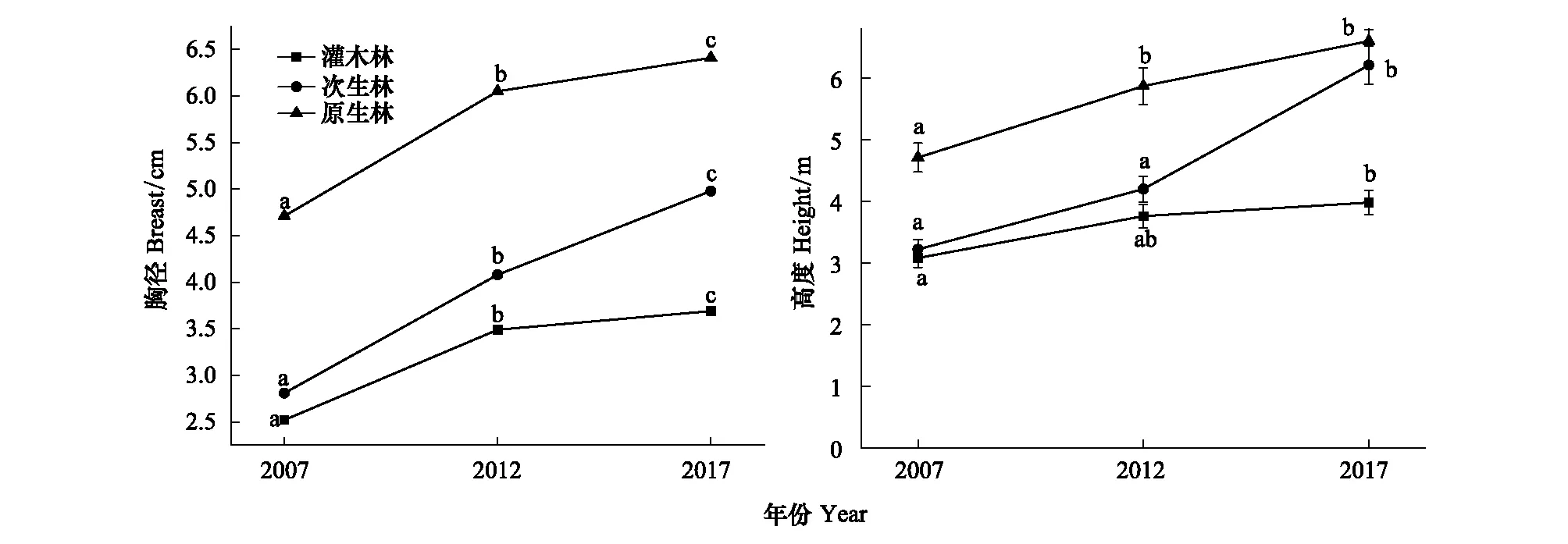
图1 三种植被类型群落结构变化Fig.1 Changes in the community structure of the three planting types
3.4 三种植被类型径级结构的变化
由图2可知,灌木林、次生林、原生林群落总体小径级个体很多,大径级个体较少,形成倒“J”形的样地径级结构。随胸径增大死亡个体数呈减少的趋势,个体主要集中于DBH<5cm和5—15cm径级,其他径级分布较少。灌木林DBH<5cm的个体在2007、2012、2017年分别占总多度的93.57%、83.57%、78.94%,十年间逐渐减少。DBH在5—15cm的植株分别占总多度的63.6%、15.9%、20.82%,十年间先减少后增加。DBH在15—25cm的植株分别占总多度的0.07%、0.22%、0.29%,十年间逐渐增加。

图2 三种植被类型径级结构变化Fig.2 Structural changes of diameter classes in three different vegetation types
次生林中DBH<5cm的植株在2007、2012、2017年分别占总多度的92.15%、78.86%、63.94%,十年间逐渐减少。DBH在5—15cm的径级,分别占总多度的6.74%、28.96%、34.1%,十年间逐渐增加。DBH在15—25cm的径级,分别占0.96%、0.88%、1.71%,十年间先减少后增加。DBH在25—35cm的植株分别占总多度的0.11%、0.42%、0.29%,十年间先增加后减少。DBH≥35cm的植株分别占总多度的0.04%、0.05%、0.1%,十年间逐渐增加。
原生林中DBH<5cm的植株在2007、2012、2017年分别占总多度的69.98%、56.93%、55.1%,十年间逐渐减少。DBH在5—15cm的植株分别占总多度的25.9%、36.67%、36.05%,十年间先增加后减少。DBH在15—25cm的植株分别占总多度的3.47%、5.33%、6.85%,十年间逐渐增加。DBH在25—35cm的植株分别占总多度的0.5%、0.83%、1.54%,十年间逐渐增加。DBH≥35cm的植株分别占总多度的0.09%、0.16%、0.37%,十年间逐渐增加。
3.5 三种植被类型优势种生物量变化
由表3可知,2007—2012年灌木林中除八角枫生物量降低外,其他物种均增加;2012—2017年小叶女贞、小巴豆生物量增加,其他物种均降低。10年间除八角枫生物量降低外,其他物种均增加。2007—2012年次生林中优势种生物量均增加;2012—2017年菜豆树生物量降低,其他物种均增加。10年间优势种生物量均增加。2007—2012年原生林中小叶女贞、掌叶木生物量减少,其他物种均增加;2012—2017年除菜豆树生物量增加外,其他物种均减少。10年间菜豆树生物量增加,其他物种生物量均减少。
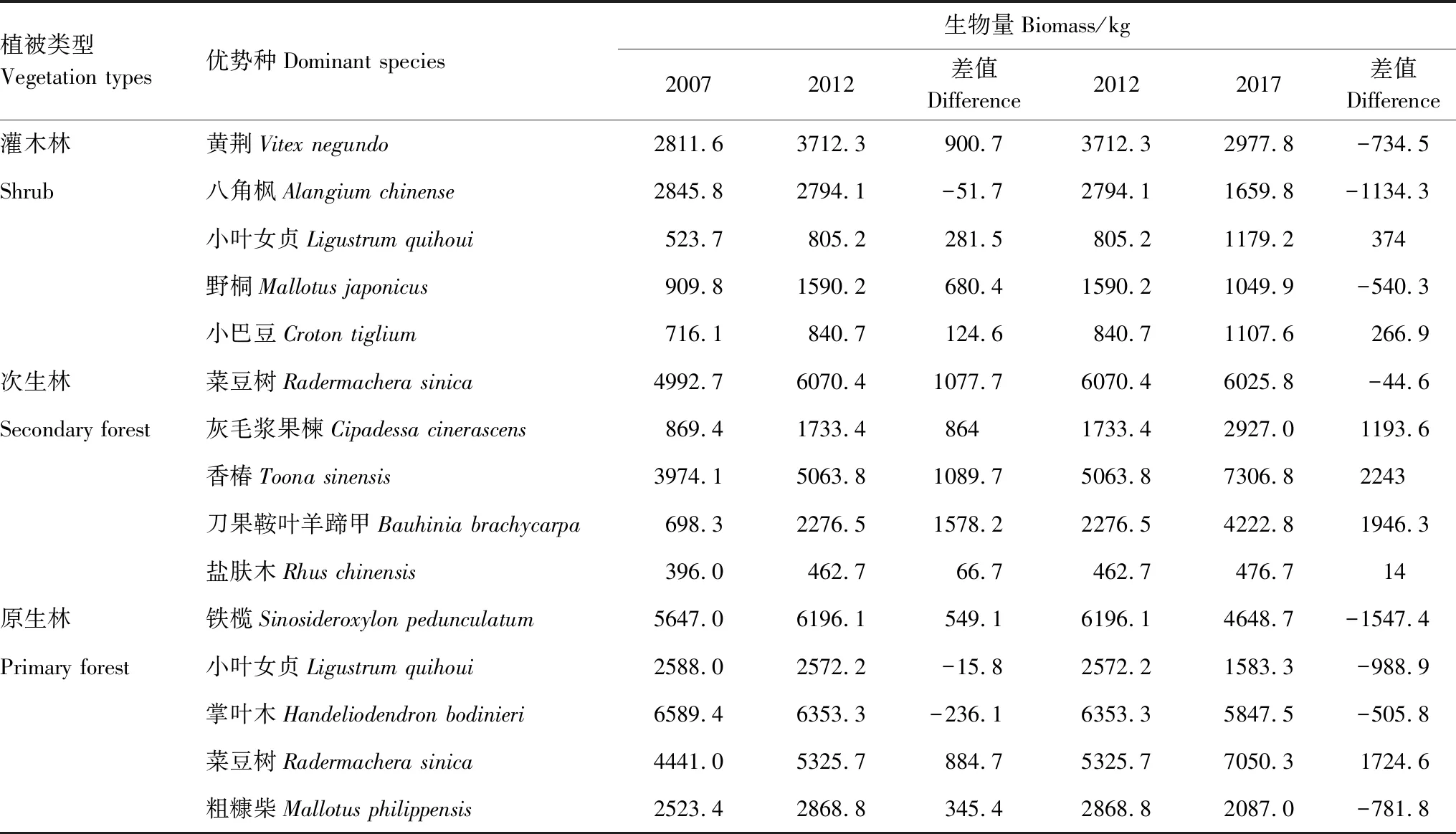
表3 三种植被类型优势种生物量变化
3.6 三种植被类型物种多样性变化
(1) α多样性
由表4可知,随着恢复时间的增加,灌木林的Shannon-wiener、Simpson指数逐渐减少,Pielou指数出现先增加后减少的趋势,各年份差异不显著。次生林Shannon-wiener指数出现先减少后增加的趋势,Simpson指数逐渐减少,Pielou指数出现先增加后减少的趋势,各年份差异不显著。原生林Shannon-wiener指数出现先减少后增加的趋势,Simpson、Pielou指数逐渐增加,各年份差异不显著。
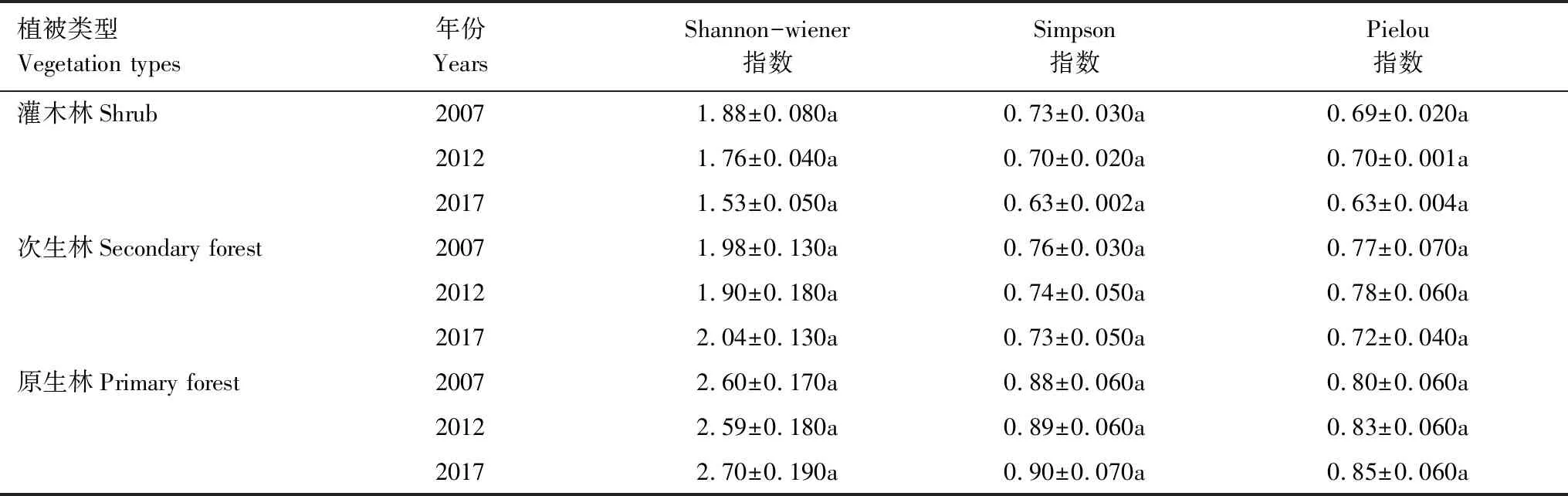
表4 三种植被类型不同年份物种多样性变化
(2) β多样性
由表5可知,灌木林2007—2012年相似性系数为0.96,2012—2017年为0.83。次生林2007—2012年相似性系数为0.98,2012—2017年为0.82。原生林2007—2012年相似性系数为0.96,2012—2017年为0.89。β多样性随着时间推移逐渐减少。
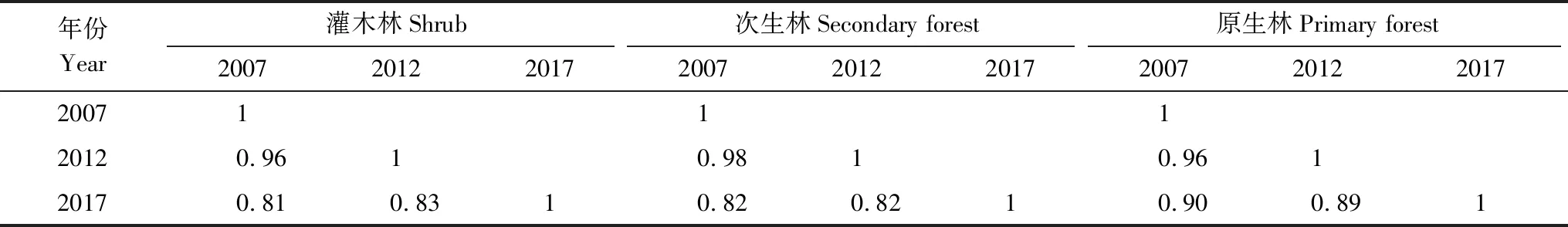
表5 三种植被类型不同年份物种相似性系数
4 结论与讨论
喀斯特生境干旱,种群竞争激烈,群落的优势种主要集中于少数甚至个别的先锋物种,这是以多样性严重减少为代价的,它是生态条件恶劣的反映[26]。前人研究表明人为干扰导致群落结构简单,优势种的重要值高[27]。灌木林和次生林均受到一定的人为干扰,灌木林中黄荆、八角枫;次生林中菜豆树、灰毛浆果楝、香椿等物种重要值大于10,为单优势种种群。原生林群落的优势种不明显,为多优势种种群,其物种组成丰富、结构较稳定[28]。三种植被类型新增和减少的物种均为偶见种或稀有种[29],引起群落中物种数量的波动[30]。
前人研究表明喀斯特环境土层浅薄和地下水的渗漏限制了植物的生长[31]。胸径和树高随着时间的推移而增加,胸径各年份差异显著;平均树高在5年间的差异不显著,10年间达到了显著差异。可能是喀斯特地区环境恶劣,对生长存在明显的胁迫作用导致植物的生长增加趋势不明显。3种植被类型群落总体呈倒“J”形的样地径级结构,表明这些物种具有丰富的幼树储备,从而能够维持其良性的自我更新,总体上群落更新状态良好[32]。3种植被类型均在DBH<5cm中个体减少最多, 表明死亡个体大部分集中在小径级阶段。由于喀斯特生境恶劣,生长比较缓慢,受到生境选择和密度制约导致其死亡率较高。随着恢复时间增加,小径级个体所占比例减少,大径级所占比例逐渐增加,群落稳定向前发展。由竞争驱动导致小径级的个体死亡率高,这是可能控制森林更新的机制之一[33- 34]。
次生林和原生林Shannon-wiener指数总体呈增加趋势,与前人研究结果一致[12]。灌木林的多样性指数随恢复时间增加而降低,可能是灌木林前期人为干扰大,退化严重,恢复多年仍处于草、灌丛阶段,阳性树种占主导地位,多样性较高。随着时间的推移,群落郁闭度增加,竞争激烈,阳性树种逐渐被其他物种所代替,导致多样性减少。阳性树种在恢复前期优势度较大,耐荫树种随着时间推移优势度逐渐增加。不同植物物种在资源利用上的生态位分化不同,种间竞争排除作用降低,这有助于森林群落物种多样性的维持。灌木林、次生林的Simpson指数降低,说明了群落内物种的组成结构发生变化,群落一些物种的优势地位不再突出,逐渐减弱[35]。灌木林新增物种小于死亡物种,多样性指数降低;次生林和原生林的新增物种大于死亡物种的数量,物种多样性增加;表明偶见种或稀有种进入和退出是引起群落物种多样性变化的主要原因,对其提供一定生存空间,是物种多样性的维持机制之一。
β多样性,即不同时间(时间周转率)、地点间(空间周转率)物种组成的变化[36],可以有效度量群落演替过程中的物种组成变化。生态位理论认为环境异质性的增加导致了群落相似性的降低,中性理论则认为扩散限制产生了较高的β多样性[37]。以生态位理论为基础的环境异质性可能是喀斯特群落演替的原因,喀斯特环境条件恶劣,高度的异质性可能导致不同恢复阶段的物种组成变化较大。特别是地形异质性导致的生境过滤导致群落间的β多样性随时间的推移而降低,与前人研究结果一致[38]。
灌木林、次生林、原生林总个体数在2007—2017年分别减少了2556、570、1077株。可能是由于一些自然灾害如2009年的干旱、2015年暴雨洪涝等导致植物大量死亡,有限时间内个体补员数量的不足,样地内木本植物个体数呈减少趋势。原生林生物量减少较多,可能是气候变化背景下, 群落内大径级个体更容易受到胁迫[39],降低群落个体数和生物量[40]。而灌木林生物量变化可能是群落中存在阳性树种如灌木林中的黄荆、八角枫等在荫蔽条件下更新困难,群落内部还存在物种竞争,群落稳定性较差,导致个体数减少,这些物种是群落结构变化的主要贡献者,其个体不断死亡将给群落造成波动,导致群落结构及多样性变化。
研究结果显示树高、胸径随着时间的推移而增加,但是增加的趋势缓慢(图1),可人为引入后期阶段的物种进行及时补播,缩短时间加速植被恢复进程。不同演替阶段的物种有所替代,在植被演替的不同阶段对植被进行恢复采取的措施有所不同。因此次生林和灌木林除了要适当修剪保持合理密度,同时应补充演替后期的繁殖体,特别注意引进一些顶极种或次顶极种,促进物种组成分布渐趋均匀,多样性趋向合理化。10年对于植被恢复研究时间较短,全面揭示灌木林和次生林恢复到原生林的整个恢复过程中物种多样性和植被结构的变化规律有待深入研究。

