利用RNAi 技术调控GhCAD1-A 基因创制低酚棉材料
刚琳霞,任丹凤,程林林,杨细燕,郭小平
(华中农业大学植物与科学技术学院/ 作物遗传改良国家重点实验室,武汉430070)
棉花是主要经济作物之一,其最大的副产品棉籽中含有丰富的蛋白质、脂肪酸等营养物质,但因内含棉酚,利用之前必须进行脱毒处理,棉酚含量低于国家食用安全标准(0.45 μg·mg-1)才能使用。同时,棉酚等倍半萜烯化合物在棉花遭遇病虫害时起一定的防御作用。 因此,种子低酚而植株棉酚含量不受影响的棉花品种选育工作一直受到重视。
植物在生长发育过程中积累大量次生代谢物,广泛参与植物与生物因子及非生物因子的互作过程,使植物能够适应多变的环境。 萜烯作为最大类别的次级代谢产物,在植物对抗昆虫、病原菌等外来侵害时发挥着重要作用。棉酚是棉属植物特有的1 种黄色二聚倍半萜烯化合物, 在根部合成后运输、储存在植株各组织表皮的色素腺体中[1]。 棉株各部位的棉酚含量不同,其中成熟种子及果皮中棉酚含量达2%(质量分数, 下同), 下胚轴中只有0.05%;在发育15~20 d 的种子中棉酚开始合成积累,到30 d 左右棉酚含量急剧增加[2]。 棉酚在棉株中以2 种化学形式存在, 右旋 (+)- 棉酚和左旋(-)- 棉酚,这2 种形式的棉酚在不同的棉种以及相同棉种的不同组织中含量均有较大差异。陆地棉中右旋(+)-棉酚的含量远远高于左旋 (-)- 棉酚。 陆地棉种子中棉酚主要以左旋(-)-棉酚形式存在,花、根中棉酚主要以右旋(+)- 棉酚形式存在[3]。 在植物体内棉酚存在游离态和结合态2 种形态,游离态形式保持棉酚原有的生物活性;而结合态棉酚是通过共价键连接氨基酸残基后形成的,无生物活性。 棉酚化学结构中存在的2 个官能团:活性羟基和活性醛基,决定了棉酚的毒性[4],很多研究证明棉酚对家禽具有毒害作用。棉酚能够破坏人和单胃动物的胃粘膜,导致其消化功能损害,反刍动物对棉酚的毒性虽然不如单胃动物敏感,但是摄入过量棉酚也会导致中毒现象,动物的中毒症状大多为呼吸困难、抽搐、厌食,严重可导致死亡[5]。棉酚含量受外部环境因素的影响,比如与降雨量呈正相关关系,与温度呈负相关关系[6]。
倍半萜烯化合物是在细胞质中合成的,棉酚作为倍半萜烯的1 种衍生物,它在棉花细胞内是从甲羟戊酸途径开始合成的[7]。 首先,3- 羟基-3- 甲基戊二酰辅酶A 在3- 羟基-3- 甲基戊二酰辅酶A还原酶的作用下还原成甲羟戊酸,甲羟戊酸经过一系列反应生成异戊烯基二磷酸及其异构体二甲丙烯基焦磷酸,异戊烯基二磷酸和二甲丙烯基焦磷酸在法尼基焦磷酸合成酶的催化下缩合形成法尼基二磷酸。 法尼基二磷酸在杜松烯合酶(Cadinene synthase 1,CAD1)的作用下环化生成(+)-δ- 杜松烯, 这一步是棉酚合成途径的限速步骤;(+)-δ-杜松烯在杜松烯-7- 羟化酶的作用下羟基化形成7- 羟基-(+)-δ- 杜松烯,之后7- 羟基-(+)-δ-杜松烯经过一系列反应生成半棉酚、 脱氧半棉酚、棉酚等物质[8]。
CAD1 是1 种富含天冬氨酸的倍半萜烯环化酶[9],是棉酚合成途径的限速酶。CAD1 基因分为4个亚类:CAD1-A、CAD1-B、CAD1-C、CAD1-D,四者的氨基酸序列相似性高达95%以上[10],CAD1-B和CAD1-D亚家族中大部分基因为假基因, 所以杜松烯合酶基因的研究大多在CAD1-A和CAD1-C上。CAD1-A和CAD1-C表达模式不同,CAD1-A主要在根部和胚珠中表达,CAD1-C在根、茎、叶、花蕾、胚珠等部位均有表达[10]。 在CAD1-A基因和CAD1-C基因的启动子区域存在1 个能与真菌激发子结合的W-box (TTGACC)调控元件[11],Xu 等从亚洲棉中克隆到1 个GaWRKY1 基因,GaWRKY1 可以与CAD1-A启动子中的W-box 相结合,进而调控CAD1-A基因的表达[12]。
随着生物技术的迅速发展,研究者们用不同的方法对CAD1 进行了不同程度的干涉。 如Martin等利用反义RNA 技术将CAD1-C1 的反义cDNA转到棉花中,获得的转基因后代种子棉酚含量下降了70%[13];Townsend 等通过反义抑制CAD1-C4 基因的表达并没有达到降低种子中棉酚含量的目的[14];Sunilkumar 等通过RNAi(RNA interference,RNA 干扰)技术并结合种子特异性启动子,沉默了当时已知的大部分CAD1-C基因, 获得了可以稳定遗传的种子低酚的棉花株系[8]。 本研究利用RNAi 技术结合种子特异性启动子特异性降低Gh-CAD1-A在种子中的表达量,从而获得种子低酚而叶片等其它组织棉酚含量不受影响的低酚棉材料。
1 材料与方法
1.1 试验材料
本研究使用的棉花材料为高效体胚发生陆地棉材料Jin668;引物合成由北京擎科生物技术有限公司完成;植物基因组DNA 提取试剂盒、总RNA提取试剂盒、快速小提质粒试剂盒购自天根生化科技(北京)有限公司;限制性内切酶购自NEB 公司;TA 连接反应试剂及常规PCR 试剂购自北京全式金生物公司;RNA 反转录试剂购自普洛麦格 (北京)生物技术有限公司;qRT-PCR(Quantitative real-time polymerase chain reaction, 实时定量聚合酶链式反应)试剂购自伯乐生命医学产品(上海)有限公司;提取棉酚所用色谱级试剂购自西格玛奥德里奇(上海)贸易有限公司;棉酚标准样品购自上海宝曼生物科技有限公司。
1.2 菌株和载体
大肠杆菌菌株Top10 和DB3.1、根瘤农杆菌菌株GV3101、双元载体pHellsgate4 均由本实验室提供,pGEM T-easy 载体购自普洛麦格(北京)生物技术有限公司。
1.3 方法
1.3.1PαGlob-GhCAD1-A-RNAi 载体的构建及转化。 载体构建参照文献[15],首先在Cottongen 上查找陆地棉 (+)-δ- 杜松烯合酶基因GhCAD1-A(Ghir_D13G015610)的序列,利用Primer premier 5根据GhCAD1-A的编码序列目标区段, 设计引物GhCAD1-F 和GhCAD1-R (表1), 以Jin668 的cDNA 为模板扩增GhCAD1-A目的片段, 然后通过Gateway 技术将扩增的PCR 产物通过同源重组插入到双元载体pHellsgate4 中, 得到35s-pHellsgate4-GhCAD1-A 载体。在NCBI 上查找α-球蛋白启动子PαGlob(GenBank: HQ689654.1) 的序列,用Primer premier 5 设计α-球蛋白启动子的引物Gh-PαGlob-F 和GhPαGlob-R (表1), 并引入限制性内切酶SacI 和XhoI 酶切位点,以Jin668 胚珠DNA 为模板克隆α-球蛋白启动子PαGlob。 PαGlob片段和35s-pHellsgate4-GhCAD1-A 载体使用SacI 和XhoI 双酶切,电泳分离目的片段,进行切胶回收,并用T4 连接酶连接构建种子特异启动子驱动的干涉载体PαGlob-GhCAD1-A-RNAi, 利用PCR 技术、XhoI 及XbaI 分别单酶切验证,并通过测序验证。最后将构建好的载体转入农杆菌GV3101 菌株中,并转化至棉花Jin668。
1.3.2转基因植株的阳性检测及Southern 杂交。获得T0转基因植株后, 利用CTAB 法提取转基因植株的叶片DNA, 设计引物AGP-F和CAD1-R(表1)并进行PCR 阳性检测。 对PCR 阳性检测结果为阳性的T1转基因植株进行Southern 杂交, 确定其拷贝数。
1.3.3转基因植株目的基因的表达量测定。 取T3转基因植株开花后35 d 的棉桃,提取总RNA,用普洛麦格(北京)生物技术有限公司的反转试剂盒进行RNA 反转录,具体步骤参考试剂盒说明书。
通过qRT-PCR 检测目的基因GhCAD1-A表达量, 并同时检测其上下游基因GhFPS、Gh-CYP706B1 的表达量,以GhUB7 为内参基因,所用引物见表1。 qRT-PCR 反应及分析参照文献[16]。

表1 本研究中使用的引物
1.3.4棉花种子腺体的观察。参照文献[17],将成熟种子去壳后放置水中,室温下种子吸胀后去除种皮,利用体视显微镜对处理后的种子色素腺体进行观察。
1.3.5转基因植株棉酚含量的测定。取T3转基因植株及对照材料花期的倒三叶、幼蕾、开花当天花瓣、开花1 d 后萼片和成熟种子提取棉酚,棉酚提取方法参照文献[17]。
将提取好的样品用Agilent 1260 高效液色谱仪测定。 首先,打开仪器及软件,使其运行稳定;其次,设置测定参数(种子泵流速为0.8 mL·min-1,其它组织泵流速为0.6 mL·min-1, 进样量50 μL,柱温箱温度55 ℃,DAD 检测器波长272 nm,分析时间与棉酚标准样品一致);最后,测定棉酚标准品获得标准曲线后,测定样品中的棉酚含量。 实验设置3 个生物学重复。
1.3.6田间农艺性状测定。株高测定:测量单株子叶节到主茎顶端的距离,精确到0.1 cm。籽指测定:随机挑选3 组100 粒饱满的棉花种子,称重后取平均值,精确到0.1 g。 纤维品质测定:保持仪器测定室房间温度在21 ℃, 湿度在60%左右。 放入样品(一般10 g,不得低于8.5 g)到测定室,在温度21 ℃,湿度60%的情况下平衡36~48 h 后使用纤维品质测定仪HFT9000 对样品进行测定。
转基因植株后代的油分测量:将浓硫酸脱绒后的种子晾晒2~3 d,取饱满的种子用核磁共振分析仪测量。 首先,打开仪器,使其运行稳定,温度保持在30 ℃;其次,定标曲线;最后称量种子重,进行测量。
2 结果与分析
2.1 棉花遗传转化、阳性鉴定及Southern 杂交
选取GhCAD1-A的361 bp 干涉区段进行干涉载体构建, 构建好的PαGlob-GhCAD1-A-RNAi 载体见图1A,将其电击转化到农杆菌GV3101 中,再用农杆菌介导的方法将质粒转入Jin668 中进行遗传转化,得到123 个T0转基因植株。分别提取正常生长并结种的T0转基因植株的DNA 进行PCR 阳性检测, 阳性率为91.9%(图1B)。 选取部分T1转基因植株进行Southern 杂交,以确定其拷贝数,来自于T0单株R4 的3 个单株R4-1、R4-5、R4-7 均为单拷贝, 且条带大小一致,R7-3 为4 拷贝,R9-1 和R12-1 为双拷贝(图1C),后续用R4-1、R4-5、R4-7、R7-3、R9-1 和R12-1 表示其后代株系。

图1 PαGlob-GhCAD1-A-RNAi 载体(A)、T0 转基因植株的PCR 检测(B)和T1 转基因植株Southern 杂交(C)
2.2 转基因植株的基因表达量测定
取6 个T1转基因单株(R4-1、R4-5、R4-7、R7-3、R9-1、R12-1)的种子进行田间种植至T3,取6个T3转基因植株开花后35 d 的胚珠和叶片组织,分别提取RNA,反转录成cDNA 后通过qRT-PCR对转基因植株中的GhCAD1-A基因及其上游基因GhFPS、 下游基因GhCYP706B1 进行表达量的测定。 结果如图2 所示,在转基因植株的胚珠中Gh-CAD1-A及上游GhFPS 基因表达量在干涉株系中表达量均显著降低(图2A―B),下游GhCYP706B1基因表达量有一定程度的降低(图2C)。 不同转化事件中干涉效果有所差异,且在同一转化事件的不同单株间干涉效果也存在一定的差异。 而Gh-CAD1-A、GhFPS、GhCYP706B1 基因在转基因植株的叶片中均没有显著性降低(图2D―F),说明种子特异性启动子在转基因胚珠中发挥了作用。
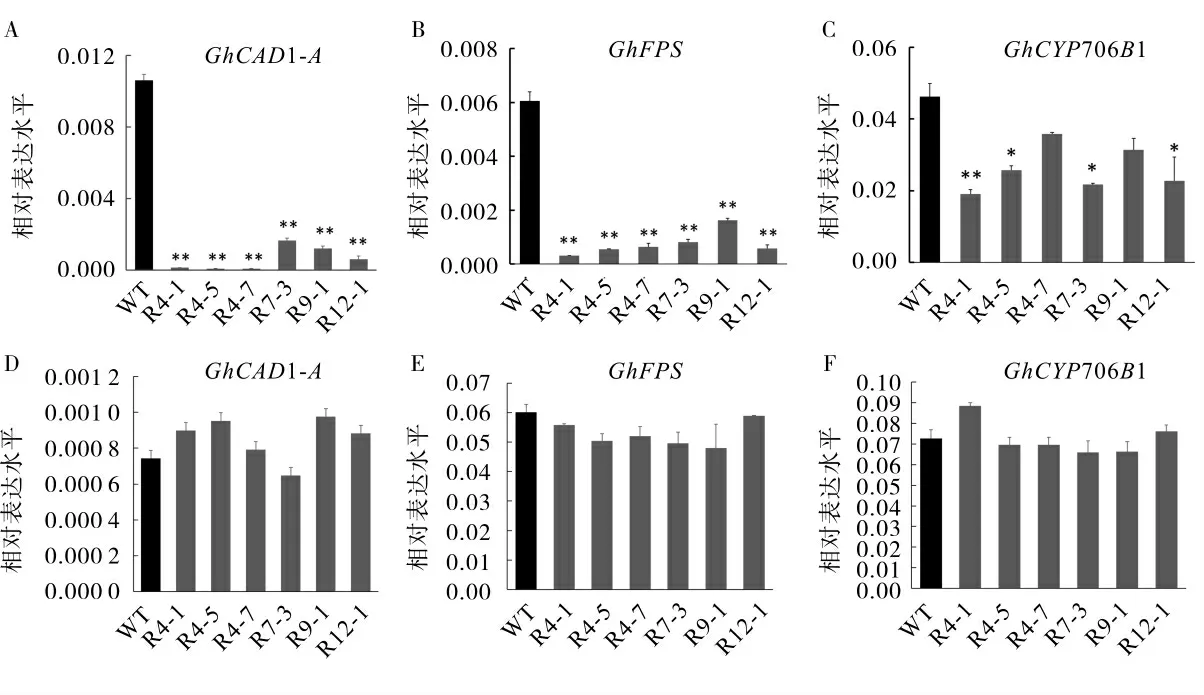
图2 T3 转基因株系中GhCAD1-A 及相关基因的表达量检测
2.3 转基因植株腺体的观察及棉酚含量测定
将筛选出来的6 个转基因材料的成熟种子置于常温水中,待种子吸胀后剥去种皮,在体视显微镜下对种子进行观察,结果如图3A-G(见封三)所示,干涉材料种子色素腺体颜色变浅。 从图中也可以看出在不同的干涉材料中,色素腺体的颜色也有所区别,且与棉酚含量呈正相关,比如R4-7 的棉酚含量比R7-3 高,R4-7 种子表面的色素腺体的颜色要稍高于R7-3。
提取T3转基因植株的6 个不同材料中的种子棉酚进行测定,结果如图3H(见封三)所示,与野生型Jin668 的种子棉酚含量相比, 不同干涉株系的种子棉酚含量均显著降低,其中干涉效果最好的株系R4-5 种子棉酚含量比野生型降低了49.87%,棉酚含量为2.75 μg·mg-1。
分别提取T3不同转基因植株的叶片、 花萼、花蕾、花瓣4 个组织中的棉酚,测定结果如图4 所示,不同转基因植株中叶片、花萼、花蕾、花瓣4 个组织的棉酚含量,与野生型Jin668 相比并没有显著性降低。在同一单株的不同组织中,棉酚含量有比较大的差异,叶片和花萼中的棉酚含量最少,棉酚含量平均仅为0.3 μg·mg-1,而花蕾和花瓣组织中棉酚含量较高,其中花瓣中的棉酚含量可达叶片棉酚含量的百倍。 这种只降低种子中的棉酚含量而不影响其它组织棉酚含量的结果跟预期是一致的。
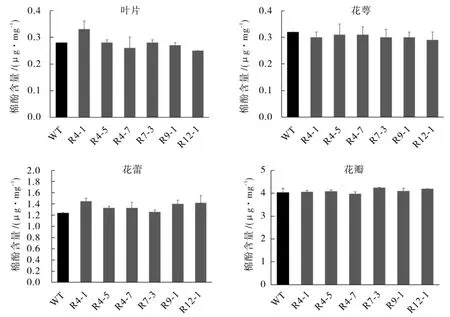
图4 T3 转基因植株不同组织棉酚含量测定
2.4 转基因植株农艺性状考察
对筛选出来的6 个T3转基因植株进行了农艺性状考察,其中包括株高、籽指和纤维品质等性状的测定。 6 个转基因植株与野生型Jin668 相比,所考察的农艺性状没有显著性差异(表2),这表明干涉目的基因表达不影响棉花植株的正常生长。
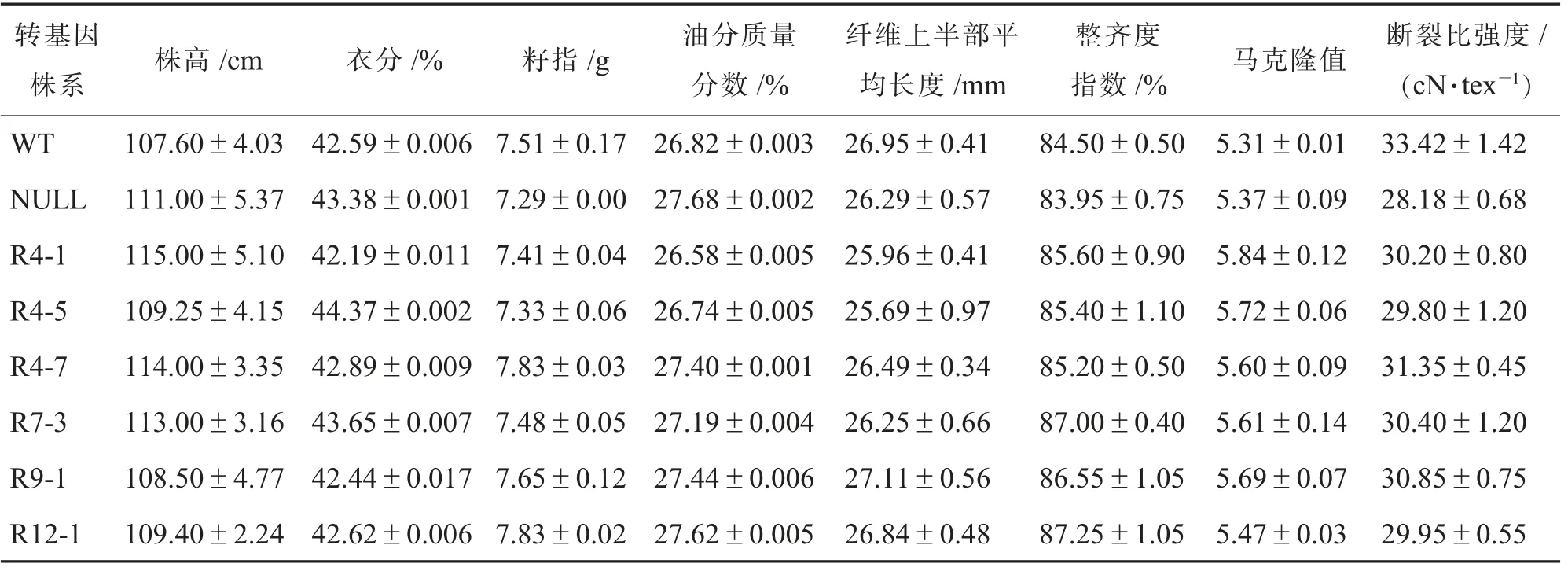
表2 T3 转基因植株农艺性状统计
3 讨论
杜松烯合酶CAD1 是棉酚合成路径中的限速酶,其产物(+)-δ- 杜松烯是棉酚及其衍生物合成的基本骨架[8],选择CAD1 基因进行干涉,理论上在降低棉酚含量上会有很好的效果。
本研究中干涉效果较好的植株种子棉酚含量为2.75 μg·mg-1。 与Sunilkumar 等[8]的研究相比,本研究所创造的干涉材料种子棉酚含量降低幅度较小,可能是干涉片段的选择。 本研究使用的干涉片段长度为361 bp, 而Sunilkumar 等所选的干涉片段长度为601 bp, 且其多出的片段靠近5' 端的区域,沉默效果更好。在本研究中,不同的株系表达量有所差异,且来自于同一株系的不同单株间的表达量也有差异的。这是RNAi 技术自身的局限性所致,RNAi 载体所产生的dsRNA 只能在转录水平上较大程度地沉默靶基因的表达,而不能在基因水平上对其起作用,这就造成了不同转基因株系间表达量的差异[18]。 理论上来说,表达量降低得越多,棉酚含量降低越明显,而在本研究中,有些单株表达量的变化跟棉酚含量的变化不呈正比,这可能是因为棉酚含量易受外界环境如温度、水分、病虫害等影响。
4 结论
本研究选择通过种子特异启动子驱动的干涉载体对GhCAD1-A基因进行干涉, 获得了种子棉酚含量显著降低,而其它组织棉酚含量不变,且对其它主要农艺性状和纤维品质无显著影响的转基因材料,获得的转基因植株种子棉酚含量降幅达到15.27%~49.87%。

