扶正通络解毒汤对急性心肌梗死大鼠心肌组织内游离钙离子浓度、MMP-9、MDA及SOD的影响∗
范才清 陈 姚 张 帆 蒲建璐
(四川大学华西医院,四川 成都 610000)
急性心肌梗死(AMI)是患者冠状动脉出现供血不足或中断供血情况,导致心肌组织持续性处于缺血缺氧状态进而引发心肌坏死性病变[1]。国内外研究表明,除心功能降低外,AMI患者在病理上还表现为心肌组织钙稳态失调、心室重构和氧自由基生成。上述病理表现涉及多项观察指标,如心肌游离钙、基质金属蛋白酶-9(MMP-9)、丙二醛(MDA)、超氧化物歧化酶(SOD)[2-3]。研究上述指标的变化趋势,对于揭示AMI发病机制、评估疗效、为AMI治疗提供新的方向具有积极意义。在中医理论中,AMI属于“卒心痛”范畴,心脉瘀阻、心气内虚是本病的病因病机[4]。中药方剂扶正通络解毒汤由黄芪、丹参、水蛭、黄连、当归等中药材组成,具有通络解毒、益气活血的功效[5],可针对AMI病因病机对症治疗,取得显著疗效,但目前尚缺少中药治疗AMI与西医理论中心肌组织钙稳态失调、心室重构和氧自由基生成调节关系的动物实验和临床研究[6]。本研究通过动物实验的方式探讨了扶正通络解毒汤对AMI大鼠模型血清MMP-9、MDA、SOD活性及心肌组织内游离钙离子浓度的影响及相关作用机制,现报告如下。
1 材料与方法
1.1 实验动物 选取60只健康的无特定病原体(SPF)级SD大鼠,均为雄性,体质量200~300 g,周龄10~12周,实验前体检身体健康、活动正常、心脏功能和心电图谱正常,预计生存期大于6个月,由上海剑钝生物科技有限公司提供,合格证号为SCXK(沪):2019-0013。AMI大鼠模型构建、饲养和后续动物实验均与上海剑钝生物科技有限公司合作完成。造模前笼养大鼠7 d适应环境,饲养温度(22±2)℃,湿度(60±10)%,饮用水为纯净水,饲料符合GB14924.3-2010标准,实验周期4~6周,严格按国家实验动物管理法规进行实验。
1.2 实验药物 扶正通络解毒汤(组成:黄芪、银耳各30 g,丹参、生地黄、栀子、白芍各15 g,麦冬12 g,柴胡、红花、川芎、当归、连翘、檀香、金银花各10 g,水蛭、黄连各6 g,甘草7 g。药材由成都中医药大学医技所大药房提供,将上述药材浸泡后用400 mL水煎煮沸,去渣取药汁,继续煎煮浓缩至原液质量浓度为2 g/mL)。盐酸地尔硫片(合心爽,天津田边制药有限公司,国药准字H12020126),0.9%氯化钠溶液(青岛日水生物,10801-1),克赛依诺肝素钠注射液(NOFI WIN⁃THROP INDUSTRIE,规格0.6 mL∶6 000 A×aIU,2支)。
1.3 试剂与仪器 PBS缓冲液(上海鼓臣生物技术有限公司)、戊巴比妥钠(上海信裕生物科技有限公司)、大鼠血清MMP-9酶联免疫吸附(ELISA)检测试剂盒(上海美轩生物科技有限公司,MEXN-R0581)、SOD ELISA试剂盒(上海创祥生物)、MDA ELISA试剂盒(上海笃玛生物科技有限公司)、组织钙离子浓度比色法定量检测试剂盒(杰美基因,GMS50097.2);大鼠血清CK-MB ELISA检测试剂盒(潍坊祺翔生物科技有限公司,MB-6930)、大鼠cTnI ELISA检测试剂盒(江西江蓝纯生物试剂有限公司,JLC14924)。BLS-X2兽用彩超机(徐州贝尔斯电子科技有限公司),ST-960多功能酶标仪(科华),6/0可吸收缝线(博达),D-16C台式小型冷冻离心机(赛多利斯),BS124S电子分析天平(赛多利斯),LS-20ECG动物心电图记录分析仪(北京拜安吉科技有限公司),HX-101E小型动物呼吸机(成都秦盟科技有限公司),UV754N紫外分光光度仪(青岛路博)。
1.4 分组与造模 见表1。采用随机数字表法将60只SD大鼠分为造模组与假手术组,每组30只。造模组采用改良冠脉结扎手术法制作AMI大鼠模型,术前以2.5 mL/kg腹腔注射3%的戊巴比妥钠溶液麻醉,大鼠肌腱反射消失后实施手术,取仰卧位,注射肝素钠,鼠颈前区除毛、备皮,分离右颈部外静脉和气管,连接呼吸机,潮气量6 mL/kg,吸气∶呼气比为1∶2,呼吸频率80次/min,胸前取备皮,连接心电监护装置(心电图),沿着锁骨中线做纵切口,剥离皮肤,L4~L5肋间钝性分离肌层,开胸,剪开心包,轻压胸廓,暴露心脏,在肺动脉圆锥、左心耳间,距冠状动脉起始2~3 mm处用6/0缝线结扎左冠状动脉前降支,此时大鼠左室前壁变白、心跳减弱,将心脏还纳胸腔,关胸、缝合切口,术后1~5 min内大鼠心电图Ⅱ导联ST段弓背向上抬高≥0.1 mV或病理性Q波作为手术成功的标志。假手术组仅开胸,不给予冠脉结扎,术后2 h抽取鼠尾静脉血测定CK-MB活性、cTnI浓度,造模组大鼠血清CK-MB活性比值及cTnI水平较假手术组升高,差异有统计学意义(P<0.05),证明造模成功。
表1 两组大鼠术后2 h血清CK-MB比值及cTnI水平比较(±s)
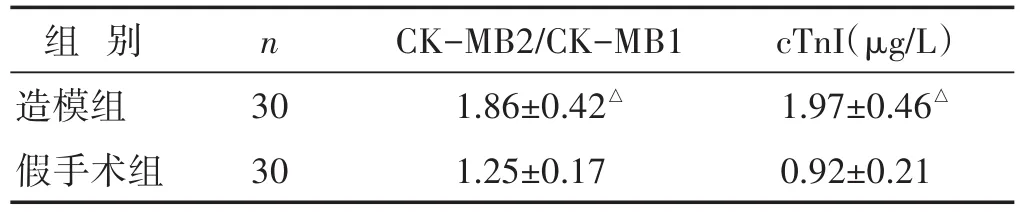
表1 两组大鼠术后2 h血清CK-MB比值及cTnI水平比较(±s)
与假手术组比较,△P<0.05
组别造模组假手术组cTnI(μg/L)1.97±0.46△0.92±0.21 n 30 30 CK-MB2/CK-MB1 1.86±0.42△1.25±0.17
1.5 干预方法 采用随机数表法将造模成功的30只AMI大鼠分为3组,各组10只,参照60 kg标准成人临床用药剂量,利用体表面积-剂量对应关系换算灌胃药液剂量1 mL/100 g。中药组予扶正通络解毒汤:用0.9%氯化钠溶液将扶正通络解毒汤2 g/mL稀释为1.4 g/mL,灌胃剂量为8 g/kg。西药组予盐酸地尔硫片溶液:将30 mg盐酸地尔硫卓片研成粉末后,加0.9%氯化钠溶液稀释为0.75 g/L,灌胃剂量2.6 mg/kg。模型组给予等量的0.9%氯化钠溶液灌胃。各组均在成模24 h后通过灌胃给药,每天给药1次,连续给药7 d,期间检测和比较3组大鼠相关指标水平。
1.6 标本采集与检测 1)血清MDA、MMP-9浓度和SOD活性:在给药前后抽取鼠尾静脉血约1 mL置于不含热原和内毒素的试管中,3 000 r/min离心10 min取上清液在2 h内完成检测,不能在2 h内完成检测的血清样本及试剂盒均应保存在4℃环境中。检测时利用96孔板上样,每组待测血清样本做3个复孔,按照ELI⁃SA检测试剂盒说明书要求操作,主要步骤为:预处理→上样(标准品、待测品稀释液,平行样本)→加带有辣根过氧化物酶(HRP)标记的一抗→封孔,37℃孵育60 min→洗板(PBS缓冲液洗涤5次)→加二抗,封板,37℃避光孵育15 min→加显色液、终止液→利用酶标仪测定各孔OD值。检测方法为双抗夹心法,利用酶标仪测定血清MDA、MMP-9和SOD吸光度,检测波长450 nm,并利用标准曲线换算成浓度值和单位酶活值。2)比色法测定梗死区心肌游离钙离子浓度:给药第7日,在抽血完成后处死各组大鼠,通过手术取出大鼠心脏组织,在显微镜引导下将梗死区心肌剪成小块,称质量后用PBS溶液清洗,利用液氮冷冻并碾成粉末,加入裂解液后孵育30 min制成心肌细胞液,16 000 r/min离心5 min,取上清,按照检测试剂盒说明书要求,利用比色法测定心肌游离钙离子浓度,分光光度仪的检测波长为570 nm。
1.7 统计学处理 应用SPSS23.0统计软件。对研究资料之间进行对比分析,计量资料表示为()形式,组间两两配对比较采用t检验;计数资料(%)组间两两比较采取χ2检验;组内资料两两比较采取单因素方差分析,3组及以上资料比较则采取Z检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠血清MMP-9、MDA和SOD水平比较见表2。给药7 d后,与给药前相比,3组AMI大鼠的血清MMP-9、MDA浓度和SOD活性改善水平差异有统计学意义(P<0.05)。MMP-9、MDA浓度:中药组<西药组<模型组;SOD活性:中药组>西药组>模型组。
表2 各组大鼠干预前后血清MMP-9、MDA浓度及SOD活性比较(±s)
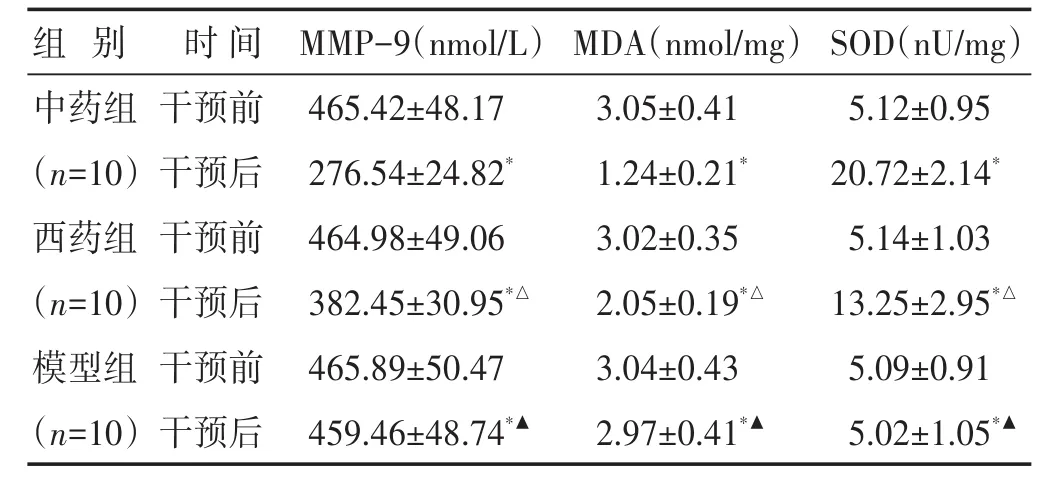
表2 各组大鼠干预前后血清MMP-9、MDA浓度及SOD活性比较(±s)
与本组干预前比较,∗P<0.05;与中药组同时期比较,△P<0.05;与西药组同时期比较,▲P<0.05
组别中药组(n=10)西药组(n=10)模型组(n=10)时间干预前干预后干预前干预后干预前干预后MMP-9(nmol/L)465.42±48.17 276.54±24.82*464.98±49.06 382.45±30.95*△465.89±50.47 459.46±48.74*▲MDA(nmol/mg)3.05±0.41 1.24±0.21*3.02±0.35 2.05±0.19*△3.04±0.43 2.97±0.41*▲SOD(nU/mg)5.12±0.95 20.72±2.14*5.14±1.03 13.25±2.95*△5.09±0.91 5.02±1.05*▲
2.2 各组大鼠梗死区心肌组织内游离钙离子浓度比较 见表3。给药第7日,3组大鼠梗死区心肌组织内游离钙离子浓度比较,差异有统计学意义(P<0.05):中药组<西药组<模型组。
表3 各组大鼠梗死区心肌组织内游离钙离子浓度比较(nmol/L,±s)

表3 各组大鼠梗死区心肌组织内游离钙离子浓度比较(nmol/L,±s)
与中药组比较,∗P<0.05;与西药组比较,#P<0.05;与模型组比较,△P<0.05
组别中药组西药组模型组n 10 10 10梗死区心肌组织内游离钙离子浓度159.62±9.74#△208.18±8.43*△321.82±15.19*#
3 讨论
AMI是一种发病率、致死率和致残率较高的心脑血管疾病。AMI病因的十分复杂,一般认为,冠动脉供血供氧不足是诱发AMI的主因[7],而国内外近年来的研究则指出,AMI的发生和进展还很有可能与下述原因有关。1)心肌细胞游离Ca2+负责调节心肌舒缩功能,其浓度水平也与心肌细胞兴奋程度呈正相关,而AMI发生后患者心肌游离Ca2+出现超载,患者心脏收缩和舒张出现障碍,引发心力衰竭[8-9]。2)心肌组织持续性缺血缺氧会引发心室重构,心肌组织通过分泌MMPs来降解心肌胶原蛋白和基底膜,重塑心脏适应性。而研究也提示,此时患者血清中MMP-9的浓度较正常水平显著升高[10-11]。(3)AMI发生后,患者大脑中氧自由基的产生明显加快,此时SOD会因清除过多氧自由基而消耗,并产生大量生物毒性脂质过氧化物MDA,从而损伤患者脑细胞和神经细胞,引发脑梗死等不良反应[12]。西医针对AMI成因和进展趋势,采用钙离子阻滞剂如硫氮酮等药物治疗,以抑制心肌钙离子内流、扩张冠状动脉血管、松弛心血管平滑肌[13],临床研究结果显示,应用硫氮酮治疗AMI的有效率为60%~70%,对于室上性心动过速的疗效优秀,高达88%~94%,对于心血管血氧供应改善十分显著[14]。不过硫氮酮对于抗氧化指标和心室重构的影响少有文献提及,也具有较多的不良反应和禁忌证,因此应探寻一种更为安全有效的AMI治疗方案,以便获得更理想的疗效和预后[15]。
近年来,临床越来越重视将中医辨证论治或中西医结合治疗心血管疾病。中医理论将AMI归为“胸痹”“卒心痛”范畴,认为AMI的病机分为禀赋不足、瘀血阻心、痰瘀闭心、情志致郁、寒邪凝滞等。AMI患者的共同病证为心络不通,虽原因各异,但均应活血散结、解毒通络。中医认为浊毒是炎症因子、氧自由基,而钙调紊乱、心室结构改变则是“阻络”表现[16]。扶正解毒通络汤方中含有丹参、黄芪、黄连、栀子、麦冬、水蛭等中药材,从组方配伍上分析,丹参归心、肝经,可活血祛瘀,通经止痛;黄芪可补益正气;丹参、黄芪二者为君药,主治胸痹心痛。水蛭可破血通经、黄连可清热解毒,水蛭、黄连为臣药,主治心经实热。麦冬可润肺清心、泻热生津;柴胡可和解表里,疏肝解郁,升阳举陷;白芍可养血调经止痛,麦冬、白芍和柴胡均为佐药,主治热病心烦、胸胁胀痛。连翘、甘草为使,可清热、解毒、散结、消肿、调和诸药,主治心气虚,心悸怔忡。基于动物实验的现代药理学也表明,扶正通络解毒汤中的丹参酮ⅡA可显著缩小心肌梗死范围,复方丹参注射液则具有抗心肌缺血、减少心肌细胞膜的脂质过氧化反应、抑制Ca2+内流的功效;黄芪则富含多糖、皂苷类、黄酮类和氨基酸化学物质,黄芪总皂苷具有抗氧化、清除氧自由基等药理作用,黄芪甲苷则具有舒张血管平滑肌、缓解肌浆网、保护脑细胞等药理作用,可有效预防心室重构、保护心肌组织;其余中药材则具有免疫调节、降血糖、降血压、抗疲劳、抗炎等药理作用[17],这些都是扶正解毒通络汤治疗AMI的理论基础。
至今为止,虽有文献对心肌细胞游离Ca2+、MMP-2、MMP-9和心肌抗氧化指标水平与AMI疗效和预后的关系进行了研究,证实上述实验室指标检测结果与AMI患者的疗效评估、转归预后具有关联性,但仍缺少将中药疗效与心肌细胞游离Ca2+、MMP-2、MMP-9和心肌抗氧化指标联系起来的研究[18]。本研究结果显示,给药后3组AMI模型大鼠的血清MMP-9、MDA浓度、SOD活性及梗死区心肌组织内游离钙离子浓度比较差异有统计学意义(P<0.05)。结果表明扶正通络解毒汤可促进AMI模型大鼠的MMP-9、MDA浓度和SOD单位活性水平的改善,也能降低缺血心肌组织内游离钙离子浓度水平。这一结果值得进一步研究。

