晚期非小细胞肺癌外周血EGFR基因检测与肿瘤抗原标志物临床价值①
王 莉,任秀英,牟洪香,辛 华
(佳木斯大学附属第一医院,黑龙江 佳木斯 154003)
非小细胞肺癌(NSCLC)是具有高度异质性的一种恶性肿瘤疾病。对于非小细胞肺癌的治疗当中,作用于表皮生长因子受体的酪氨酸激酶抑制剂(EGFR-TKI)起到重要的作用[1,2]。而外周血EGFR基因突变是作为口服EGFR-TKI疗效预测的一个最有效的因子,有研究也提示外周血EGFR基因的突变与血CEA间存在有关联性[3,4]。本文主要以探究原发性非小细胞肺癌(NSCLC)患者外周血EGFR基因检测与肿瘤抗原标志物临床价值,为晚期NSCLC患者的EGFR基因检测以及治疗选择提供参考思路。现报道如下。
1 资料与方法
1.1 一般资料
选取本院2017-09~2018-09收治的NSCLC患者中的80例作为本次研究对象。其中包括男46例、女34例,年龄41~80岁,平均(61.45±6.27)岁,其中存在吸烟史患者42例、无吸烟史38例。纳入患者包括其中肺腺癌57例、非腺癌23例。TNM分期中,Ⅲ期32例、Ⅳ期48例。纳入患者均经临床确诊NSCLC,且对于研究内容均知情且自愿参与本研究,患者均签署知情同意书,本实验经医院伦理委员协会的批准。
1.2 研究方法
(1)外周血EGFR基因检测。于晨间空腹状态下采集所有患者的10mL全血,将采集到的血液置于EDTA管当中,通过2000r/min离心机下进行离心处理15min,取上清置2000r/min离心机中再次离心处理10min,分离血浆与血细胞,将样品置于-80℃冰箱当中进行保存备用。血浆当中的循环肿瘤DNA抽提通过DNA专用提取试剂盒(CatNO23211,上海允英公司生产)进行提取,获得产物应用Qubit(LifeTechnology公司)进行浓度检测,根据检测的实际浓度进行调整,使最终浓度在2~52ng/μL,当检测浓度过高则应用纯水稀释,浓度过低则进行重新提取。通过PCR技术对外周血EGFR基因的突变情况进行检测,检测过程以肿瘤DNA(微量)作模板,应用阻遏分子对EGFR野生型的位点进行封闭,使在PCR时突变的特异引物通过基因组作为模板,对突变的靶序列进行PCR高精度扩增,同时利用荧光探针Taqman-MGB对扩增的产物进行准确检测,于实时PCR平台上,对样本DNA当中基因EGFR的突变情况进行检测,在每次进行PCR反应中对所有的样品、阳性对照以及无模板对照进行共同分析。检测依次以95℃10min,1个循环;95℃10s、60℃50s,15个循环;95℃10s、60℃50s,35个循环;在第三阶段的60℃时,对FAM信号与HEX信号进行收集,进行实时PCR并对检测文件进行保存。(2)肿瘤抗原标志物检测。空腹下抽取患者肘静脉血3mL,通过3500r/min离心机离心处理10min后取上清液,应用罗氏2010型全自动电化学发光免疫分析仪进行检测,过程使用配套的试剂。通过电化学发光法对血清神经元特异性烯醇化酶(NSE)、癌胚抗原CEA(CEA)、非小细胞肺癌抗原(CYFRA21-1)、糖基抗原CA-125(CA-125)以及鳞状细胞癌抗原(SCCAg)表达水平进行检测[5]。
1.3 观察指标
对基因突变的结果判断:按依据检测说明书操作,在EGFR检测中,每次试验均提前设定空白对照、野生型对照与各突变阴阳性检测的结果作为检测的参照,确定样品的各反应管中突变的Ct值与外控Ct值。ΔCt=突变Ct-外控Ct。当Ct≥24则EGFR基因突变检测阴性,Ct<20则EGFR基因突变检测阳性,当20≤Ct<24则EGFR基因突变为可疑阳性,此时分析ΔCt值,ΔCt<10则突变为阳性。
1.4 统计学方法
采用SPSS16.0统计学软件进行分析,计数资料形式n(%)表示,对比行χ2检验;计量资料以均值±标准差进行描述,对比行t检验;P<0.05为差异具统计意义。
2 结果
2.1 非小细胞肺癌患者的EGFR基因突变检测
80例NSCLC患者的EGFR基因突变检测结果中,阳性33例、阴性47例,基因突变率41.25%。EGFR基因突变情况多见于肺腺癌与女性患者(P<0.05)。见表1。
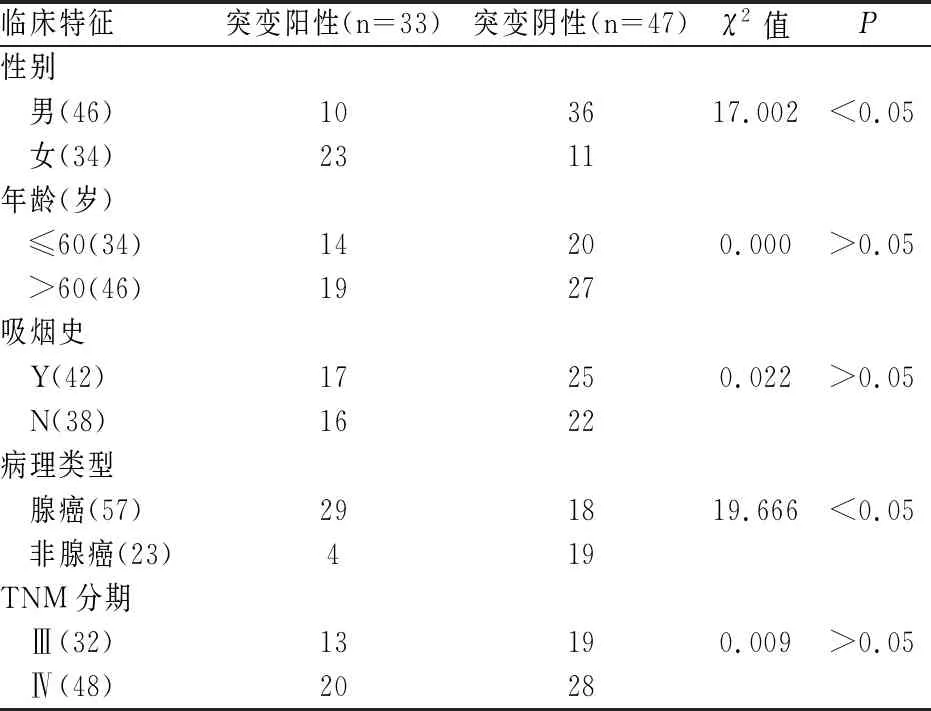
表1 非小细胞肺癌患者的EGFR基因突变检测
2.2 外周血EGFR基因突变与患者血清肿瘤标志物水平关系
EGFR基因突变阳性患者的CEA值显著高于EGFR基因突变阴性(野生型)患者(P<0.05),而SCCAg值则显著低于EGFR基因突变阴性患者(P<0.05);EGFR基因突变阳性患者的CYFRA21-1、CA-125以及NSE表达水平与EGFR基因突变阴性患者的对比均为见显著差异(P>0.05)。见表2。

表2 外周血EGFR基因突变与患者血清肿瘤标志物水平关系
3 讨论
作用于表皮生长因子受体的酪氨酸激酶抑制剂(EGFR-TKI)在对EGFR基因敏感突变的非小细胞肺癌(NSCLC)患者时治疗时,其疗效显著优于传统的化疗治疗[6]。而由于组织活检样本具有一定的局限性,对于不少高龄患者在诊断时已无法进行手术因此无法获取标本,加之气管镜的取材较小,穿刺本身存在较大风险,对于某些肿瘤的解剖位置以及肺部的基础疾病影响而不适于进行穿刺,反复取材使患者难以接受等,病理组织不适用于长期治疗,因此,有必要选择应用更合适的方法对EGFR-TKI疗效进行预测[7,8]。在当前,液体肿瘤学检测的侵害性小、操作可行性较强、且同时具实时动态监测的特点,在临床上越来越受关注。循环肿瘤DNA(ctDNA)是由肿瘤细胞凋亡与坏死而被直接释放到外周血当中的一种DNA片段,其中携带着大量与肿瘤组织存在相关的信息,对其检测能对EGFR-TKI疗效起到一定的预测价值。且由于ctDNA源于肿瘤的原发灶以及转移灶坏死、凋亡的肿瘤细胞碎片,因此对其检测也能够避免肿瘤组织遗传异质性,体现整个非小细胞肺癌肿瘤遗传学的特征。在本研究80例NSCLC患者的EGFR基因突变检测结果中,阳性33例、阴性47例,基因突变率41.25%。EGFR基因突变情况多见于肺腺癌与女性患者(P<0.05)。且EGFR基因突变与年龄、吸烟史、TNM分期在本研究中均未见相关性。而肿瘤抗原标志物作为由肿瘤细胞生物合成并释放的物质,癌胚抗原(CEA)可作为肺癌患者一个独立的预后因素,血清中CEA的表达水平与NSCLC治疗疗效以及肿瘤侵袭转移存在一定的相关性。有研究提示血清CEA浓度与EGFR基因突变检测阳性呈线性关系,EGRF基因突变可使下游信号通路激活,加速癌细胞的分化致,CEA蛋白表达水平升高。本研究发现EGFR基因突变阳性患者的CEA值显著高于EGFR基因突变阴性(野生型)患者(P<0.05),研究提示CEA可能与高EGFR突变存在有关性。研究也提示EGFR基因突变阳性患者的SCCAg值则显著低于EGFR基因突变阴性患者(P<0.05)。SCCAg作为鳞癌的一种特异性标记物,在腺癌当中的表达水平相对较低,而EGFR基因突变更多见于腺癌,因此,结合研究结果可提示EGFR突变患者的血清SCCAg表达水平会出现降低。
综上所述,血清中肿瘤抗原标志物CEA浓度水平的升高、SCCAg表达水平下降与EGFR基因突变存在相关性,对血清CEA与SCCAg的检测可对EGFR基因突变的预测起到一定的效果,临床可结合优势人群选择使用EGFR-TKIs进行治疗,临床行血浆EGFR基因检测具有较高的实用价值。

