miR-21-5p通过靶向TGF-β1改善LPS诱导的脓毒症实验研究
雷 磊,赵 鹏,杨昌伟,刘传明,尹 文,李俊杰
脓毒症是由于各种病原体微生物和毒素物质的侵入引起宿主的不适应反应,产生各种细胞因子和炎性因子,引发全身性炎症反应,可致患者休克、器官功能衰竭甚至危及生命[1-2]。脓毒症一般在机体受到感染、严重创伤、再灌注损伤、缺氧以及外科手术之后被引发,致死率高达25%。因其病因复杂目前尚无特效治疗方法[3]。MicroRNA(miRNA)能直接与下游靶基因结合、降解mRNA进而抑制下游蛋白翻译[4]。近来有大量研究表明一些miRNA参与脓毒症的调控,如敲除miR-9可减弱脂多糖(LPS)诱导的脓毒症对白介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)分泌的诱导作用[5];TargetScan等软件预测miR-21有很多靶基因,转化生长因子-β(transforming growth factor-beta, TGF-β)是其中之一,其在多种癌细胞中高表达,能调控肿瘤细胞的增殖、凋亡以及转移[4,6]。而TGF-β是一种多功能细胞因子,哺乳动物中有3种异构体,其中以TGF-β1活性最强,能促进蛋白酶抑制剂合成,调节细胞分化和组织增生[7],参与脓毒症的调控[8-9]。本研究从基因调控层面来探索miR-21-5p是否对TGF-β1具有靶向作用,是否可以通过靶向TGF-β1来改善LPS诱导的脓毒症,并探讨这三者之间的关联,从而为脓毒症的研究奠定基础。
1 材料与方法
1.1实验动物 36只C57BL/6小鼠(6~8周,南京大学动物实验中心)。
1.2药物与试剂 LPS(Sigma-Aldrich);miR-21-5p antagomir、miR-21-5p mimic、si-TGF-β1载体(RiboBio);Trizol试剂盒、逆转录试剂盒、qRT-PCR试剂盒(TaKaRa);降钙素检测试剂盒(北京热景生物技术有限公司);丙二醛(MDA)和超氧化物歧化酶(SOD)检测试剂盒(南京建成生物工程研究所);ELISA检测试剂盒(武汉默沙克生物科技有限公司);双荧光素酶报告基因试剂盒(Promega);超敏ECL化学发光试剂盒、蛋白提取试剂盒(康为世纪);TGF-β1抗体(CST);羊抗兔二抗(Santa);PVDF膜(Millipore)。
1.3仪器 多功能酶标仪(Labsystem Multiskan);荧光定量仪(Bio-Rad)。
1.4方法
1.4.1建立LPS诱导的脓毒症小鼠模型:对小鼠腹腔注射10 mg/kg的LPS,注射5 d,建模剂量和时间参照文献[5]。
1.4.2分组和处理:静脉注射miR-21-5p antagomir以低表达miR-21-5p,注射si-TGF-β1以低表达TGF-β1。将小鼠分为对照组、脓毒症组、NC antagomir组、siRNA-NC组、miR-21-5p antagomir组、si-TGF-β1组,每组6只。对照组为健康小鼠;脓毒症组为LPS诱导的脓毒症小鼠;NC antagomir组为注射NC antagomir的LPS诱导的脓毒症小鼠;siRNA-NC组为注射siRNA-NC的LPS诱导的脓毒症小鼠;miR-21-5p antagomir组为注射miR-21-5p antagomir的LPS诱导的脓毒症小鼠;si-TGF-β1组为注射si-TGF-β1的LPS诱导的脓毒症小鼠。所有注射均为静脉注射,每3天注射1次,每次10 nmol/L,最终浓度50 nmol/L。
1.5检测指标
1.5.1降钙素和超敏C反应蛋白:取6组小鼠血清,用上转电化学发光技术检测降钙素水平,用ELISA试剂盒检测超敏C反应蛋白水平,方法参照使用说明书。
1.5.2miR-21-5p和TGF-β1水平的检测:用Trizol试剂盒提取组织总RNA,用反转录试剂盒将RNA以及miRNA合成cDNA,按照2×SYBR Green Master Mix的操作说明进行qRT-PCR。
1.5.3Western blot检测TGF-β1表达水平:提取总蛋白并测定其浓度,取30 μg于SDS-PAGE分离蛋白质,转移至PVDF膜上,用脱脂乳密封1 h,加入TGF-β1抗体4℃过夜孵育,洗膜后用二抗孵育1 h,用超敏ECL化学发光试剂盒检测。
1.5.4miR-21-5p与TGF-β1靶向关系的验证:用PCR扩增软件预测的位于TGF-β1 3'UTR区与miR-21-5p的结合位点附近的200 bp序列(TGF-β1-wt,野生型),设计突变体(TGF-β1-mut,在结合位点处设计突变),分别连入双荧光素酶报告载体。将其与NC-mimic和miR-21-5p mimic载体按不同组合分别共转染293T细胞,在多功能酶标仪上按双荧光素报告分析试剂盒说明书操作检测TGF-β1 3'UTR荧光素酶的活性。
1.5.5炎性因子:取6组小鼠血清,用ELISA试剂盒检测IL-6、TNF-α的水平,具体方法参照使用说明书。
1.5.6氧化应激反应活性:用分光光度法检测SOD、MDA的活性,具体方法参照使用说明书。

2 结果
2.1成功构建小鼠模型 脓毒症组降钙素和超敏C反应蛋白表达水平高于对照组(P<0.01)。见图1A和1B。表明用LPS诱导制备的脓毒症小鼠模型是成功的。对不同处理下的小鼠血清中miR-21-5p和TGF-β1的表达水平定量分析发现,与对照组比较,脓毒症组小鼠miR-21-5p表达明显下调,TGF-β1明显上调(P<0.05);miR-21-5p antagomir组血清中miR-21-5p的表达量低于NC antagomir组和对照组,si-TGF-β1组血清中TGF-β1的表达量显著低于siRNA-NC组和对照组(P<0.05,P<0.01);NC antagomir组miR-21-5p mRNA表达水平低于对照组,siRNA-NC组TGF-β1 mRNA表达水平高于对照组(P<0.05)。见图1C和1D。表明这2种小鼠都瞬转成功。

图1 成功构建LPS诱导的脓毒症小鼠降钙素、超敏C反应蛋白和miR-21-5p、TGF-β1 mRNA表达水平
2.2miR-21-5p与TGF-β1之间存在靶向关系 首先用TargetScan软件预测miR-21-5p与TGF-β1的靶向关系,在TGF-β1的3'UTR区425-432 bp区域发现了2个hsa-miR-21-5p潜在的靶向结合位点,见图2A。接着用NC antagomir、miR-21-5p antagomir(低表达miR-21-5p)、NC mimic、miR-21-5p mimic(高表达miR-21-5p)、siRNA-NC、si-TGF-β1(敲除TGF-β1)分别转染293T细胞并检测miR-21-5p和TGF-β1表达水平的变化。转染miR-21-5p antagomir会显著降低miR-21-5p的表达水平(P<0.05),见图2B;而转染miR-21-5p mimic会显著提升miR-21-5p的表达水平(P<0.01),见图2C;转染si-TGF-β1会显著降低TGF-β1的表达水平(P<0.01),见图2D。说明细胞转染是成功的。从图2E来看,相对于对照组和转染si-TGF-β1组,转染miR-21-5p antagomir后TGF-β1的表达水平显著提升(P<0.05),提示抑制miR-21-5p的表达可以提高TGF-β1的表达,即miR-21-5p对TGF-β1有负调控的作用。最后用双荧光素报告分析进一步验证miR-21-5p与TGF-β1的靶向关系,在预测的结合位点处设计突变体(TGF-β1-mut),发现野生型(TGF-β1-wt)能使荧光素酶的活性显著下降(P<0.05),而突变体并无明显变化,见图2F。提示miR-21-5p靶向并负调控TGF-β1的表达。
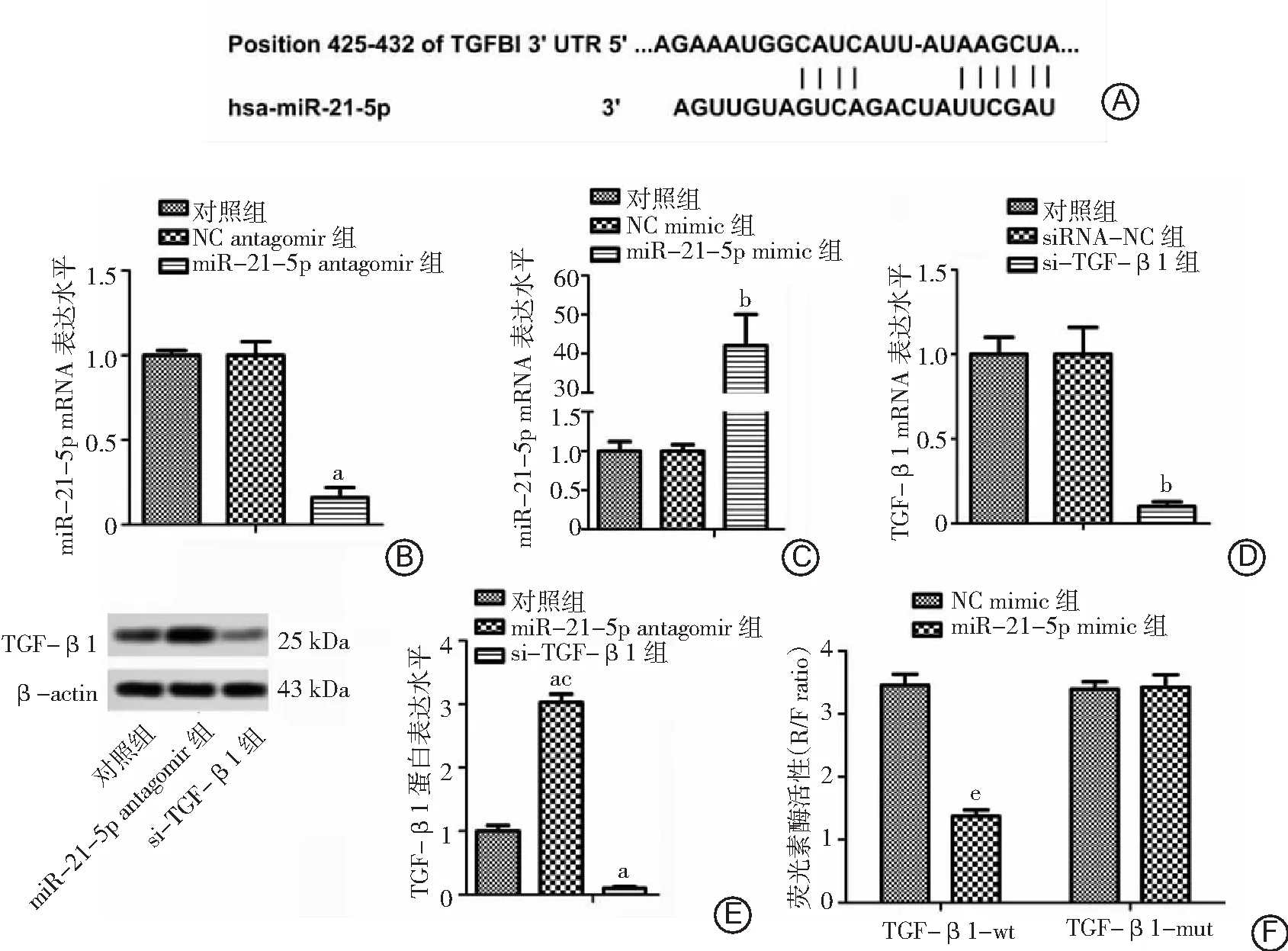
图2 脓毒症小鼠miR-21-5p与TGF-β1之间的靶向关系
2.3miR-21-5p通过调节TGF-β1的表达减轻LPS诱导的脓毒症炎症 脓毒症组小鼠血清中IL-6和TNF-α的水平显著高于对照组(P<0.05),说明脓毒症时炎症非常严重。相对于脓毒症组,miR-21-5p antagomir组小鼠血清中IL-6和TNF-α的水平显著升高,而si-TGF-β1组显著下降(P<0.05)。见图3。提示抑制TGF-β1的表达使得炎症减轻,而抑制miR-21-5p的表达会使TGF-β1的表达升高,从而炎症加重,即miR-21-5p靶向抑制TGF-β1的表达减轻LPS诱导的脓毒症炎症。

图3 miR-21-5p靶向抑制TGF-β1的表达对LPS诱导的小鼠脓毒症炎性因子水平的影响
2.4miR-21-5p通过调节TGF-β1的表达减轻LPS诱导的脓毒症的氧化应激反应 与对照组比较,脓毒症组小鼠血清中SOD活性显著下降,MDA活性显著升高(P<0.05),说明脓毒症时氧化应激反应加剧。与脓毒症组比较,miR-21-5p antagomir组小鼠血清中SOD活性显著下降,MDA活性显著升高,而si-TGF-β1组SOD活性显著升高,MDA活性显著降低(P<0.05)。见图4。提示抑制TGF-β1的表达可减轻LPS诱导的脓毒症小鼠体内氧化应激反应,而抑制miR-21-5p的表达会使TGF-β1的表达升高,从而加剧氧化应激反应,即miR-21-5p通过靶向抑制TGF-β1的表达来减轻LPS诱导的脓毒症氧化应激反应。

图4 miR-21-5p靶向抑制TGF-β1的表达对LPS诱导的小鼠脓毒症的氧化应激反应的影响
2.5miR-21-5p通过调节TGF-β1的表达改善LPS诱导的脓毒症 与对照组比较,脓毒症组降钙素和超敏C反应蛋白水平升高(P<0.05,P<0.01);与脓毒症组比较,miR-21-5p antagomir组小鼠血清中降钙素、超敏C反应蛋白的水平显著提高,si-TGF-β1组显著下降(P<0.05),见图5。提示抑制TGF-β1的表达会降低降钙素、超敏C反应蛋白的表达水平,而抑制miR-21-5p的表达可提高TGF-β1的表达水平,进而使降钙素、超敏C反应蛋白的表达水平升高,加剧脓毒症。

图5 miR-21-5p靶向抑制TGF-β1表达对LPS诱导的脓毒症降钙素和超敏C反应蛋白水平的影响
3 讨论
脓毒症是严重感染患者死亡的主要原因,危害严重,且目前尚无有效治疗方法。因此本研究将从miRNA入手来探索其发病机制,期望为脓毒症的治疗打开一个新的窗口。miRNA广泛存在于人体液中,且具有独特的选择性和稳定性,因此被视为临床诊断的理想生物标志物。每个miRNA都有多个靶基因,一般是通过转录水平或转录后水平调控靶基因表达,且具有高度的保守性,进而调控多种细胞功能和病理过程,而且在其中扮演的角色和功能也各有不同[6]。miR-21-5p在多种疾病中高表达,如乳腺癌[10]、前列腺癌、喉癌等[4]和急性肾损伤[6],miR-21可促进人成骨细胞分化[11]。通过生物信息学方法预测以及实验验证,发现其有很多靶基因,如LCRG1、PDCD4、TGF-β、BMPR2等[4,6,10,12]。TGF-β属于TGF-β超家族,是一种具有多种生物学效应的免疫调节细胞因子,广泛存在于各个组织和器官中,参与调控肿瘤的发生和发展过程[13]。TGF-β1是TGF-β表达的异构体中活性最强的,研究报道最多,其可以调控细胞分化及组织增生,进而参与各类疾病调控[7,14-15]。早有研究表明,TGF-β1参与脓毒症的调控,如姜黄素可以通过抑制TGF-β1/SMAD3通路的表达对脓毒症诱导的急性肺损伤起保护作用[8]。外源细胞色素C可通过下调TGF-β1的表达来改善脓毒症诱导的心肌功能障碍[9]。但目前还未见有相关研究详细报道miR-21-5p与TGF-β1是否真实存在靶向关系,以及这种关系在脓毒症调控中扮演的角色。
降钙素和超敏C反应蛋白是脓毒症诊断和治疗的生物标志物[3,16-17],具有较高的准确性和特异性,表达水平过高,表明脓毒症较严重[18]。本研究结果显示,构建LPS诱导的脓毒症小鼠体内降钙素和超敏C反应蛋白的水平显著高于对照组。提示脓毒症小鼠模型构建是成功的。通过定量检测脓毒症小鼠体内miR-21-5p和TGF-β1的表达,发现miR-21-5p在脓毒症中低表达,而TGF-β1高表达,结果与以往研究一致[9]。通过生物信息学预测,发现在TGF-β1的3'UTR区425-432 bp区域有2个hsa-miR-21-5p潜在的靶向结合位点。在转染miR-21-5p antagomir的293T细胞中TGF-β1的表达量高于对照组,表明抑制miR-21-5p的表达可以促进TGF-β1的表达,呈负相关。本研究双荧光素酶报告分析结果,TGF-β1-wt能使荧光素酶的活性显著下降,这就证实了靶向结合位点的存在,miR-21-5p可以靶向抑制TGF-β1的表达。
本研究结果显示,miR-21-5p antagomir组小鼠血清中IL-6、TNF-α、MDA、降钙素和超敏C反应蛋白的水平都显著高于脓毒症组,SOD水平低于脓毒症组,而si-TGF-β1组却是相反的结果,提示抑制TGF-β1的表达可减轻LPS诱导的脓毒症小鼠体内的炎症反应、氧化应激反应以及脓毒症症状,而抑制miR-21-5p的表达会使TGF-β1的表达升高,进而使各项症状加重。
综上所述,miR-21-5p通过靶向抑制TGF-β1的表达可以减轻LPS诱导的脓毒症引起的炎症、氧化应激反应,进而改善脓毒症。基于本研究结果,或许可以通过药物调控miR-21-5p的表达,进而改善脓毒症,为脓毒症的治疗找到了一个新的突破口。

