POLD3在肝细胞癌及癌旁组织的表达及临床意义
盛 涛,张少华,毛兴波,赵国刚
肝细胞癌(hepatocellular carcinoma, HCC)通常指原发性肝癌,是肝脏上皮细胞恶性增殖形成,其具体发病机制目前尚未完全明确,可能与病毒性肝炎、乙醇及各种化学致癌物质有关[1-2]。HCC早期患者常缺乏特异性表现,起病隐匿但进展迅速[3],且现阶段临床尚无有效根治方案,因此预后情况一直不容乐观,近年来随着医学水平发展和基因组学开展,恶性肿瘤分子生物学机制不断被揭开和证实,为阐明恶性肿瘤发病机制和进行临床治疗提供了新的思路和靶点[4-5]。DNA聚合酶δ3(DNA polymerase delta 3, POLD3)为POLD第3亚基,是生命体染色体复制过程中重要的修复功能基因,对维持基因结构稳定具有重要意义,文献报道,POLD3缺失或表达紊乱可能参与结直肠癌等多种恶性肿瘤的发生和进展过程[6-7]。本研究主要探讨POLD3在肝癌及癌旁组织中的表达水平及其与HCC临床病理特征的关系,为明确HCC发病机制和寻找新的治疗靶点,进一步提升临床治疗水平提供参考依据。
1 资料与方法
1.1一般资料 选取2015年12月—2018年12月我院拟行手术治疗的HCC患者97例为研究对象,男65例,女32例,年龄31~84(67.38±12.49)岁,纳入标准:①符合HCC诊断标准且经病理检查结果证实[8];②年龄≥18岁;③术前未行抗癌辅助治疗;④明确未发生肝外转移;⑤患者及家属知晓本研究并签署同意书。排除标准:①伴活动性肝炎或脂肪肝等其他肝脏疾病;②伴严重系统性疾病;③伴肝胆手术史或腹腔粘连者;④合并全身其他类型恶性肿瘤;⑤伴其他手术相关禁忌证;⑥临床病理资料收集不完整者。
1.2方法 术中收集97例HCC患者癌组织和癌旁组织标本,经10%中性福尔马林固定24 h后进行石蜡包埋、切片和HE染色,复核病理诊断和分期,其中癌组织标本要求肿瘤组织成分≥90%,癌旁组织取自肿瘤远端切缘处,经HE染色确定无肿瘤成分,采用POLD3抗体和试剂盒(美国Sigma-Aldrich公司生产)按EnVision两步法进行免疫组化染色,所有操作均严格遵循说明书要求执行,在400倍光镜下随机选取10个视野对染色细胞数量和染色程度进行评分,其中阳性细胞数量<10%为0分,10%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;染色程度:无染色为0分,浅棕色为1分,棕黄色为2分,棕褐色为3分,棕黑色为4分;根据免疫组化反应评分(IRS)标准[9],POLD3表达水平为阳性细胞数量评分×染色程度评分,本研究以IRS>3分为高表达,≤3分为低表达,同时采集患者临床和病理资料,并分析不同POLD3表达水平HCC患者的临床病理特征。

2 结果
2.1HCC癌组织和癌旁组织病理学表现 癌组织细胞镜下大小和形状各异,可见核分裂象和肿瘤巨细胞,生长方式呈柱状、团状或滤泡状,并可见乳头状结构,肿瘤细胞周围为肝窦样血管网,部分血管可内衬非典型核分裂象肿瘤细胞(图1A);癌旁组织显示肝小叶基本正常,小叶间结缔组织减少,常相互连接成片状,可见中央静脉及周围呈放射状排列的肝索和肝窦,细胞强嗜酸性,形态和大小未见明显异型性(图1B)。

图1 HCC癌组织和癌旁组织病理学表现(HE×400)
2.2HCC癌组织和癌旁组织中POLD3表达水平 POLD3阳性定位于细胞核,颜色自浅棕色至棕黑色不等。见图2。HCC癌组织中POLD3高表达率低于癌旁组织,差异有统计学意义(P<0.05)。见表1。
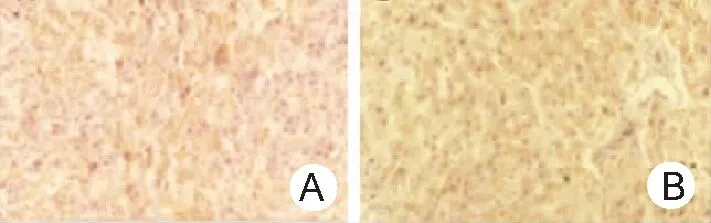
图2 HCC癌组织和癌旁组织POLD3表达情况(EnVision×400)
HCC为肝细胞癌;A.癌组织;B.癌旁组织

表1 HCC癌组织和癌旁组织中POLD3表达水平分析[例(%)]
2.3癌组织POLD3表达水平与患者临床特征的关系 POLD3低表达与HCC患者肿瘤数量、直径、TNM分期、合并门静脉癌栓及分化程度有关(P<0.05)。见表2。
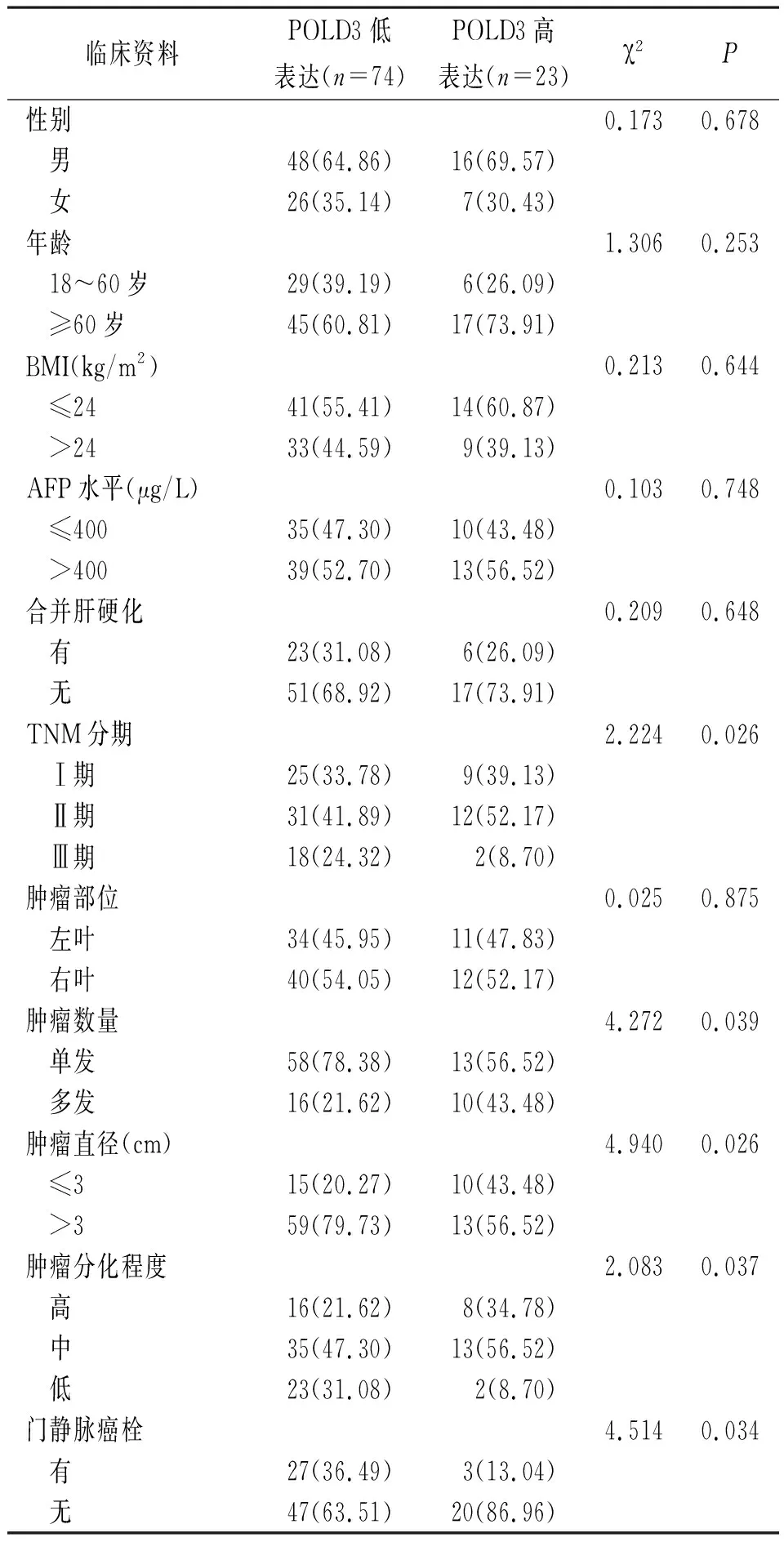
表2 HCC癌组织POLD3表达水平与患者临床特征的关系[例(%)]
2.4癌组织POLD3表达水平对HCC预后影响 HCC术后均随访5年,其中POLD3高表达者失访3例,生存时间57(51.0~63.1)个月,低表达者失访1例,生存时间52(45.4~58.6)个月。2组生存时间比较差异无统计学意义(P>0.05)。见图3。
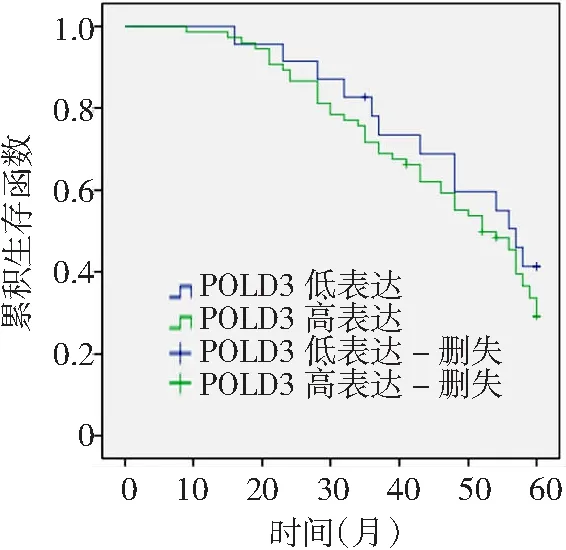
图3 POLD3表达水平对HCC患者预后的影响
3 讨论
HCC是世界范围内最常见的恶性肿瘤之一[10],其发病率和病死率分别位于全球第六和第二,每年新增患者数量约70万,受环境和生活习惯等因素影响,不同地区HCC发病和死亡情况差异较大,我国为HCC高发地区,患者数量在全球占比高达55%,发病率为(145~190)/10万,死亡率为20.37/10万,严重危害社会群众身心健康和生命安全,给医疗卫生工作带来沉重压力,因此结合我国居民生活环境和身体素质,探讨HCC发病的分子生物学机制及其治疗靶点,是现阶段临床需要解决的重要难题[11-13]。
恶性增殖是不同癌细胞典型生物学行为,而细胞增殖关键环节为DNA复制和转录,POLD通过与增殖细胞核抗原(PCNA)相互作用而参与调解DNA扩增、复制和损伤修复过程,因此推测癌细胞增殖过程可能与POLD表达或结构异常有关,POLD全酶由p125、p50、p66和p12四个亚基组成,在核苷酸切除修复(NER)、错配修复(MMR)及碱基切除修复(BER)等常见DNA损伤修复方式中均有涉及和参与,其中POLD3即p66是POLD与PCNA交互作用过程的功能结合域,同时还能增加整个聚合酶稳定性及与PCNA的亲和力,对维持POLD功能具有重要意义,POLD3表达异常可能导致DNA损伤修复功能异常,从而引起癌症等疾病发生和进展[14-17]。Rayner等[18]报道显示,POLD3基因系突变可增加直肠癌发生风险。本研究分析HCC患者POLD3表达水平显示癌组织中仅23.71%为高表达,而癌旁组织88.66%为高表达,可见HCC患者癌组织POLD3表达水平较正常组织明显偏低,因此POLD3低表达可能是HCC发生的分子生物学机制之一。文献报道,POLD在DNA合成中的作用取决于是否存在PCNA,但几乎参与了所有方式的DNA损伤修复,因此POLD在介导DNA损伤修复和保持染色体稳定性方面的作用较复制合成更为重要和关键,因此核心亚基POLD3表达下降的主要影响是DNA损伤修复障碍,而HCC发生则可能与无法修复或未及修复的DNA产生克隆性进而异常增殖有关[19-20]。
Willis等[21]研究报道,卵巢癌单基因生物标志物发现POLD3低表达患者预后较差,认为POLD3可作为卵巢癌潜在治疗靶点。为进一步研究POLD3表达水平降低对HCC的影响,本研究将不同POLD3表达水平的HCC患者临床病理特点进行比较,结果显示POLD3低表达患者肿瘤单发数量和直径增加,分化程度降低,TNM分期更晚且合并门静脉癌栓的比例较大,可见POLD3低表达可能促进肿瘤细胞去分化和增殖,故而POLD3表达下降不仅参与HCC发病,还可导致肿瘤细胞增殖和生长速度加快,分化程度降低且发生远处转移风险增加,故而患者预后可能相对更差,同时提示以POLD3作为靶点进行治疗可能改善HCC癌细胞恶性行为,对控制病情进展和改善预后具有重要意义。本研究中所有HCC患者术后均随访5年,2组中位生存时间比较差异无统计学意义,分析原因可能与样本容量偏小和术后治疗措施干预等因素有关,这也是本研究不足之处,其结果是否具有普适性和推广意义还有待观察,同时POLD3表达水平降低的原因、POLD不同亚基间的相互作用,以及POLD3影响HCC临床病理特点的详细机制等也尚不明确,因此需要后续更多临床和实验室研究进行证实。
综上所述,POLD3在HCC患者癌组织中表达水平降低,可能在HCC发病和进展过程中均发挥重要作用,为HCC诊断、治疗和预后评估提供了新的思路和靶点。

