miR-200a在乙型肝炎病毒相关慢加急性肝衰竭患者血清中的表达及其与预后的关系
吴炳 张涵斌 柯淑慧 池宏波
(1浙江中医药大学,浙江 杭州 310000;2台州市椒江区妇幼保健院检验科;3台州市黄岩区妇幼保健院检验科;4台州市恩泽医疗中心恩泽医院检验科)
慢加急性肝衰竭(ACLF)是一种严重的肝脏损伤,病死率极高。临床主要表现为黄疸和凝血障碍,并合并有肝性脑病、腹水等并发症〔1〕。ACLF的病变基础可能是肝硬化,也可能是无肝硬化的慢性肝病,ACLF 28 d死亡率高达33%,是其他慢性肝病的15倍〔2〕。我国ACLF最常见的病因是乙型肝炎病毒(HBV)感染,被称之为HBV-ACLF〔3〕。常用的评估和预后手段如终末期肝病模型(MELD)和Child-Pugh评分,均不是专门为ACLF设计的。因此制定正确治疗方案和准确评估ACLF患者的预后是治疗ACLF的关键,这样才能有效降低ACLF患者死亡率。由于HBV-ACLF预后很差,所以迫切需要筛选出新的潜在生物标志物来诊断和预测HBV-ACLF患者的预后,为临床治疗方案提供实验基础。微小RNA(miRNA)是一类长18~24个核苷酸的单链编码RNA。它可通过与mRNA的3′UTR结合来调节基因的表达〔4〕。已经证实miRNA参与了肝损伤和肝衰竭的过程,例如大鼠热缺血再灌注后肝损伤后循环miR-122的相对表达水平升高,血清miR-21水平升高和肝脏miR-223相对表达升高;miR-122的相对表达与血清天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)和乳酸脱氢酶(LDH)活性相关,可作为热缺血再灌注后肝损伤的潜在标志物〔5〕。在乙酰氨基酚引起的急性肝衰竭模型中,microRNAs被动释放到循环中;在miR-122、miR-192和miR-124-1显著升高之前,总microRNA显著升高,并与肝、肾和脑损伤的临床证据密切相关〔6〕。尤其是一些特殊的miRNA可作为肝衰竭预后的生物学标志物,例如HBV-ACLF患者血清miR-125b-5p水平随病情进展而升高,存活者血清miR-125b-5p水平低于死亡的HBV-ACLF患者;miR-125b-5p表达与总胆红素和MELD评分呈正相关,与凝血酶原活性(PTA)呈负相关〔7〕。研究发现,在无ACLF和ACLF患者之间有20个miRNAs改变,与存活患者相比,在30 d内死亡的患者中有27个miRNAs改变;通过验证发现ACLF患者和30 d内死亡的患者miR-223-3p和miR-25-3p表达的降低与ACLF的存在和预后不良有关〔8〕。因此,一些miRNAs可能在ACLF包括HBV-ACLF中有作为生物学标志物应用于临床的潜力。通过微阵列分析技术,Zheng等〔9〕筛选出很多miRNAs,在HBV-ACLF患者的血清中9个miRNAs表达显著上调(miR-21,miR-486-5p,miR-130a,miR-192,miR-148a,miR-143,miR-200a,miR-194,miR-122)。该研究证实恢复期ACLF患者血清miR-130a和miR-486-5p表达明显高于未恢复期ACLF患者,血清miR-130a与国际标准化比值、凝血酶原时间(PT)、MELD呈负相关,与PTA呈正相关,提示miR-130a可能是HBV-ACLF患者有用的预后标志物。由于该研究没有对miR-200a在HBV-ACLF中的表达进行进一步验证,未深入探究其临床相关性,本研究探讨miR-200a在HBV-ACLF患者血清中的表达,并进一步探究其临床意义。
1 材料与方法
1.1临床资料 选择台州市椒江区妇幼保健院HBV-ACLF患者42例纳入HBV-ACLF组,平均年龄(65.3±13.1)岁;无症状乙肝病毒携带者(ASC,30例纳入ASC组,平均年龄(62.7±14.2)岁;慢性乙型肝炎(CHB)患者30例纳入CHB组,平均年龄(64.5±12.9)岁。患者入院后收集基本资料,各指标检查由医院检验科完成,ASC、CHB和HBV-ACLF的诊断依据慢性乙型肝炎防治指南(2015版)〔10〕和肝衰竭诊治指南(2012年版)〔11〕。
1.2实验试剂和设备 患者所做各项实验室指标检查的试剂和仪器由美国贝克曼库尔特有限公司提供,TRIzolTMLS Reagent 试剂盒SYBR Green Ⅱ荧光染料(Invitrogen公司,美国)、Revert Aid First Stand cDNA synthesis kit试剂盒、酶标仪(MultiskanTMFC,Thermo Fishers公司,美国)、ABI 7900系统(Applied Biosystems公司,美国)。
1.3各组血清miR-200a表达的检测 患者入院第2天清晨空腹采静脉血,在室温下静置30 min后,1 500 r/min离心20 min分离血清,留存血清于-80℃待检测。采用实时荧光定量PCR(qPCR)法检测各组血清miR-200a表达;并分析血清中miR-200a表达水平与HBV-ACLF预后的关系。
1.4qPCR检测方法 使用TRIzolTMLS Reagent试剂盒提取血清中总RNA。根据沉淀量加入20 μl高温灭菌去离子水溶解RNA,并使用酶标仪测定RNA的纯度(260/280)及浓度。根据测得的RNA浓度,使用Revert Aid First Stand cDNA synthesis kit试剂盒和1 μg RNA进行逆转录反应,反应结束后,加入180 μl去离子水稀释逆转录得到的cDNA,保存于-20℃备用。根据说明书,使用SYBR Green Ⅱ荧光染料(Invitrogen) 及ABI 7900系统(Applied Biosystems)检测miR-200a的表达。以U6 snRNA的相对表达量为内参,采用2-ΔΔCt相对定量法进行统计分析。引物序列为:miR-200a,正义链:5′-TAACACTGTCTGGTAACGATG-T,反义链:5′-CATCTTACCGGACAGTGCTGGA;U6,正义链:5′-CTCGCTTCGGCAGCACA,反义链:5′-AACGCTTCACGAATTTGCGT。
1.5统计学方法 采用SPSS18.0软件进行t及χ2检验、单因素方差分析。
2 结 果
2.1各组临床资料比较 3组年龄、性别及HBV-DNA定量比较差异无统计学意义(P>0.05)。3组血小板计数(PLT)、总胆红素(TBIL)、ALT、AST、MELD评分、PT和血清白蛋白(ALB)比较差异有统计学意义(P<0.05)。见表1。

表1 3组临床资料比较
2.23组血清miR-200a表达的比较 与ASC组(0.61±0.31)和CHB组(0.86±0.45)相比,HBV-ACLF组(2.58±1.22)血清miR-200a表达明显增高,差异均有统计学差异 (均P<0.001)。受试者工作特征(ROC)曲线分析显示miR-200a的表达对于区分HBV-ACLF和ASC或CHB价值明显优于区分ASC和CHB。见表2。
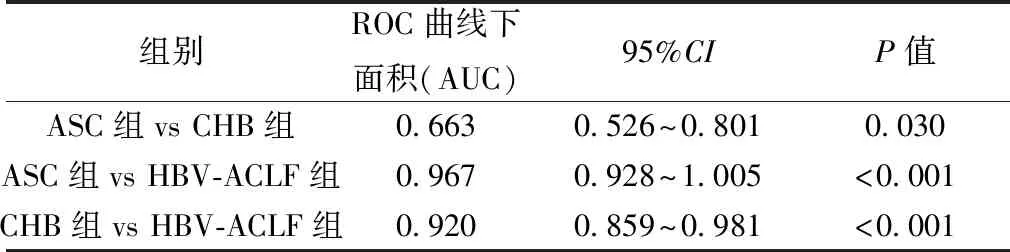
表2 3组血清miR-200a表达区分比较
2.3HBV-ACLF组生存患者与死亡患者血清miR-200a表达比较 13例死亡HBV-ACLF患者血清miR-200a 表达(3.66±1.06,n=13)明显高于29例生存患者(2.10±0.96,n=29,P<0.001)。ROC曲线显示miR-200a的表达对HBV-ACLF预后具有很好的预测价值(AUC=0.862,P<0.001)。
3 讨 论
miRNA可稳定表达于血液、血清等体液中,而且在不同疾病中表达谱不同,因而循环miRNA可作为潜在的生物学标志物用于疾病诊断和预后判断。例如在急性心肌梗死后心力衰竭中,血清循环miR-150水平显著降低,其表达水平与急性心肌梗死后心力衰竭独立相关,血清循环miR-150是一种预测急性心肌梗死后心力衰竭新的生物标志物〔12〕。在胰腺癌中血清miR-1290和miR-1246表达上调,分别与肿瘤的分期和大小有关,且都是胰腺癌的独立危险因素;血清miR-1290和miR-1246可能是胰腺癌诊断有潜在的生物标志物〔13〕。活动性系统性红斑狼疮(SLE)、非活动性SLE和健康对照组 miR-371b-5p和miR-5100的表达存在差异,且miR-371b-5p和miR-5100的表达水平与SLE患者的临床参数之间存在相关性,提示miR-371b-5p和miR-5100可能是SLE的血清标志物。在HBV-ACLF中,凋亡、坏死的肝细胞可将细胞内合成的miRNA释放到血液循环系统中〔14,15〕,因此,血液中异常表达的miRNA也可作为诊断HBV-ACLF和评价预后的潜在生物学标志物。本研究结果表明,miR-200a不仅是肝脂肪变性的一个阶段依赖性生物标志物,而且是人类免疫缺陷病毒(HIV)患者脂肪变性进展和肝细胞损伤的预测因子〔16〕。同时也有研究者发现miR-200a可作为ART治疗的HIV-1感染者致命肝病的生物标志物〔17〕。可见miR-200a在肝细胞损伤中发挥了重要作用,然而在HBV-ACLF并没有miR-200a相关研究。本研究结果可能是由于ASC、CHB和HBV-ACLF患者不同的肝细胞损伤程度,且HBV-ACLF往往伴随非常严重的肝细胞坏死。

