泛酸合成酶菌株筛选及其催化生产D-泛酸的研究
马玉玉 宋 伟 冯小娜 刘 佳 钱园园
(1. 安徽科技学院食品工程学院,安徽 凤阳 233100;2. 江南大学食品科学与技术国家重点实验室,江苏 无锡 214122)
泛酸(Pantothenic acid,PA)又称维生素B5,是一种水溶性维生素,仅D-型(D-PA)具有生物活性,是活细胞中合成辅酶A(CoA)的关键前体物质,也是生命必需的维生素[1-2]。泛酸具有制造抗体的功能,在维护头发、皮肤以及血液健康方面有着重要的作用,目前被广泛应用于制药行业、食品工业、化妆品以及饲料添加剂[3-4]。纯游离泛酸是一种黄色黏稠的油状物,酸性,易溶于水和乙醇,不溶于苯及氯仿,在酸、碱以及光热条件下都不能稳定存在[5]。
目前,生产D-泛酸的方法有:① 物理诱导结晶法,利用混旋泛酸钙的溶解度大于D-型或L-型这一特点进行诱导结晶,此方法工艺成熟,但只能生产泛酸钙,无法用于其他泛酸衍生物的生产。② 化学拆分法,利用氯酶胺等手性拆分剂拆分,但拆分剂价格昂贵,分离困难,还存在毒性和环境污染问题[6]。③ 微生物法,包含代谢工程法、发酵法和生物酶法。Zhang等[7]利用代谢工程法生产D-PA,方法复杂,产量低,最高产量仅28.45 g/L;发酵法的产量较高,但存在发酵产物成分复杂,不利于下游提取等问题[8-9],发酵过程中产生的物质对食品品质也会产生一定的影响[10-12];生物酶法是利用泛酸合成酶(PS)催化D-泛解酸和β-丙氨酸进行缩合反应生成D-PA,反应条件温和,没有副产物的生成,更有利于产品分离。Miyatake等[13-14]研究了大肠杆菌来源的PS酶的酶学性质,发现PS酶的最适pH为10.0,最适温度为30 ℃。Tigu等[15]研究发现谷氨酸棒状杆菌来源的PS酶最适pH为9.0,最适温度为37 ℃。目前,有关利用泛酸合成酶合成D-泛酸的研究较少,Miki等[16]筛选了来自E.coli的PS酶经过60 h的发酵得到117.5 g/L的D-PA,其发酵周期长,时空产率较低。由于反应需腺嘌呤核苷三磷酸(ATP)提供能量(见图1),所以酶法生产D-PA过程中大多需额外添加ATP,而ATP价格昂贵,极大地增加了D-泛酸的生产成本。

图1 生物酶法合成D-PA
试验拟从11种菌株中筛选出泛酸合成酶活性最高的短短芽孢杆菌(Brevibacillusbrevis),并将其在大肠杆菌中表达后进行体外催化D-泛解酸和β-丙氨酸生产D-泛酸试验。对培养基种类、诱导剂种类与浓度、诱导温度、培养基中的残糖量浓度以及补料分批发酵在5 L发酵罐上进行边发酵边转化优化,利用活菌在生长过程中的糖酵解反应产生的ATP,无需外部添加,能大大降低生产成本。旨在为酶法生产D-PA的工业化生产提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
帚石南棒杆菌(Corynebacteriumcallunae)、黄色考克氏菌(Kocuriaflava)、脆弱拟杆菌(Bacteroidesfragilis):中国工业微生物菌种保藏管理中心;
短短芽孢杆菌(Brevibacillusbrevis)、藤黄微球菌(Micrococcusluteus)、铜绿假单胞菌(Pseudomonasaeruginosa)、金黄色葡萄球菌(Staphylococcusaureus)、巨大芽孢杆菌(Bacillusmegaterium)、谷氨酸棒状杆菌(Corynebacteriumglutamicum)、枯草芽孢杆菌(Bacillussubtilis168)、大肠杆菌(Escherichiacoli)、EscherichiacoliJM109、EscherichiacoliBL21 (DE3)、质粒pET-28a(+):实验室保藏。
1.1.2 试剂与仪器
D-泛解酸钠(99%)、D-泛酰内酯(99%)、β-丙氨酸(98%):分析纯,美国Sigma-Aldrich公司;
氢氧化钠、盐酸、氨水、乙腈、甲醇等:分析纯,国药集团化学试剂有限公司;
限制性内切酶BamHI和EcoRI、一步同源重组试剂盒、细菌基因组DNA提取试剂盒:生工生物工程(上海)股份有限公司;
ATP检测试剂盒、His标签蛋白纯化试剂盒:上海碧云天生物技术有限公司;
高效液相色谱仪:Waters 2695型,美国Waters公司;
发酵罐:BIOTECH-5JG型,5 L,上海保兴生物设备有限公司。
1.1.3 培养基的配制
(1) LB液体培养基:酵母粉5 g/L,蛋白胨10 g/L,氯化钠10 g/L。
(2) LB固体培养基:酵母粉5 g/L,蛋白胨10 g/L,氯化钠10 g/L,2%体积分数的琼脂粉。
(3) TB液体培养基:胰蛋白胨12 g/L,酵母粉24 g/L,甘油4 g/L,磷酸二氢钾2.31 g/L,磷酸氢二钾16.42 g/L。
(4) 葡萄糖发酵培养基:葡萄糖20 g/L,硫酸铵9 g/L,碳酸钠2 g/L,磷酸二氢钾6.8 g/L,磷酸氢二铵4 g/L,七水合硫酸镁0.8 g/L,一水合柠檬酸0.8 g/L,酵母粉2 g/L,碳酸氢钠2 g/L,微量金属溶液5 mL/L。
(5) 微量金属溶液:七水合硫酸亚铁10 g/L,二水合氯化钙2 g/L,七水合硫酸锌2.2 g/L,一水合硫酸锰0.5 g/L,五水合硫酸铜1 g/L,二水合氧化钼二钠0.1 g/L,一水合氧化硼二钠0.02 g/L,盐酸5 mol/L。
(6) 补料培养基:葡萄糖650 g/L,磷酸氢二铵8.5 g/L,七水合硫酸镁8 g/L。
1.2 方法
1.2.1 培养条件
(1) 平板培养:将保藏的菌种接种至LB固体培养基上,37 ℃培养箱中培养12 h。
(2) 种子培养:用接种针从平板上挑取菌体,接入LB液体培养基(50 mL/250 mL)中,37 ℃下200 r/min摇床中培养12 h。
(3) 发酵培养基培养:将种子培养基接种至发酵培养基(100 mL/500 mL)中,接种量为10%,37 ℃下200 r/min摇床中培养12 h。
(4) 5 L发酵罐培养:5 L发酵罐中初始装液量为1.3 L,温度30 ℃,接种量10%,自动流加纯氨水与4 mol/L盐酸控制pH值为7.0,搅拌转速550 r/min,通气量2 vvm,底物投入量500 mL,包含60 g/LD-泛酰内酯和40 g/Lβ-丙氨酸。
(5)D-泛解酸钠的制备:为降低生产成本,使用1 mol/LD-泛酰内酯与1 mol/L NaOH在室温条件下完全反应3 h生成1 mol/LD-泛解酸钠[14]。
1.2.2 细菌基因组及质粒提取 将菌种先在含有LB固体培养基的平板中活化,37 ℃培养12 h,挑取培养好的单菌落至50 mL LB液体培养基中,37 ℃培养12 h,取1.5 mL 菌液离心进行基因组提取,具体操作方式参考生工生物工程(上海)股份有限公司细菌基因组DNA提取试剂盒的操作手册。取100 μL含 pET-28a的大肠杆菌菌液至30 mL含有卡那抗性的LB液体培养基中培养12 h,按生工生物工程(上海)股份有限公司质粒小提试剂盒的操作手册进行操作。
1.3 PS酶重组载体的构建
以上述11种菌的基因组作为模板,分别将11种菌株来源的酶命名为PSCc、PSMl、PSKf、PSBb、 PSBf、PSPa、PSSa、PSBm、PSCg、PSBs、PSEc,设计引物序列见表1。PCR扩增获得泛酸合成酶基因,将PCR产物回收。pET-28a(+)载体的质粒使用BamHI和EcoRI进行双酶切。使用一步同源重组的方法将PCR回收产物连接到表达载体pET-28a(+)中,37 ℃放置30 min,将重组质粒转化到E.coliJM109感受态细胞中,用含有卡那抗性的LB平板进行阳性转化子筛选,将筛选出的阳性转化子使用T7通用引物进行菌落PCR验证,将验证成功的菌落挑出送往苏州金唯智生物科技有限公司对目的基因进行测序。

表1 引物设计
1.4 PS酶表达菌株的构建
重组质粒pET-28a(+)-PS测序结果正确后,将其导入E.coliBL21(DE3)感受态细胞中,用含有卡那抗性的LB平板进行筛选,选择转化成功的转化子进行菌落PCR验证,将验证成功的转化子挑入含有卡那抗性的LB液体培养基中培养12 h,将其放入甘油管中-40 ℃保藏。
1.5 酶活测定
混合物包括:100 μL纯化后的泛酸合成酶,50 mmol/L磷酸钠缓冲液(pH 7.0),25 mmol/LD-泛解酸钠盐,25 mmol/Lβ-丙氨酸,4.5 mmol/L ATP,10 mmol/L MgCl2,15 mmol/L KCl,总体积1.1 mL。加入泛酸合成酶开始反应,30 ℃培养30 min,随后添加1 mol/L HCl和1 mol/L NaOH停止反应[15]。
1.6 蛋白纯化
结合液包含10 mmol/L的NH4HPO4、10 mmol/L NaH2PO4、0.5 mol/L NaCl、20 mmol/L咪唑、1%甘油,pH 7.4。洗脱液包含10 mmol/L的NH4HPO4、10 mmol/L NaH2PO4、0.5 mol/L NaCl、0.5 mol/L咪唑,pH 7.4。将表达有待纯化蛋白的菌株与结合液按1∶10 (g/mL)充分悬浮,破碎。4 ℃下8 000 r/min离心30 min,收集上清。0.22 μm过膜备用,以20 mg粗蛋白/mL 填料的比例上柱。具体操作步骤参照上海碧云天生物技术有限公司His标签蛋白纯化试剂盒的操作手册。
1.7 蛋白质浓度标准曲线
以牛血清白蛋白作为标准蛋白溶液,取8支干净的试管,并编号0~7,参照毛伍祥[17]的方法,于595 nm处测定其吸光度值。以吸光度值为纵坐标,标准蛋白液浓度为横坐标作图,得蛋白质浓度标准曲线为y=0.001 5x+0.381 5(R2=0.994 8)。
1.8 HPLC测定条件
流动相为95% 50 mmol/L NH4H2PO4缓冲液(用磷酸调pH至3.0)和5%乙腈,流速0.5 mL/min,进样体积20 μL,柱温25 ℃,色谱柱为E clipse XDB-C18Column(5 μm,4.6 mm×250 mm),检测器为紫外检测器,检测波长210 nm。
1.9 细胞内ATP含量测定
将沉淀细胞离心,弃上清,轻轻弹散细胞,按6孔板每孔加入200 μL裂解液裂解细胞,4 ℃下12 000 r/min离心5 min,取上清用于后续的测定,具体操作参照上海碧云天生物技术有限公司ATP检测试剂盒的操作说明书。
1.10 数据处理
采用Excel对原始数据进行整理及误差分析,采用Origin 9.0软件绘图。
2 结果与讨论
2.1 PS酶的筛选
由表2可知,PSBb的酶活最高,为1 562.3 U/mL,PSMl的活性稍低,为946.5 U/mL,PSPa与PSSa则无活性,将结果与文献[18]的PS酶活进行比较发现,PSBb的酶活更高,高出247.5 U/mL。

表2 PS酶活测定结果
2.2 酶学性质分析
2.2.1 PS酶的分离纯化 由图2可知,PSBb的蛋白大小为32 kD,说明试验所得蛋白是正确的,纯化后的蛋白浓度为11 233.3 mg/mL。

M. Low Marker PSBb. 纯化后的蛋白质
2.2.2 酶学参数 由图3可知,PS酶的活性随温度的升高先增加后降低,当温度高于60 ℃时,酶活性丧失,PS酶的最适反应温度为30 ℃。PS酶在30 ℃下放置12 h后,残余酶活为87.5%,40 ℃放置12 h后残余酶活为57.4%,50 ℃放置12 h后残余酶活为11.5%。当pH为7.0时,PSBb活性最高,在酸性条件或碱性条件下活性极低。PS酶在pH 7.0~7.5时稳定,放置12 h后其残余酶活仍达70%左右。PSBb的Kcat为115.4 s-1,酶与D-泛解酸和β-丙氨酸两个底物的亲和力差异不大,Km分别为1.2,1.1 mmol/L。
由表3可知,PSBb的转换数低于文献[11]的,但Kcat/Km值较大,说明PSBb与底物的亲和力更大。

图3 PS酶学性质研究

表3 不同来源PS酶动力学参数比较
2.3 发酵罐转化条件优化
2.3.1 培养基 由图4可知,使用TB培养基转化46 h后D-PA产量为58.8 g/L,转化率为59.7%,时空产率为30.9 g/(L·d);转化48 h后D-PA产量为56.4 g/L,转化率为57.3%,时空产率为28.2 g/(L·d)。使用葡萄糖发酵培养基转化46 h后D-PA产量为65.1 g/L,转化率为66.1%,时空产率为34.3 g/(L·d);转化48 h后D-PA产量为63.1 g/L,转化率为64.1%,时空产率为31.6 g/(L·d)。转化46 h后D-PA产量最高,故将转化时长确定为46 h。葡萄糖在菌体生长过程中参与细胞糖酵解产生ATP,为反应提供能量,使用葡萄糖培养基得到的D-PA产量比使用TB培养基的产量高6.4%,故选用葡萄糖发酵培养基转化46 h。
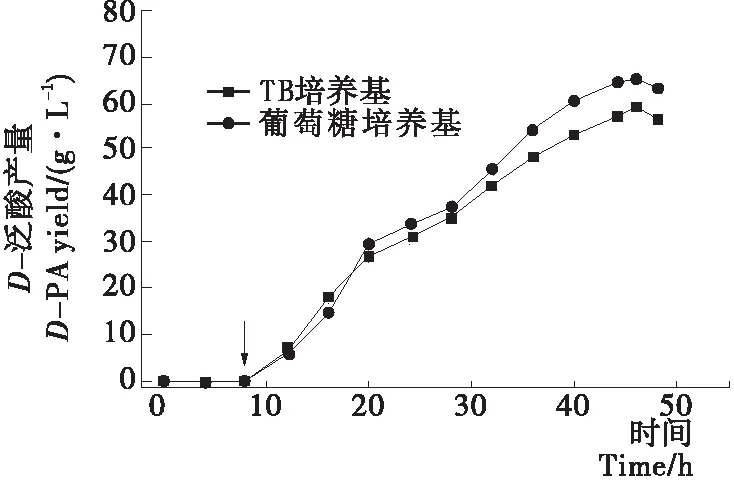
箭头表示底物投入点
2.3.2 诱导剂 由图5可知,使用乳糖作为诱导剂的发酵罐中菌体生长情况更好,OD600 nm可达40,而使用IPTG作为诱导剂的发酵罐菌体OD600 nm仅维持在20左右。使用IPTG作为诱导剂转化46 h后D-PA产量为66.3 g/L,转化率为67.4%,时空产率为34.9 g/(L·d);使用乳糖作为诱导剂转化46 h后D-PA产量为24.1 g/L,转化率为24.5%,IPTG作为诱导剂时,相同条件下产量比乳糖的高42.9%。这是由于乳糖作为诱导剂使用时并非其本身发挥作用,而是由其同素异形体异乳糖发挥作用,一部分乳糖作为碳源供菌体生长,没有完全诱导蛋白的表达,所以IPTG作为诱导剂的效果更好。

图5 诱导剂优化
2.3.3 诱导剂浓度 由图6可知,D-PA产量随IPTG浓度的增大而减少,当IPTG浓度为0.1 g/L时,D-PA产量最高,为68.9 g/L,转化率为70.0%,时空产率为36.3 g/(L·d)。IPTG对菌体有一定的毒性,高浓度会杀死细胞,故选择0.1 g/L为最适IPTG浓度,其产量比未优化时提高了2.6%。
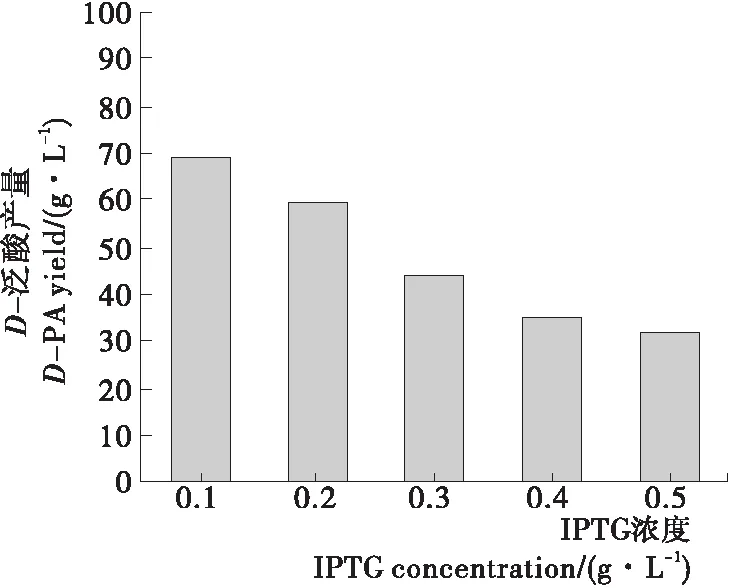
图6 IPTG浓度优化
2.3.4 诱导温度 由图7可知,30 ℃时的D-PA产量均高于其他温度,该条件下的最高D-PA产量为74.6 g/L,转化率为75.8%,时空产率为39.3 g/(L·d)。PS酶的最适温度为30 ℃,此温度下的酶活性最高,D-PA产量也最大,比未优化时的产量提高了5.8%,因此选择30 ℃作为最适诱导温度。

图7 诱导温度优化
2.4 补料分批发酵
2.4.1 培养基中残糖量优化 试验表明,PSBb细胞中ATP含量为1.58×10-5μmol/mg,pET-28a(+)细胞内ATP含量为1.15×10-6μmol/mg,5 L发酵罐转化试验表明,细胞生长过程中产生的ATP能满足反应所需的能量。

图8 残糖量优化
由图8可知,残糖量为0.1~0.5 g/L时D-PA产量为86.4 g/L,转化率为87.8%,时空产率为45.5 g/(L·d);残糖量为0.6~1.0 g/L时D-PA产量为80.5 g/L,转化率为81.8%,时空产率为42.4 g/(L·d);残糖量为1.1~1.5 g/L时D-PA产量为75.3 g/L,转化率为76.5%,时空产率为39.6 g/(L·d);残糖量为1.6~2.0 g/L时D-PA产量为68.7 g/L,转化率为69.8%,时空产率为36.2 g/(L·d)。残糖量控制后转化生产的D-PA产量比未控制时提高了12%,故残糖量控制在0.1~0.5 g/L时的效果最好。
2.4.2 底物分批投入 由图9可知,当分3批次投入底物时,反应结束菌体OD600 nm达28左右,D-PA产量为89.1 g/L,转化率为90.5%,时空产率为46.9 g/(L·d);当分5批次投入底物时,反应结束菌体OD600 nm达35左右,D-PA产量为92.2 g/L,转化率为93.7%,时空产率为48.5 g/(L·d);当分8批次投入底物时,反应结束菌体OD600 nm达67左右,D-PA产量为78.4 g/L,转化率为79.6%,时空产率为41.3 g/(L·d)。说明高浓度的β-丙氨酸会对细胞生长产生毒害作用,当分批次投入后细胞生长好的表达出的蛋白更多,而分8批次投入底物时菌体浓度很高,产生的D-PA产量却降低,是因为细胞生长过快就会很难表达蛋白。在转化过程中底物分5批次投入时的产量比一批次投入时的提高了5.9%,所以底物分5批次投入时效果最好。

图9 底物分批投入
2.5 D-PA的HPLC与LC-MS验证
由图10可知,发酵液的色谱峰出峰时间约为19.15 min,与标准品出峰时间相同,初步认定试验所得产品为D-PA。

图10 D-PA的HPLC图谱
由图11可知,发酵液色谱峰出峰时间约为3.37 min,D-PA分子量为219,在检测过程中为负离子检测,失去一个质子,所以显示的分子量为218,样品与标准品一致,由此可证明试验所得产品为D-PA。

图11 D-PA的LC-MS图谱
3 结论
将11种来源的泛酸合成酶基因进行克隆,在E.coliBL21(DE3)中进行异源表达,经酶活测定筛选出活性最高的短短芽孢杆菌(Brevibacillusbrevis)来源的泛酸合成酶(PS),并对其酶学性质进行研究;在5 L发酵罐上进行边发酵边转化条件优化,利用生长中的重组菌株催化D-泛解酸和β-丙氨酸生产D-泛酸。结果表明,PS酶的最适温度为30 ℃,最适pH为7.0,转换数为115.4 s-1。葡萄糖发酵培养基中使用0.1 g/L的IPTG,30 ℃下进行诱导,发酵液中残糖量为0.1~0.5 g/L时,转化效果较好。将底物分成5批次投入反应时,D-PA产量最高为92.2 g/L,转化率达到93.7%。后续需进一步缩短反应时间,提高产量以达到工业化生产标准,边发酵边转化过程中发酵罐的转速、溶氧、通气量等需进一步优化。

