三疣梭子蟹Apaf-1基因的克隆及其在低盐和病原胁迫后的表达分析*
王 磊 任宪云 宋 柳 吕建建 高保全 刘 萍 孙东方
三疣梭子蟹基因的克隆及其在低盐和病原胁迫后的表达分析*
王 磊1,3任宪云2,3宋 柳1,3吕建建2,3高保全2,3刘 萍2,3①孙东方3
(1. 上海海洋大学水产与生命学院 上海 201306;2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;3. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 青岛 266071)
本研究利用RACE方法克隆获得三疣梭子蟹()凋亡蛋白酶激活因子-1 (Apoptotic protease activating factor-1,基因,该基因cDNA全长为2032 bp,其中,ORF为1050 bp,编码349个氨基酸,预测分子量为39.13 kDa,理论等电点为7.67。同源性和系统发育分析显示,与凡纳滨对虾()的同源性最高,为51.27%,并与凡纳滨对虾聚为一支。组织表达分析显示,基因的相对表达水平在肝胰脏最高,其次是肌肉、心脏、鳃和眼柄,血细胞和表皮最低。不同盐度胁迫后,在Ⅱ期幼蟹体内表达水平在3 h达到最大值,此后,呈先下降再上升趋势;在80日龄盐度20胁迫后三疣梭子蟹的鳃中呈上升趋势,在肝胰腺中为先上升后下降趋势,表明盐度改变能影响该基因在鳃和肝胰腺组织中的表达。不同病原感染实验结果显示,在血细胞中,注射副溶血弧菌()后的表达于48 h到达峰值,为对照组的2.76倍(<0.05),注射白斑综合征病毒(WSSV)后,仅在12 h表达水平上调,为对照组的1.25倍(<0.05);在肝胰腺中,注射副溶血弧菌后在72 h到达峰值,为对照组的5.44倍(<0.05),注射WSSV后在12 h到达峰值,为对照组的5.89倍(<0.05),整体呈上调表达趋势。本研究为进一步理解三疣梭子蟹基因的生理功能提供了参考。
三疣梭子蟹;;低盐度胁迫;副溶血弧菌;WSSV
凋亡蛋白酶激活因子-1 (Apaf-1蛋白)是促进细胞凋亡发生的一个重要基因,Zou等(1997、1999)首次从子宫颈癌细胞(HeLa细胞)胞浆内纯化和克隆出Apaf-1蛋白,已有报道证实,它在线粒体介导的凋亡过程中起核心作用(Campioni, 2005)。Apaf-1是发育性程序化细胞死亡的重要组成部分(Cecconi, 2001),多种凋亡刺激干扰线粒体正常的电子转移链过程,导致细胞色素c从线粒体向胞浆释放,释放的细胞色素c易与Apaf-1结合,引发Apaf-1蛋白构象改变,从而使其与dATP稳定结合,这一过程导致凋亡小体的形成,进一步促使了凋亡的发生。
三疣梭子蟹()主要分布于中国、朝鲜、日本等国家的沿海水域(戴爱云等, 1977),是重要的海产经济蟹类,在我国具有较大的养殖规模。盐度和病原感染均能引起细胞凋亡的发生,盐度是三疣梭子蟹生长发育的主要环境因子之一,在蜕皮、生长、代谢和免疫等生命活动过程中发挥重要作用(Cheng, 2000; Sang, 2004; Romano, 2006; 杨其彬等, 2008; 王冲等, 2010)。当外界水环境发生改变时,鳃是水生生物感受盐度变化最为敏感的器官。鱼类的盐度适应是凋亡机制的触发因素,尤其是在鳃的氯化物(或线粒体)细胞、皮肤和胃肠道的表皮成份中(Anvarifar, 2016)。Bonga等(1989)研究认为,无论是在淡水适应还是海水适应的样品中,罗非鱼()鳃纤维和板层上皮细胞的变性和死亡均主要是通过细胞凋亡发生。Iger等(1994)通过研究鲤鱼()经海水浸泡处理后表皮细胞、邻近细丝细胞和白细胞超微结构发现,随着海水盐分含量的增加,细胞凋亡的细丝细胞数量增加。韩晓琳等(2014)关于低盐对三疣梭子蟹鳃和肝胰腺组织的显微结构的研究表明,低盐胁迫能分别对鳃和肝胰腺组织中的鳃上皮细胞和肝细胞造成损伤,从而间接影响细胞凋亡的发生。因此,无论是在鱼类还是三疣梭子蟹中,细胞凋亡均是存在的,其在盐度适应过程中普遍发生并发挥着不可替代的功能。甲壳动物病原感染是水产养殖中的一个严重问题,已在许多虾类中进行了关于病原感染在细胞凋亡中的研究,但在三疣梭子蟹中还未见报道。通过消除病原感染的细胞,发现细胞凋亡在包括对虾在内的许多生物的抗病原过程中也发挥重要作用(Granja, 2006; Kanokpan, 2003)。细胞凋亡除了在细胞发育和转换过程中发挥重要作用外,在先天免疫中也具有关键作用(Everett, 1999)。免疫反应是由病原感染引起的,从病原的角度来看,入侵者必须避免宿主诱导的细胞凋亡(McLean, 2008; Irusta, 2003; Hilleman, 2004; Helen, 2002; Galluzzi, 2008)。甲壳类动物和其他无脊椎动物一样依赖先天免疫,而不存在基于抗体的适应性免疫(Bayne, 2003)。Caspase介导的细胞凋亡是甲壳动物抗病毒免疫的重要机制(Lei, 2008; Wang, 2013),甲壳动物凋亡进程的发生是通过直接抑制启动子caspase上游的基因来控制的。为了探究在低盐胁迫和病原感染后基因是否参与细胞凋亡,本研究以基因作为研究对象,分析该基因在低盐胁迫和病原感染环境条件下的表达规律,为后续研究三疣梭子蟹凋亡途径的调控机制提供理论依据。
1 材料与方法
1.1 实验材料
本实验分别于2018年5月和8月在山东昌邑海丰水产养殖有限公司内进行,5月实验所用个体为Ⅱ期幼蟹,随机选取健康的Ⅱ期幼蟹置于大小规格相同的整理箱中,用于盐度胁迫实验,每天更换1/3海水,定时投喂大卤虫;8月实验所用个体为80日龄蟹(通过显微镜下观察三疣梭子蟹游泳足趾节末端结构,选取处在蜕皮间期的梭子蟹),体重为(32.0±0.8) g,于室内水泥池中暂养7 d用于后续的盐度胁迫和病原感染实验,暂养期间,水温为(24±2)℃,盐度为33,连续充氧,每天更换约1/3体积海水,定时投喂新鲜杂鱼。
1.2 三疣梭子蟹Apaf-1基因cDNA全长的克隆
根据本实验室构建的三疣梭子蟹转录组数据库,筛选得到基因的序列,用引物设计软件Primer Premier 5.0设计3′和5′特异性RACE引物(表1)、长短链UPM、NUP通用引物进行RACE克隆,本实验使用的引物均由生工生物工程(上海)股份有限公司合成。利用TaKaRa LA®试剂盒进行3′和5′末端全长序列片段扩增。3′末端扩增以AP-F1和通用引物UPM混合进行第1次PCR;然后以第1次反应产物为模板,以AP-F2和通用引物NUP混合进行第2次PCR。5′末端扩增以AP-R1和通用引物UPM配对进行第1次扩增;然后以第1次反应产物为模板,以AP-R2和通用引物NUP配对进行第2次扩增。PCR程序:94℃ 5 min;94℃ 30 s,57.0℃ 30 s,70℃ 1 min,共35个循环;70℃ 10 min。将获得的PCR产物切胶回收、载体连接、转化进入感受态细胞中,挑取并利用通用引物进行菌落PCR,对阳性单克隆菌落进行鉴定,筛选目的菌液测序。
1.3 Apaf-1基因的生物信息学分析
利用Contig Express软件对测序得到的3′序列、5′序列与验证的基因EST序列进行拼接,得到基因的cDNA全长;使用国家生物技术信息中心(NCBI, http://www.ncbi.nlm.nih.gov)提供的ORF查找器识别得到开放阅读框架(ORF),并对编码的氨基酸进行翻译;用BLAST软件(http://www.ncbi.nlm.nih.gov/blast/)检测核苷酸序列相似性,ExPASy (http://web.expasy. org/computepi/)在线软件进行分子量及等电点的预测;通过Pfam (http://pfam.xfam.org/search)数据库进行蛋白质功能结构域分析;以氨基酸序列为基础,采用近邻连接法,利用分子进化遗传学分析MEGA 6.0,建立基于氨基酸序列的系统发育树来比较分析各物种之间的亲缘关系。
1.4 低盐胁迫实验
1.4.1 Ⅱ期幼蟹盐度胁迫实验 取1200只健康活泼的Ⅱ期幼蟹,平均分成4组,包括1个对照组,为盐度35的自然海水,3个低盐度胁迫实验组,盐度分别为30、25、20,低盐水体调配方法详见隋延明等(2012)。盐度胁迫实验在完全一致的整理箱中进行,实验设置3个平行。盐度胁迫后,分别在0、3、6、12、24、48和72 h时进行取样。由于Ⅱ期幼蟹个体比较小,每个时间点取10只进行混合,置于冻存管中,样品置于液氮中保存。
1.4.2 80日龄三疣梭子蟹盐度胁迫实验 随机选取30只暂养后健康的三疣梭子蟹进行72 h半致死盐度(72h-LC50)预实验(韩晓琳等, 2014; 隋延鸣, 2012),确定72h-LC50为11。根据隋延明等(2012)的方法进行盐度胁迫预实验,得出本实验80日龄梭子蟹72 h半致死的盐度为11。正式实验前,连续充气暂养7 d,每天定时换水投喂饵料。正式实验时,设置盐度33的对照组、低盐20实验组和低盐11实验组。低盐水体的调配方法见隋延明等(2012),实验期间的饲养管理与暂养期保持一致,每个实验组90只蟹子,设置3个平行。各盐度实验组取样时间与Ⅱ期幼蟹相同。各时间点随机取3只梭子蟹,并取3个平行样品的鳃组织和肝胰腺组织样本,标记编号后置于液氮保存。
1.5 病原感染实验
取暂养后健康活泼的80日龄三疣梭子蟹300只,均分为3组,每组100只,均于游泳足第一关节基膜处(谢建军等, 2011; Ren, 2017)进行注射,空白对照组注射100 μl无菌的海洋甲壳动物生理盐水,副溶血弧菌()实验组和WSSV实验组注射浓度参照张杰等(2018)的72 h半致死浓度,预实验得到副溶血弧菌和白斑综合征病毒(WSSV)分别为2.5×107CFU/ml、3.4×107拷贝/ml,并在此基础上进行感染实验,其中,WSSV粗提液和副溶血弧菌悬液参照窦全伟等(2019)的方法提取制备,实验设3个平行,实验过程中,饲养管理与暂养期一致。在注射病原后的0、3、6、12、24、48和72 h取梭子蟹的血细胞和肝胰腺组织样本,每个时间点随机取3只梭子蟹进行混合处理,每只都于游泳足第1关节基膜处或心脏处抽取1 ml血液,并与1 ml抗凝剂均匀混合,转移置l.5 ml无RNA酶离心管中,4℃ 4000 r/min离心15 min,然后将上清液即血清去掉,保留血细胞,用于后续实验,该实验设3个平行,样品标记编号后置于液氮中保存。
1.6 三疣梭子蟹Apaf-1基因的表达分析
采用TRIzol (Roche公司)方法提取总RNA,选取高质量的RNA进行实时荧光PCR定量分析检测,参照PrimeScriptRTreagent Kit说明书反转录合成20 μl cDNA,用于后续实验。定量的引物设计基于所获得的基因的cDNA全长序列(表1),内参基因选用β-actin(表1),样品的荧光定量分析通过使用Applied BiosystemsTM7500 Real Time PCR instrument定量仪,采用2-ΔΔCt的计算方法进行。实时PCR反应体系为10 μl,其中,SYBR Premix ExTMⅡ 5 μl、cDNA 1 μl、10 pmol/μl正反引物各0.4 μl、ROX Reference dye Ⅱ 0.2 μl和去离子水3 μl。反应程序: 95℃ 10 min; 95℃ 30 s, 95℃ 5 s, 60℃ 34 s, 40个循环; 95℃ 15 s; 60℃ 1 min; 95℃ 15 s。反应完成后,采用Excel (Somboonna, 2010)进行统计,并用2-ΔΔCt来比较值法计算数据,利用SPSS 19.0软件进行差异显著性分析,<0.05表示差异显著。
表1 本实验所用引物序列

Tab.1 Sequences of the primers used in this study
2 结果与分析
2.1 Apaf-1基因的cDNA全长及序列同源性分析
实验获得的三疣梭子蟹基因(GenBank登录号MH178242)的结构特征见图1。由图1可以看出,该基因的cDNA序列全长为2032 bp,其中,ORF为1050 bp,共编码349个氨基酸,预测理论等电点为7.67,分子量为39.13 kDa,且不稳定系数为45.84,推测为不稳定蛋白质。SMART预测该基因存在Ⅱ类醛缩酶和内收蛋白N端结构域(图1)。利用Blast在线软件来比较三疣梭子蟹和其他物种的Apaf-1氨基酸序列(图2),结果显示,三疣梭子蟹基因与凡纳滨对虾的同源性最高为51.27%。使用MEGA 6.0软件对三疣梭子蟹基因系统进化分析(图3),结果显示,与凡纳滨对虾聚为一支,在进化上关系较近,而与脊椎动物等亲缘关系较远。
2.2 Apaf-1基因组织表达分析
基因组织分布情况如图4所示,各组织中均有该基因表达,其中,在肝胰腺中表达量最高,然后是肌肉、心脏、鳃和眼柄和血细胞,表皮中表达量最低。

图1 三疣梭子蟹Apaf-1基因cDNA全长及其编码的氨基酸序列
ATG:起始密码子;*:终止密码子;下划线区域为基因Ⅱ类醛缩酶和内收蛋白N-末端结构域
ATG: Start codon; *: Stop codon; Bold underlines indicate Class II Aldolase and Adducin N-terminal domain

图2 三疣梭子蟹Apaf-1氨基酸序列比对

图3 基于Apaf-1氨基酸序列的不同物种进化树分析

图4 三疣梭子蟹Apaf-1基因在各组织中的表达
He:肝胰腺;M:肌肉;H:心脏;G:鳃;E:眼柄;Hem:血细胞;C:表皮柱上不同字母代表差异显著(<0.05),下同
He: Hepatopancreas; M: Muscle; H: Heart; G: Gill; E: Eyestalk; Hem: Hemocyte; C: Cutex Different letters indicate significant difference (<0.05). The same as below
2.3 三疣梭子蟹低盐胁迫下Apaf-1基因的表达分析
2.3.1 三疣梭子蟹Ⅱ期幼蟹盐度胁迫下的表达分 析 三疣梭子蟹Ⅱ期幼蟹在低盐胁迫后基因表达情况如图5所示。不同盐度胁迫后,基因的表达发生明显变化,在盐度30、25、20胁迫后,该基因的表达水平均于3 h达到峰值,分别为对照组的6.7倍、23.9倍和5.6倍,均为上调表达(<0.05)。
2.3.2 三疣梭子蟹80日龄个体低盐胁迫后的表达分析 三疣梭子蟹在盐度胁迫后的鳃和肝胰腺组织中的基因表达情况如图6所示。在鳃组织中,盐度20胁迫后,基因表达量整体呈先上升后下降再上升的趋势,与对照组相比,除3 h、48 h两个时间点之外,其余时间点该基因均为上调表达(<0.05),72 h基因表达量最高,为对照组的

图5 低盐胁迫下Ⅱ期幼蟹的表达水平
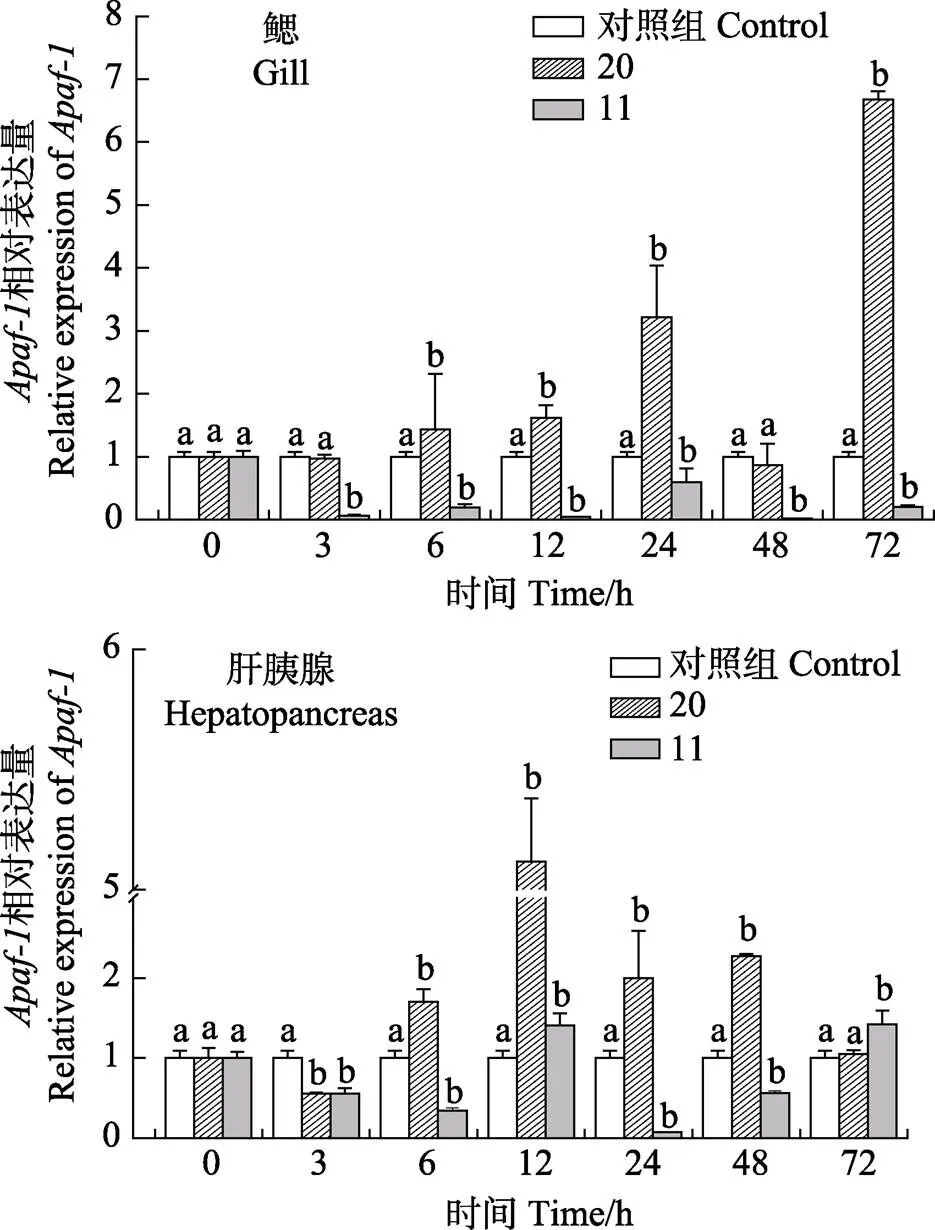
图6 三疣梭子蟹Apaf-1基因在低盐胁迫下鳃和肝胰腺中的表达
6.67倍。在盐度11胁迫后,基因表达量呈先下降后上升再下降的趋势,与对照组相比,从3 h起,该基因的表达量均出现显著下调(<0.05),且在3 h该基因表达量下调至最低值,为对照组的0.04倍,在24 h表达量有所回升,为正常对照组的0.59倍(<0.05)。在肝胰腺组织中,在盐度20胁迫下,在3 h该基因表达量最少,是对照组的0.55倍(<0.05),此后,表达量上升至72 h,整体均为上调表达,其中,12 h到达最大值,为对照组的5.11倍(<0.05)。在盐度11胁迫下,基因表达量在24 h降至最低值,为对照组的0.07倍(<0.05),除12 h、72 h外,整体均呈下调表达(<0.05)。
2.3.3 三疣梭子蟹80日龄个体病原感染后的表达分析基因病原感染在三疣梭子蟹血细胞和肝胰腺组织中表达情况如图7所示。注射副溶血弧菌后,在血细胞中,基因表达呈先下降后上升再下降的趋势,在48 h到达峰值,为生理盐水对照组的2.76倍(<0.05),WSSV注射后,基因仅在12 h血细胞中出现上调,表达水平为生理盐水对照组的1.25倍(<0.05),其余时间为下调表达。在肝胰腺中,注射副溶血弧菌后,基因表达呈先上升后下降再上升的趋势,在72 h到达峰值,为生理盐水对照组的5.44倍(<0.05),在感染WSSV后,基因表达量呈先上升后下降的趋势,在12 h到达峰值,为对照组的5.89倍(<0.05),在72 h恢复到对照组的正常水平,整体表达水平均呈显著上调。

图7 三疣梭子蟹血细胞和肝胰腺感染副溶血弧菌和 WSSV病毒后Apaf-1基因的表达
3 讨论
本研究首次克隆获得三疣梭子蟹凋亡蛋白酶激活因子-1基因全长,将其命名为,cDNA全长为2032 bp,其中,开放阅读框1050 bp,编码1个由349个氨基酸所组成的多肽。基因编码的蛋白质经Blast在线比对显示,与其他无脊椎动物以及脊椎动物的同源性都较高(73%~98%)。系统进化树得出,三疣梭子蟹与凡纳滨对虾聚为一支,与其他无脊椎动物聚为一类。同源性分析表明,基因编码的氨基酸与其他物种的基因编码的氨基酸一样高度保守,具有特定的内收蛋白N端结构域。综上所述,可以确定该序列为三疣梭子蟹基因序列。
根据组织表达分布,得出该基因在肝胰腺中表达量最高,推测肝胰腺是其基因发生作用的主要场所。盐度胁迫后,Ⅱ期幼蟹中基因的表达量在3 h时到达峰值,可能由于盐度骤变Ⅱ期幼蟹对盐度的响应性较强,王冲等(2010)研究表明,盐度骤变20或以上时,显著影响三疣梭子蟹Ⅱ期幼蟹的存活率,当幼蟹适应盐度变化后,基因的表达量就会随着时间的推移而慢慢上升。80日龄在盐度20胁迫后,该基因在鳃中的表达量增加,Kammerer等(2009)研究认为,盐度胁迫下罗非鱼鳃组织的鳃上皮的凋亡细胞随时间的延长而增加。在盐度11时,该基因的表达量低于对照组水平,推测可能由于盐度胁迫导致机体生命活动紊乱,鳃的组织结构发生变化,从而导致该基因表达量降低。肝胰腺中基因的表达量在盐度20和11时均呈先上升后下降的趋势,不同之处在于前者整体呈上调表达,后者为下调表达。根据韩晓琳等(2014)低盐胁迫后三疣梭子蟹的肝胰腺的显微镜结构,低盐胁迫后肝胰腺组织中的肝细胞形态发生的变化,反映了凋亡活化因子的对应表达。表明低盐胁迫通过影响基因的表达,从而促进细胞凋亡的进程。
甲壳动物的免疫系统中血细胞和肝胰腺具有清除受损细胞的作用(Yao, 2006)。凋亡基因在病原体入侵过程中的可能作用是参与机体清除受损细胞过程,在病原胁迫实验中,甲壳类血细胞主要参与对外来物质的识别和清除,其免疫应答多发生在感染后的前12 h (Söderhäll, 1998),感染副溶血弧菌后,基因在12 h表达量增加;感染WSSV后,该基因在24 h到达峰值,此过程中,该基因的表达量上升,清除对机体免疫产生的受损细胞,保持机体正常的生理活动。基因在注射副溶血弧菌后的肝胰腺中的表达量呈先升高后降低再升高的趋势,病原胁迫后,机体细胞会产生免疫反应,来主动防御外来物质的入侵,此时的表达量会上升,帮助机体清除受损细胞,来保护机体正常生理机能(Chang, 2008)。基因在三疣梭子蟹感染WSSV后的肝胰腺中出现显著上调表达(<0.05),在血细胞和肝胰腺中的表达不同,推测可能是由于在血细胞和肝胰腺中,二者的调控机制不同,受病原感染之后的凋亡机制也不一样。病原感染实验表明,基因参与了细胞凋亡的发生。
4 结论
本研究探讨了三疣梭子蟹低盐胁迫和病原感染后凋亡通路基因的表达模式及可能的调控机制,克隆了基因cDNA全长,分析了基因在主要组织中的表达情况,明确了在低盐胁迫过程中,该基因在肝胰腺和鳃组织中的表达变化模式,初步了解基因在免疫防御的响应机理,为深入研究三疣梭子蟹凋亡通路在盐度适应和病原感染中的作用机制提供了参考。
Anvarifar H, Amirkolaie AK, Miandare HK,. Apoptosis in fish: Environmental factors and programmed cell death. Cell and Tissue Research, 2016, 368(3): 425–439
Bayne CJ. Origins and evolutionary relationships between the innate and adaptive arms of immune systems. Integrative and Comparative Biology, 2003, 43(2): 293–299
Bonga SEW, Meij CJMVD. Degeneration and death, by apoptosis and necrosis, of the pavement and chloride cells in the gills of the teleost. Cell and Tissue Research, 1989, 255(1): 235–243
Campioni M, Santini D, Tonini G,Role of Apaf-1, a key regulator of apoptosis, in melanoma progression and chemoresistance. Experimental Dermatology, 2005, 14(11): 811–818
Cecconi F, Gruss P. Human genome and diseases: Apaf1 in developmental apoptosis and cancer: How many ways to die? Cellular and Molecular Life Sciences, 2001, 58(11): 1688–1697
Chang CC, Yeh MS, Lin HK,The effect ofinfection on caspase-3 expression and activity in white shrimp. Fish and Shellfish Immunology, 2008, 25(5): 672–678
Cheng W, Chen JC. Effects of pH, temperature and salinity on immune parameters of the freshwater prawn. Fish and Shellfish Immunology, 2000, 10(4): 387–391
Dou QW, Li JT, Liu P,. cDNA and immunological properties of two variants of hemocyanin subunit with higher molecular weight in. Acta Hydrobiologica Sinica, 2019, 43(1): 37–44 [窦全伟, 李吉涛, 刘萍, 等. 脊尾白虾2种血蓝蛋白大亚基变体的克隆及功能分析. 水生生物学报, 2019, 43(1): 37–44]
Dai AY, Feng ZQ, Song YZ,. Preliminary investigation on fishery biology of. Journal of Zoology, 1977(2): 36–39 [戴爱云, 冯钟琪, 宋玉枝, 等. 三疣梭子蟹渔业生物学的初步调查. 动物学杂志, 1977(2): 36–39]
Everett H, McFadden G. Apoptosis: An innate immune response to virus infection. Trends in Microbiology, 1999, 7(7): 160–165
Galluzzi L, Brenner C, Morselli E,Viral control of mitochondrial apoptosis. PLoS Pathogens, 2008, 4(5): e1000018
Granja CB, Vidal OM, Gustavo P,Hyperthermia reduces viral load of white spot syndrome virus in. Diseases of Aquatic Organisms, 2006, 68(2): 175–180
Han XL, Gao BQ, Wang HF,. Effects of low salt stress on gill and hepatopancreas and family survival rate of. Progress in Fishery Sciences, 2014, 35(1): 104–110 [韩晓琳, 高保全, 王好锋, 等. 低盐胁迫对三疣梭子蟹鳃和肝胰腺显微结构及家系存活的影响. 渔业科学进展, 2014, 35(1): 104–110]
Helen E, Michele B, Xuejun S,The myxoma poxvirus protein, M11L, prevents apoptosis by direct interaction with the mitochondrial permeability transition pore. Journal of Experimental Medicine, 2002, 196(9): 1127–1140
Hilleman MR. Strategies and mechanisms for host and pathogen survival in acute and persistent viral infections. Proceeding of National Academy of Sciences of USA, 2004, 101(2): 14560–14566
Iger Y, Abraham M, Bonga SEW. Response of club cells in the skin of the carpto exogenous stressors. Cell and Tissue Research, 1994, 277 (3): 485–491
Irusta PM, Chen YB, Hardwick JM. Viral modulators of cell death provide new links to old pathways. Current Opinion in Cell Biology, 2003, 15(6): 700–705
Kammerer BD, Kultz D. Prolonged apoptosis in mitochondria- rich cells of tilapia () exposed to elevated salinity. Journal of Comparative Physiology B Biochemical, Systems, and Environmental Physiology, 2009, 179(4): 535–542
Kanokpan W, Kornnika K, Supatra SG,Time-course and levels of apoptosis in various tissues of black tiger shrimpinfected with white-spot syndrome virus. Diseases of Aquatic Organisms, 2003, 55(1): 3–10
Lei W, Zhi B, Wu W,Requirement for shrimp caspase in apoptosis against virus infection. Developmental and Comparative Immunology, 2008, 32(6): 706–715
McLean JE, Ruck A, Shirazian A,Viral manipulation of cell death. Current Pharmaceutical Design, 2008, 14(3): 198–220
Ren X, Lü J, Gao B,Immune response and antioxidant status ofinoculated with pathogens. Fish and Shellfish Immunology, 2017, 63: 322–333
Romano N, Zeng C. The effects of salinity on the survival, growth and haemolymph osmolality of early juvenile blue swimmer crabs,. Aquaculture, 2006, 260(1): 151–162
Sang HM, Fotedar R. Growth, survival, haemolymph osmolality and organosomatic indices of the western king prawn (Kishinouye, 1896) reared at different salinities. Aquaculture, 2004, 234(1): 601–614
Söderhäll K, Cerenius L. Role of the prophenoloxidase- activating system in invertebrate immunity. Current Opinion in Immunology, 1998, 10(1): 23–28
Somboonna N, Mangkalanan S, Udompetcharaporn A,Mud crab susceptibility to disease from white spot syndrome virus is species-dependent. BMC Research Notes, 2010, 3(1): 315
Sui YM, Gao BQ, Liu P,. Preliminary studies on the salinity tolerance of "Huangxuan No.1"Progress in Fishery Science, 2012, 33(2): 63–68 [隋延鸣, 高保全, 刘萍, 等. 三疣梭子蟹“黄选1号”盐度耐受性分析. 渔业科学进展, 2012, 33(2): 63–68]
Sui YM. The effects of salinity on growth, immune-related and metabolism-related enzymes activity of"Huangxuan No.1". Master´s Thesis of Shanghai Ocean University, 2012 [隋延鸣. 盐度对三疣梭子蟹“黄选1号”生长及免疫、代谢相关酶的影响. 上海海洋大学硕士研究生学位论文, 2012]
Wang C, Jiang LX, Wang RJ,. Effect of abrupt and gradual changes in salinity on development and feeding in juvenile swimming crab (). Fisheries Science, 2010, 29 (9): 510–514 [王冲, 姜令绪, 王仁杰, 等. 盐度骤变和渐变对三疣梭子蟹幼蟹发育和摄食的影响. 水产科学, 2010, 29(9): 510–514]
Wang PH, Wan DH, Chen YG,Characterization of four novel caspases from(Lvcaspase2-5) and their role in WSSV infection through dsRNA-mediated gene silencing. PLoS One, 2013, 8(12): 804–818
Xie JJ, Xu WJ, Shi H,. Evaluation of hemato- immunological parameters in the swimming crabinfected. Journal of Fisheries of China, 2011, 35(9): 1392–1398 [谢建军, 许文军, 施慧, 等. 溶藻弧菌诱导对三疣梭子蟹血淋巴非特异性免疫水平的影响. 水产学报, 2011, 35(9): 1392–1398]
Yang QB, Ye L, Wen WG,. Effect of salinity on molting, survival, growth and feed conversion rate of juvenile. South China Fisheries Science, 2008, 4(1): 16–21 [杨其彬, 叶乐, 温为庚, 等. 盐度对斑节对虾蜕壳、存活、生长和饲料转化率的影响. 南方水产科学, 2008, 4(1): 16–21]
Yao CL, Wang ZY, Xiang JH. Crustacean haemocytes and their function in immune responses. Zoological Research, 2006, 27(5): 549–557
Zhang J, Lü JJ, Liu P,Cloning of Toll4 inand its expression in responding to pathogenic infection and low salinity stress. Progress in Fishery Sciences, 2018, 39(2): 146–155 [张杰, 吕建建, 刘萍, 等. 三疣梭子蟹Toll4基因克隆及其在病原和低盐胁迫中的表达特征分析. 渔业科学进展, 2018, 39(2): 146–155]
Zou H, Henzel WJ, Liu X,Apaf-1, a human protein homologous toCED-4, participates in cytochrome c-dependent activation of caspase-3. 1997, 90(3): 405–413
Zou H, Li Y, Liu X,An APAF-1·cytochrome c multimeric complex is a functional apoptosome that activates procaspase-9.Journal of Biological Chemistry, 1999, 274(17): 11549–11556
Cloning and Expression Analysis of theGene inafter Exposure to Low Salt and Pathogenic Stresses
WANG Lei1,3, REN Xianyun2,3, SONG Liu1,3, LÜ Jianjian2,3, GAO Baoquan2,3, LIU Ping2,3①, SUN Dongfang3
(1. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306; 2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071; 3. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs; Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071)
In this study, the apoptotic protein activator 1 (apoptotic protease activating factor-1,) gene of the swimming crab () was cloned using the RACE technique. The full length of the gene was 2032 bp, and the ORF was 1050 bp, encoding 349 amino acids, with a predicted molecular weight of 39.13 kDa, and a theoretical isoelectric point of 7.67. The homology and phylogenetic analysis showed that the homology ofwithwas 51.27%, and it was also clustered with. Tissue expression analysis showed that the relative expression level of thegene was highest in the hepatopancreas, followed by the muscle, heart, gill, and eyestalk, and was lowest in the hemocytes and epidermis. After different salinity stresses, the expression level ofin the stage Ⅱ juvenile crab reached its maximum at 3 h, and then decreased and then increased.showed an upward trend in the gills after salinity 20 stress after 80 d, and an upward and downward trend in the hepatopancreas, suggesting that the change of salinity could affect the expression ofin the gill and hepatopancreas. The results showed that the expression ofreached its peak at 48 h after injection of, which was 2.76 times higher than that of the control group (<0.05), and increased 12 h after the injection of white spot syndrome virus (WSSV), which was 1.25 times higher than that of the control group (<0.05). In the hepatopancreas, the expression ofreached its peak at 72 h after the injection of, which was 5.44 times higher than that of the control group (<0.05), and 12 h after the injection of WSSV. The peak value was 5.89 times higher than that of the control group (<0.05), and the expression was up-regulated as a whole. This study provides a reference for further understanding the physiological function of thegene in.
;; Low salinity stress;; WSSV
LIU Ping, E-mail: liuping@ysfri.ac.cn
S917
A
2095-9869(2020)04-0085-09
10.19663/j.issn2095-9869.20190418001
http://www.yykxjz.cn/
王磊, 任宪云, 宋柳, 吕建建, 高保全, 刘萍, 孙东方. 三疣梭子蟹基因的克隆及其在低盐和病原胁迫后的表达分析.渔业科学进展, 2020, 41(4): 85–93
Wang L, Ren XY, Song L, Lü JJ, Gao BQ, Liu P, Sun DF. Cloning and expression analysis of thegene inafter exposure to low salt and pathogenic stresses. Progress in Fishery Sciences, 2020, 41(4): 85–93
* 国家虾蟹产业技术体系(CARS-48)、国家自然科学基金面上项目(41876186)、江苏省重点研发计划(面上项目) (BE2017325)和中国水产科学研究院基本科研业务费(2020TD46)共同资助[This work was supported by the National Shrimp and Crab Industry Technology System (CARS-48), National Natural Science Foundation of China (41876186), Key Research and Development Plan of Jiangsu Province (BE2017325), and Central Public-Interest Scientific Institution Basal Research Fund, CAFS (2020TD46)]. 王 磊,E-mail: 1006966437@qq.com
刘 萍, 研究员, E-mail: liuping@ysfri.ac.cn
2019-04-18,
2019-05-15
(编辑 冯小花)

