大菱鲆水通道蛋白(AQP1、AQP3)以及离子通道蛋白(CFTR、NHE1)对低盐胁迫的响应*
张金生 刘志峰 马爱军 崔文晓 曲江波
大菱鲆水通道蛋白(AQP1、AQP3)以及离子通道蛋白(CFTR、NHE1)对低盐胁迫的响应*
张金生1,2,3刘志峰1,2,3马爱军1,2,3①崔文晓1,2,3曲江波4
(1. 中国水产科学研究院黄海水产研究所 山东省海洋渔业生物技术与遗传育种重点实验室青岛市海水鱼类种子工程与生物技术重点实验室 青岛 266071;2. 上海海洋大学水产与生命学院 上海 201306;3. 青岛海洋科学与技术国家实验室海洋生物学与生物技术功能实验室 青岛 266071;4. 烟台开发区天源水产有限公司 烟台 264003)
在鱼类适应环境盐度变化的过程中,鳃、肾、肠是主要的渗透调节器官,而水通道蛋白()、囊性纤维化跨膜传导调节因子()、钠氢交换体()又是这些器官中重要的渗透调节基因。为研究、、、在大菱鲆()低盐胁迫过程中的渗透调节功能,本研究采用荧光定量PCR技术,对4种基因在盐度5和盐度10下大菱鲆鳃、肾、肠中表达量随时间的变化进行检测。结果显示,表达量在鳃中极少(<0.05),在肾和肠中较高,低盐胁迫下,盐度5组和盐度10组在鳃中的表达量无显著变化,在肾和肠中均显著上升(<0.05)。表达量在肾中极少(<0.05),在鳃中较高,在肠中较少,低盐胁迫下,盐度5组和盐度10组在肾中的表达量无显著变化,在鳃和肠中均显著上升(<0.05)。表达量在肾中极少,在鳃中较高,在肠中较少,低盐胁迫下,盐度5组和盐度10组在肾中的表达量无显著变化,在鳃和肠中均显著下降(<0.05)。在鳃和肠中表达量较少,在肾中较高,低盐胁迫下,盐度5组和盐度10组在鳃中的表达量无显著变化,在肾和肠中均显著上升(<0.05)。这些结果表明,4种基因表达水平因组织、盐度和时间的不同而不同,反映了这4种基因的功能特异性;在低盐胁迫下,4种基因积极响应,表达量均发生不同程度的变化,表明、、和在大菱鲆低盐环境适应中可能具有潜在的重要作用。另外,本研究结果可为大菱鲆半咸水养殖和淡化养殖提供理论依据,同时为培育适应低盐环境大菱鲆良种提供理论和技术支撑。
大菱鲆;低盐胁迫;水通道蛋白;囊性纤维化跨膜传导调节因子;钠氢交换体;荧光定量PCR
盐度是影响鱼类生长代谢等各种生理活动的重要环境因素,为适应渗透压不断变化的自然环境以及维持自身渗透压稳定,鱼类进化出一系列的渗透压调节机制。当外界渗透压变化时,鱼体内鳃、肾、肠等主要渗透调节器官和组织积极响应并调节机体水盐代谢平衡,维持体内渗透压稳定。为深入了解鱼类的渗透压调节机理,国内外学者对此进行了大量研究,在渗透器官的形态结构(Yang, 2017)、离子转运过程(Seale, 2014)、激素调节(Tipsmark, 2016)等方面取得许多成果。研究表明,鱼类对环境盐度变化的适应是由许多水通道蛋白(赵超平等, 2018)和离子通道蛋白(马金武等, 2016)共同作用来实现。
AQPs是一组跨膜蛋白家族,作为水分的传输通道,允许水在细胞膜自由流动,对维持参与渗透调节和体液稳态的器官中的水分平衡具有重要作用(Gonen, 2006)。目前,已经发现并报道了13种(~),其中,广泛存在于各种生物体内并发挥重要作用,并得到最为广泛和深入的研究。在鱼类方面,第1个被克隆出的同系物来自日本鳗鲡(),在日本鳗鲡体内,主要在肠道中表达,且海水鳗鱼肠道中mRNA的表达水平高于淡水鳗鱼(Aoki, 2003),而在刀鲚()鳃、肾、肠、脑中的表达水平均较高,高盐胁迫后,鳃中的表达水平下降,而在肾和肠中升高(王美垚等, 2017)。由此可见,在不同鱼类和组织中具有差异性表达,其表达量也与盐度密切相关。
与传统水通道蛋白AQP1的功能有所不同,AQP3除运输水分的主要功能外,对非离子小分子溶质(如尿素和甘油)也具有运输作用,但不能运输较大的分子(如氨基酸和糖)(Ishibashi, 1994)。在硬骨鱼类中,首先在欧洲鳗鲡()中发现(Cutler, 2000),随后,克隆了日本鳗鲡(Tse, 2006)、底鳉() (Jung, 2012)等的cDNA序列,并研究了其功能作用。在鱼类体内分布广泛,在鳃、肾、肠、脑等组织中均有表达,但其表达范围和表达水平因鱼类和组织的不同而差异显著(甘远迪, 2014; Cutler, 2002; Hirata, 2003)。
众多学者已经证实,钠氢交换体() (Watanabe, 2008; Choe, 2005)以及囊性纤维化跨膜传导调节因子() (Davidson, 2000; Chen, 2001)与鱼类渗透调节极具相关性。在鱼类方面,家族成员-已被广泛研究(Edwards, 2010; Pedersen, 2003; Claiborne, 1999)。关于鱼类的研究主要集中在酸碱平衡的调节,但越来越多的研究认为,在鱼类的渗透调节方面也具有重要作用。Smith(1930)首先提出海水鱼类鳃中氯化钠和酸/碱运动之间的联系,作为离子和渗透调节的潜在机制。Edwards等(2010)研究发现,底鳉不仅在酸中毒后的表达发生变化,在不同的盐度环境下的表达也发生相应的变化。淡水适应的莫桑比克罗非鱼() (Watanabe, 2008)和大西洋黄貂鱼() (Choe, 2005)鳃中3表达水平大约是海水适应鱼的2倍。这些结果表明,可能参与渗透调节,特别是在鱼类适应低盐环境时发挥重要作用。
CFTR是ATP结合转运蛋白质中唯一的离子通道蛋白,与Cl–的转运相关,为Cl–跨上皮细胞运动提供选择性通道,对于跨上皮的盐类转运、液体流动和离子浓度调节等具有重要作用(周建华等, 2015)。不同盐度环境中的鱼类分布和表达量具有显著差异,适应海水环境的鳉鱼鳃中CFTR集中分布于氯细胞的顶室顶膜,适应淡水的鳉鱼鳃中CFTR集中分布于鳃上皮氯细胞和扁平细胞的基底外侧膜,硬骨鱼类从低盐到高盐环境适应过程中,CFTR在缓慢地从细胞基底外侧位置重新分布到顶端膜的同时,离子分泌能力也会增强(Marshall, 2002a、b)。当鳉鱼和罗非鱼从海水移至淡水后,基因表达量明显下降(Scott, 2004; Hiroi, 2005),日本鳗鲡经海水驯化后,基因表达量增加(Tse, 2006)。这些研究表明,广盐性硬骨鱼类在高渗环境中的表达量远大于低渗环境,在鱼类适应高盐环境时具有重要作用,是维持鱼体Cl–平衡的重要调控途径。
大菱鲆()俗称“多宝鱼”,是原产于欧洲沿海的一种名贵比目鱼,1992年引进我国后,逐渐成为全国沿海地区尤其是北方地区主要的海水养殖经济种类。同时,随着养殖业的发展,为了适应环保需要,以及满足内陆城市的消费需求,促使大菱鲆养殖区域逐渐向滩涂和内陆地区进行推广,因此,对大菱鲆耐低盐性状的要求更高。但目前为止,国内有关大菱鲆渗透调节方面的研究却鲜有报道。因此,本研究根据从大菱鲆基因组中得到的、、和基因序列,采用荧光定量PCR技术分析了大菱鲆鳃、肾、肠组织中的4种基因在不同盐度胁迫下(盐度5和盐度10)随时间的表达量变化,分析4种基因在低盐胁迫下发挥的渗透调节功能,研究结果可为大菱鲆半咸水养殖和低盐条件养殖提供理论依据,同时为培育适应低盐环境大菱鲆良种提供理论和技术支撑。
1 材料与方法
1.1 实验鱼
实验所用大菱鲆和养殖实验场地均由国家大菱鲆良种场山东烟台天源水产有限公司提供。随机挑选体重为(300±20) g的健康大菱鲆300尾,分别于3个1.5 m3容量的实验桶内暂养7 d,暂养期间水温平衡在14℃~15℃,每天少量投饵1次,换水1次。暂养结束后停止喂食24 h。
1.2 盐度胁迫实验与取样
急性盐度胁迫实验分为3个盐度组,即盐度30组(对照组)、盐度10组和盐度5组(实验组),每个盐度组设3个重复。盐度30组直接使用深井海水,盐度10和盐度5组海水是由深井海水和淡水勾兑稀释而成。每个实验组将暂养的30尾大菱鲆分别放入0.4 m3容量的实验桶中,实验桶内水温保持在14℃~15℃,溶氧大于6 mg/L,自然光照,实验期间不投饵,无死亡现象。
每个盐度组分别在1、12和24 h共3个时间点随机挑选3尾鱼(3个重复,共9条鱼),MS222麻醉后迅速采取鳃、肠和肾组织,放入冻存管后立即在液氮中保存备用。由于胁迫时间较短,对照组仅在实验开始时进行取样(暂养7 d停食24 h),取样方法同上。
1.3 总RNA提取及反转录
RNA提取和cDNA合成过程使用天根生化科技有限公司提供的RNA提取试剂盒(DP431)和反转录试剂盒(KR116-02),实验操作严格按照实验说明书进行。使用NanoDrop 2000(Thermo)和凝胶电泳检测RNA质量和浓度。使用检测合格的RNA进行cDNA合成,合成产物稀释后放入–80℃冰箱保存备用。
1.4 荧光定量的引物设计合成与检测
根据大菱鲆基因的、、和的序列,使用Primer 5.0软件设计上、下游引物,引物合成后进行PCR反应,对反应产物进行序列测定,以检测合成引物的特异性,引物合成以及PCR产物测序均在生工生物工程(上海)有限公司进行。对测序正确的引物,使用标准曲线的方法对其质量及合格程度进行检测。定量用引物表见表1。
1.5 实时荧光定量PCR
使用大菱鲆18S RNA作为内参,通过荧光定量PCR,检测在1、12和24 h的鳃、肾、肠中、、和基因的表达水平。具体操作方法如下:用反转录的cDNA作为模板以及检测合格的特异性引物进行qRT-PCR反应,反应根据北京全式金生物技术有限公司荧光定量PCR试剂盒(AQ131-04)说明书在Applied Biosystems-Step One Plus PCR仪上进行。qRT-PCR的反应体系为20 μl:2 μl模板cDNA, 10 μl SuperMix(2×),6.8 μl RNase-Free Water,上、下游引物各0.4 μl,0.4 μl ROX Reference Dye,扩增反应程序:94℃ 30 s;94℃ 5 s,60℃ 30 s,40个循环。
表1、、和qRT-PCR引物序列

Tab.1 Primers of AQP1, AQP3, CFTR and NHE1 in qRT-PCR
1.6 数据分析
数据使用DDC法(2–DD)进行分析,数据统计分析采用SPSS 23.0软件,结果用平均值±标准差(Mean±SD)表示。用Origin 8.6软件作图。使用Levene检验方差的均匀性。采用单因素方差分析法(One-way ANOVA)检测平均值之间的差异,然后采用Tukey事后检验法对平均值进行多次比较。用Duncan检验对数据进行统计学分析(<0.05为显著水平)。
2 结果
2.1 水通道蛋白AQP1和AQP3基因在不同盐度胁迫下的表达变化
采用qRT-PCR检测了不同盐度胁迫下和基因在大菱鲆鳃、肾、肠中表达量随时间的变化,结果显示,在肾和肠中的表达量较高,在鳃中的表达量极小,显著低于肾和肠(<0.05)。低盐胁迫后,在鳃中,盐度5组和盐度10组的表达量在0~24 h内均无显著变化;在肾中,盐度5组和盐度10组的表达量均呈上升趋势,盐度5组在各时间点均显著高于盐度10组(<0.05);在肠中,盐度5组和盐度10组的表达量呈先上升后下降的趋势,在12 h达到峰值,盐度5组在各时间点均显著高于盐度10组(<0.05)(图1)。
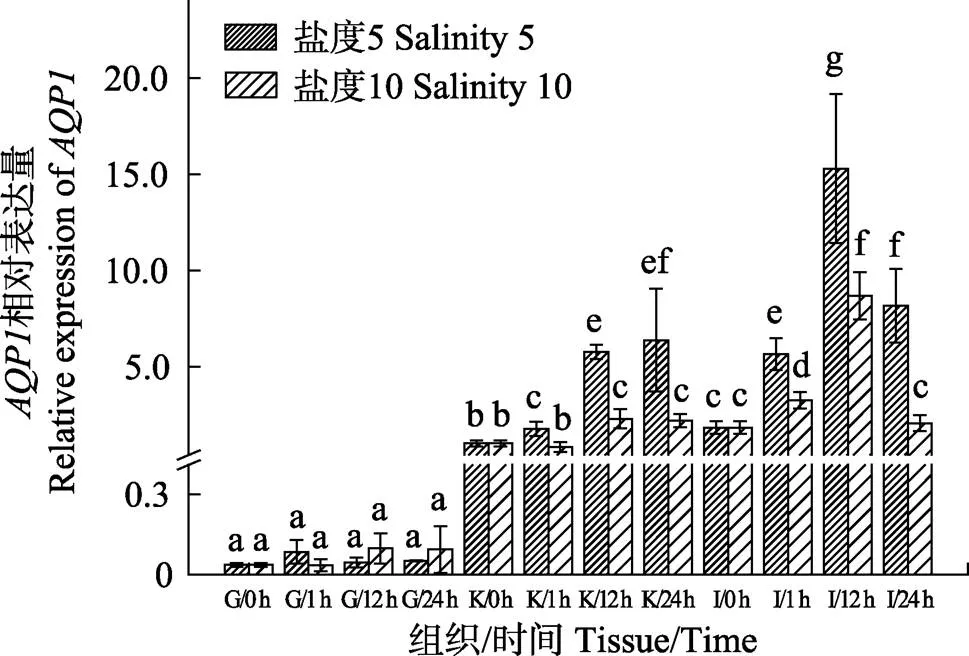
图1 低盐胁迫下大菱鲆鳃、肾、肠中AQP1基因在各时间点的表达量变化
G:鳃;K:肾;I:肠;h:小时。不同的字母代表组间差异显著(0.05)。下同
G: Gill; K: Kidney; I: Intestine; h: Hour. Different letters represented significant differences between groups (0.05). The same as below
与的表达特点不同,在鳃和肠中的表达量较高,而在肾中的表达量极低,显著低于鳃和肠(0.05)。低盐胁迫后,在鳃中,盐度5组的表达量在0~24 h内呈先上升后下降的趋势,在12 h达到峰值,盐度10组的表达量在0~24 h呈上升趋势,盐度5组在24 h显著低于盐度10组(<0.05);在肾中,盐度5组和盐度10组的表达量无显著差异;在肠中,盐度5组的表达量在0~24 h内呈先上升后下降的趋势,在12 h达到峰值,盐度10组肠中的表达量无显著变化,5盐度组在第1、12小时均显著高于盐度10组(<0.05)(图2)。
2.2 NHE1基因在不同盐度胁迫下的表达变化
采用qRT-PCR技术检测了不同盐度胁迫下基因在大菱鲆鳃、肾、肠中表达量随时间的变化,结果显示,在肾中的表达量较高,在鳃和肠中的表达量较低。低盐胁迫后,在鳃中,盐度5组的表达量在0~24 h内显著上升,盐度10组的表达量在0~24 h内无显著变化,盐度5组在各时间点的鳃中表达量均显著高于盐度10组(<0.05);在肠中,盐度5组表达量在1~24 h内显著上升,盐度10组表达量在0~24 h内无显著变化,盐度5组在第12、24小时显著高于盐度10组(<0.05);在肾中,盐度5组的表达量在1~24 h内大幅上升,10盐度组在0~24 h内小幅上升,盐度5组在第12、24小时显著高于盐度10组(<0.05)(图3)。
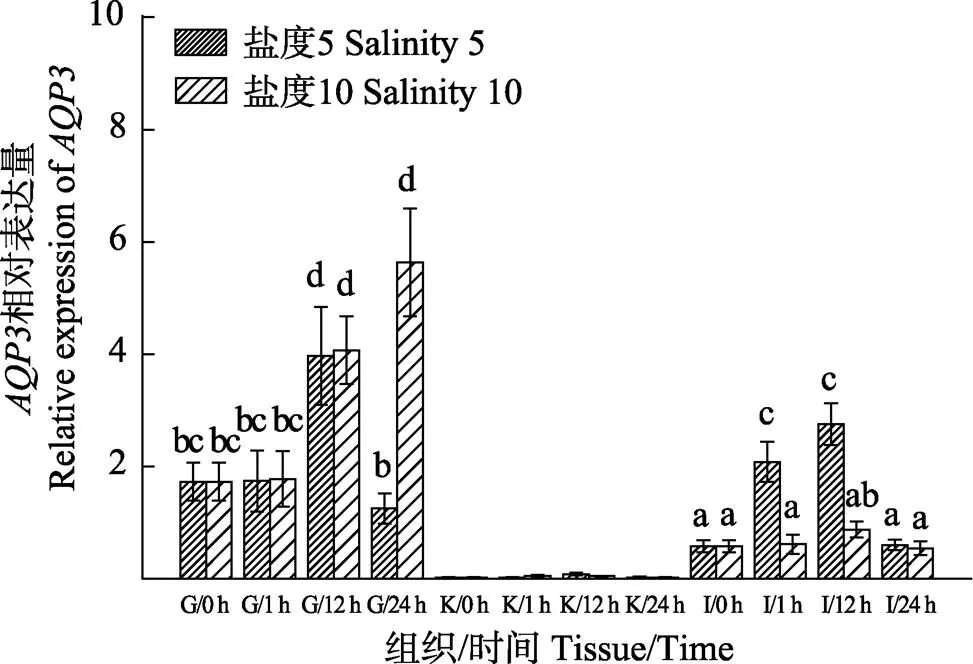
图2 低盐胁迫下大菱鲆鳃、肾、肠中AQP3基因在各时间点的表达量变化
2.3 CFTR基因在不同盐度胁迫下的表达变化
采用qRT-PCR技术检测了不同盐度胁迫下基因在大菱鲆鳃、肾、肠中表达量随时间的变化,结果显示,基因在鳃中的表达量最高,显著高于肾和肠(<0.05),在肾中基本不表达,在肠中的表达量较低。低盐胁迫后,在鳃中,盐度5组和盐度10组的表达量在0~12 h大幅下降,在12~24 h内无显著变化,盐度5组在第1小时显著低于盐度10组(<0.05);在肾中,盐度5组和盐度10组的表达量在0~24 h内基本保持不变;在肠中,盐度5组表达量在0~1 h内下降,在1~24 h内无显著变化,盐度10组的表达量在0~24 h内呈先下降后上升的趋势,在12 h达到最低值,在24 h恢复,盐度5组在24 h显著低于盐度10组(<0.05)(图4)。

图4 低盐胁迫下大菱鲆鳃、肾、肠中CFTR基因在各时间点的表达量变化
3 讨论
鳃、肾、肠作为主要渗透调节器官,当盐度发生变化时,鳃、肾、肠等渗透器官可通过改变形态结构(Yang, 2017)、离子通道(Seale, 2014)以及离子转运蛋白的表达和激素分泌水平(Tipsmark, 2016)等来调整体内外渗透压的动态平衡。鳃可在高渗环境中分泌Cl–,在低渗环境中吸收Na+和Cl–,肠道可在高渗环境中排出过多的离子以降低所吞海水的渗透压,进而间接地促进上皮细胞吸收大量的海水以补充丢失的水分。在低渗环境中,肠道则会吸收过多的水分。肾脏在高渗环境中重吸收水分并产生较少的高渗尿液,在低渗环境中吸收各种离子,排出大量稀薄的尿液。可见,这些渗透器官在发挥自己功能作用的同时又相互合作,共同进行渗透压的调节,维持机体渗透压的正常稳定。因此,本研究选取主要渗透调节器官鳃、肾和肠,检测大菱鲆、、和在低盐胁迫下的表达变化,分析这些基因在大菱鲆渗透调节过程中的作用。
3.1 水通道蛋白AQP1和AQP3基因对低盐胁迫的响应分析
AQPs是一组跨膜蛋白家族,其作为水分的传输通道,允许水在细胞膜自由流动,对维持渗透调节和体液稳态相关器官中的水分平衡具有重要作用(Gonen, 2006)。目前,和分别在日本鳗鲡(Aoki, 2003)、刀鲚(王美垚等, 2017)和欧洲鳗鲡(Cutler, 2000)、底鳉(Jung, 2012)等硬骨鱼类中被发现研究并报道,证实了及广泛分布于鱼类的各种渗透调节器官,其表达调控在鱼体水分运输调节中起到重要作用。本实验结果显示,基因在肾和肠中表达量较高,在鳃中表达量极少,与暗纹东方鲀() (Jeong, 2014)的研究结果一致。低盐胁迫后,在鳃中表达量变化不显著,推测可能在大菱鲆鳃中的渗透调节功能有限。在肾和肠中的表达量显著升高,这与黑鲷()和欧洲鳗鲡的研究结果相一致,当海水中培养的黑鲷(An, 2008)转移至10%海水和淡水时,基因在肾和肠中的表达量显著增加,对黄鳗(欧洲鳗鲡)(Martinez, 2012)进行高盐胁迫时,肾中的表达量显著下降。而卵形鲳鲹() (赵超平等, 2018)和暗纹东方鲀(Jeong, 2014)肾和肠中的表达量在高渗胁迫下上升,在低渗胁迫下降低,这与本研究结果相反。通常在高渗条件下,鱼类吞咽高渗水溶液,通过肠和肾对高渗液的吸收以及肾对尿液的重吸收来补充鱼体失水,这些过程需要较高水平的水运输,因此,需要的表达量增加。大菱鲆在低渗胁迫后,的增加看似难以理解,但实际上肾和肠都可以作为吸收或分泌器官来发挥渗透调节作用,因此,在器官中的差异性表达可能是根据鱼类适应环境变化的需要来发挥其吸收或分泌的作用。当水环境渗透压降低时,鱼类将面临大量水分渗透进体内,进而需要肾产生大量的低渗尿液以及肠排出更多的水分,因此,大菱鲆在低渗条件下中的表达量上升可能是参与了肾肠组织的排水过程,是一种应对低渗环境的科学表达模式(An, 2008)。此外,盐度10组,肾中在第12小时有上升趋势,随后趋于稳定,而盐度5组在各时间点表达量均显著升高,可能是因为大菱鲆具有良好的渗透调节能力,因此,盐度10组在第12小时升高表达量后足以应对盐度为10的环境,而盐度5组则需要继续升高表达量来应对更低盐度的环境。在肠中,盐度5组和盐度10组表达量均呈先上升后下降的趋势,推测是因为大菱鲆受到低盐刺激后,肠道中大量表达,增加对水的通透性,有利于水的排出,当大菱鲆体内水盐趋于平衡时,表达量回落。
与的表达模式不同,主要在鳃中表达,在肠中表达量较少,在肾中几乎不表达,与欧洲鳗鲡(Cutler, 2000)和日本鳗鲡(Kim, 2010)的表达模式一致。低盐胁迫后,盐度10组和盐度5组在鳃和肠中表达量均有不同程度的上升,在肾中无明显变化。研究发现,在盐度胁迫下,尼罗罗非鱼()鳃中的表达量随盐度的上升而下降,随盐度的下降而上升(甘远迪, 2014),海鲈()(Giffard-Mena, 2007)和银海鲷() (Deane, 2006)在低渗环境下,鳃中表达量显著高于高渗环境,这些研究结果均与本研究结果基本一致。众所周知,鳃组织直接接触周围环境介质,海水鱼类将面临因渗透梯度较大而产生高通量水分子流的风险,因此,从渗透调节的角度来看,生物体选择将鳃上皮的透水性保持在较低限度,以维持体内渗透稳态,是一种科学的适应模式(王美垚等, 2017)。对于鳃中表达量在低渗条件下高于高渗条件的现象,有学者认为,在淡水条件下,鳃上皮对水的通透性高(Kammerer, 2010),大量水分进入鱼体内,鳃上皮细胞可将由细胞顶端进入的水从基底侧排出,因此,增加的表达量来促进水分的排出,可防止上皮细胞膨胀破裂,维持体内渗透平衡(Cutler, 2001)。此外,有研究通过免疫组化显示,存在于欧洲鳗鲡鳃中的氯细胞、初级鳃瓣的基底上皮细胞以及鳃弓上皮细胞中,在欧洲鳗鲡海水适应的过程中,氯细胞内的表达量不变,而初级鳃瓣的基底上皮细胞以及鳃弓上皮细胞中的显著减少,这可能是导致mRNA和蛋白在海水环境中下调的原因(Cutler, 2007)。令人感到意外的结果是,盐度胁迫的第12小时,盐度5组和盐度10组在鳃中的表达量均显著升高,在第24小时盐度5组表达量急剧下降,而盐度10组继续上升,推测原因可能是从高盐环境转移至低盐环境后出现了一定的渗透调节失衡所致(赵超平等, 2018;An, 2008)。在肠中,盐度5组表达量在第1、12小时显著上升后,在第24小时恢复,盐度10组的表达量也在第12小时轻度上调后,在第24小时恢复。推测是因为大菱鲆受到低盐刺激后,肠道中大量表达,增加对水的通透性,有利于水的排出,而后大菱鲆体内水盐趋于平衡,表达量回落。
3.2 离子通道蛋白NHE1对低盐胁迫的响应分析
NHE是一种双向离子交换载体蛋白,通常位于细胞的顶膜或基底膜外侧,具有催化细胞内H+和细胞外Na+的电中性交换的作用。Edwards等(2010)等研究发现,底鳉不仅在酸中毒后的表达发生变化,在不同的盐度环境下的表达也会发生相应的变化。这些结果表明,可能参与渗透调节,特别是在鱼类适应低盐环境时发挥了重要作用。本研究结果显示,在鳃中表达量较多,在肾和肠中表达量较少,显著低于鳃中。低盐胁迫后,在鳃、肾、肠中的表达量均显著升高,推测在低渗条件下参与了渗透调节过程。有研究显示,淡水适应的莫桑比克罗非鱼(Watanabe, 2008)和大西洋黄貂鱼(Choe, 2005)鳃中的3表达水平均显著高于海水适应鱼,三疣梭子蟹() (马金武等, 2016)在低盐胁迫下,在鳃中的表达量上升,在高盐胁迫下,鳃中表达量下降。这些研究结果与本研究结果相一致,表明可能具有从低离子环境中吸收钠的功能(Choe, 2005)。此外,盐度5组各组织中的表达量在大多数时间点显著高于盐度10组,推测低盐环境可能对鳃、肾、肠中的表达具有促进作用,在极低盐的环境中作用更明显(马金武等, 2016)。另外,盐度5组大菱鲆鳃中的表达量在胁迫后第1小时就显著上升,而在肾和肠中的表达量在第12小时才开始增加,这可能是因为鳃作为与水环境直接接触的渗透调节器官,当水环境盐度剧烈变化时,最先响应盐度胁迫进行渗透调节,以维持鱼体渗透压稳定。而肾和肠则需要根据鱼体吞咽进来的水来判定盐度的变化,因此响应时间有所延迟,不过这种猜测还需进一步的验证(赵超平等, 2018)。
3.3 离子通道蛋白CFTR对低盐胁迫的响应分析
CFTR是一种与Cl–的转运相关的离子通道蛋白,为Cl–跨上皮细胞运动提供选择性通道,对于跨上皮的盐类转运、液体流动和离子浓度调节等具有重要作用(周建华等, 2015)。大量研究已表明,广盐性硬骨鱼类在高渗环境中的表达量远大于低渗环境,在鱼类适应高盐环境时具有重要作用,是维持鱼体Cl–平衡的重要调控途径(Hiroi, 2005; Tse, 2006)。本结果显示,主要在鳃中表达,表达量远高于肠和肾,在肠中表达量较少,在肾中基本不表达。这与舌齿鲈()的研究结果一致,无论是在海水或淡水环境中,在舌齿鲈鳃中的表达量均显著高于肾和肠(Bodinier, 2009)。在海水条件下,鱼类通过吞咽海水,利用肠和肾对高渗液的吸收以补充水分,然后经过鳃将盐分排出体外,因此,在鳃中的大量表达有助于Cl–的排出。低盐胁迫后,本研究中盐度10组和盐度5组在鳃和肠中的表达量显著降低,在肾中的表达量无明显变化,与底鳉(Scott, 2004)的研究结果相一致,当底鳉从盐度10海水分别移至淡水和海水时,底鳉的鳃中的表达量分别显著降低和增加,将舌齿鲈从海水转移至淡水时,鳃和肠中的表达量均显著降低。海水硬骨鱼类通过吞饮海水,利用肠道吸收水和离子,并通过鳃和皮肤上皮的氯细胞将过多的离子分泌出体外(Singer, 1998)。因此,当外部环境盐度突然下降时,鱼体积极响应,促使鳃和肠中表达量减少,防止鱼体内离子大量流失而导致体内水盐失衡。此外,在第1小时盐度10组的鳃中,表达量显著高于盐度5组可能是因为盐度5组的盐度更低,导致表达量下降更显著。
本研究利用qRT-PCR技术,检测了大菱鲆鳃、肾、肠中、、、四种基因在不同盐度胁迫下不同时间点的表达量,结果显示,、、三种基因的表达量在低盐胁迫下总体呈上升趋势,而基因的表达量在低盐胁迫下总体呈下降趋势,这4种基因表达水平因组织、盐度和时间的不同而不同,反映了这4种基因的功能特异性。在低盐胁迫下,4种基因积极响应,且表达量均发生不同程度的变化,因此,、、和在大菱鲆低盐环境适应中可能具有潜在的重要作用。本研究可为在分子水平上阐述大菱鲆的渗透调节机制提供理论依据,同时为半咸水养殖和低盐条件下养殖提供理论支撑。
An KW, Kim NN, Choi CY. Cloning and expression of aquaporin 1 and arginine vasotocin receptor mRNA from the black porgy,: Effect of freshwater acclimation. Fish Physiology and Biochemistry, 2008, 34(2): 185–194
Aoki M. Intestinal water absorption through aquaporin 1 expressed in the apical membrane of mucosal epithelial cells in seawater-adapted Japanese eel. Journal of Experimental Biology, 2003, 206(19): 3495–3505
Bodinier C, Lorin-Nebel C, Charmantier G,. Influence of salinity on the localization and expression of thechloride channel in the ionocytes of juvenileexposed to seawater and freshwater. Comparative Biochemistry and Physiology Part A Molecular and Integrative Physiology, 2009, 153(3): 345–351
Chen JM, Cutler C, Jacques C,. A combined analysis of the cystic fibrosis transmembrane conductance regulator: Implications for structure and disease models. Molecular Biology and Evolution, 2001, 18(9): 1771–1788
Choe KP, Kato A, Hirose S,.3 in an ancestral vertebrate: Primary sequence, distribution, localization, and function in gills. American Journal of Physiology-Regulatory Integrative and Comparative Physiology, 2005, 289(5): R1520
Claiborne JB, Blackston CR, Choe KP,. A mechanism for branchial acid excretion in marine fish: Identification of multiple Na+/H+antiporter isoforms () in gills of two seawater teleosts. Journal of Experimental Biology, 1999, 202: 315–324
Cutler CP, Cramb G. Branchial expression of an aquaporin(-3) homologue is downregulated in the European eelfollowing seawater acclimation. Journal of Experimental Biology, 2002, 205(17): 2643–2651
Cutler CP, Cramb G. Molecular physiology of osmoregulation in eels and other teleosts: The role of transporter isoforms and gene duplication. Comparative Biochemistry and Physiology Part A Molecular and Integrative Physiology, 2001, 130(3): 551–564
Cutler CP, Cramb G. Water transport and aquaporin expression in fish, molecular biology and physiology of water and solute transport. Springer US, 2000, 431–441
Cutler CP, Martinez AS, Cramb G. The role of aquaporin 3 in teleost fish. Comparative Biochemistry and Physiology Part A Molecular and Integrative Physiology, 2007, 148(1): 82– 91
Davidson H, Taylor MS, Doherty A,. Genomic sequence analysis ofand flanking genes in a 60 kb region conserving synteny with 800 kb of human chromosome 7. Genome Research, 2000, 10(8): 1194–1203
Deane EE, Woo NYS. Tissue distribution, effects of salinity acclimation, and ontogeny of aquaporin 3 in the marine teleost, silver sea bream (). Marine Biotechnology (New York), 2006, 8(6): 663–671
Edwards SL, Wall BP, Morrison-Shetlar A,. The effect of environmental hypercapnia and salinity on the expression of-like isoforms in the gills of a euryhaline fish (). Journal of Experimental Zoology Part A Ecological Genetics and Physiology, 2010, 303A(6): 464–475
Gan YD. cDNA cloning of aquaporin 3 in,and tissue expression patterns under salinity stresses. Master´s Thesis of Shanghai Ocean University, 2014 [甘远迪. 萨罗罗非鱼、尼罗罗非鱼cDNA序列克隆及盐度胁迫下组织表达特征. 上海海洋大学硕士研究生学位论文, 2014]
Giffard-Mena I, Boulo V, Aujoulat F,. Aquaporin molecular characterization in the sea-bass (): The effect of salinity onandexpression. Comparative Biochemistry and Physiology Part A Molecular and Integrative Physiology, 2007, 148(2): 430–444
Gonen T, Walz T. The structure of aquaporins. Quarterly Reviews of Biophysics, 2006, 39(4): 361–396
Hirata T, Kaneko T, Ono T,. Mechanism of acid adaptation of a fish living in a pH 3.5 lake. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2003, 284(5): R1199–R1212
Hiroi J, Mccormick SD, Ohtanikaneko R,. Functional classification of mitochondrion-rich cells in euryhaline Mozambique tilapia () embryos, by means of triple immunofluorescence staining forNa/K- ATPase,Na/K/2Cl cotransporterandanion channel. Journal of Experimental Biology, 2005, 208(11): 2023–2036
Ishibashi K, Sasaki S, Fushimi K,. Molecular cloning and expression of a member of the aquaporin family with permeability to glycerol and urea in addition to water expressed at the basolateral membrane of kidney collecting duct cells. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(14): 6269–6273
Jeong SY, Kim JH, Lee WO,. Salinity changes in the anadromous river pufferfish,, mediate gene regulation. Fish Physiology and Biochemistry, 2014, 40(1): 205–219
Jung D, Sato JD, Shaw JR,. Expression of aquaporin 3 in gills of the Atlantic killifish (): Effects of seawater acclimation. Comparative Biochemistry and Physiology Part A Molecular and Integrative Physiology, 2012, 161(3): 320–326
Kammerer BD, Cech JJ, DietmarKültz. Rapid changes in plasma cortisol, osmolality, and respiration in response to salinity stress in tilapia (). Comparative Biochemistry and Physiology Part A Molecular and Integrative Physiology, 2010, 157(3): 260–265
Kim YK, Watanabe S, Kaneko T,. Expression of aquaporins 3, 8 and 10 in the intestines of freshwater- and seawater- acclimated Japanese eels. Fisheries Science (Tokyo), 2010, 76(4): 695–702
Ma JW, Lü JJ, Liu P,. Na+/H+-exchanger in swimming Crab (): Cloning, characterization andmRNA expression under salinity stress. Acta Hydrobiologica Sinica, 2016, 40(5): 902–907 [马金武, 吕建建, 刘萍, 等. 三疣梭子蟹Na+/H+-exchanger基因克隆鉴定及在盐度胁迫下的表达分析. 水生生物学报, 2016, 40(5): 902–907]
Marshall WS, Lynch EM, Cozzi RRF. Redistribution of immunofluorescence ofanion channel and NKCC cotransporter in chloride cells during adaptation of the killifishto sea water. Journal of Experimental Biology, 2002a, 205(9): 1265–1273
Marshall WS, Singer TD. Cystic fibrosis transmembrane conductance regulator in teleost fish. Biochimica et Biophysica Acta Biomembranes, 2002b, 1566(1): 16–27
Martinez AS, Cutler CP, Wilson GD,. Cloning and expression of three aquaporin homologues from the European eel (): Effects of seawater acclimation and cortisol treatment on renal expression. Biology of the Cell, 2012, 97(8): 615–627
Pedersen SF, King SA, Rigor RR,. Molecular cloning offrom winter flounder RBCs: Activation by osmotic shrinkage, cAMP, and calyculin A. Renal Physiology, 2003, 284: C1561–1576
Scott GR. Changes in gene expression in gills of the euryhaline killifishafter abrupt salinity transfer. American Journal of Physiology: Cell Physiology, 2004, 287(2): C300–C309
Seale AP, Stagg JJ, Yamaguchi Y,. Effects of salinity and prolactin on gene transcript levels of ion transporters, ion pumps and prolactin receptors in Mozambique tilapia intestine. General Comparative Endocrinology, 2014, 206(9): 146–154
Singer TD, Tucker SJ, Marshall WS,. A divergenthomologue: Highly regulated salt transport in the euryhaline teleost. American Journal of Physiology, 1998, 274(1): 715–723
Smith HW. The absorption and excretion of water and salts by marine teleosts. American Journal of Physiology, l930: 419–427
Tipsmark CK, Breves JP, Rabeneck DB,. Regulation of gill claudin paralogs by salinity, cortisol and prolactin in Mozambique tilapia (). Comparative Biochemistry and Physiology Part A Molecular and Integrative Physiology, 2016, 199: 78–86
Tse WK, Au DW, Wong CK. Characterization of ion channel and transporter mRNA expressions in isolated gill chloride and pavement cells of seawater acclimating eels. Biochemical and Biophysical Research Communications, 2006, 346(4): 1181–1190
Wang MY, Yang J, Xu P,. Molecular cloning and expression analysis of aquaporin-1 from theunder high-salinity conditions. Journal of Fishery Sciences of China, 2017, 24(3): 449–458 [王美垚, 杨健, 徐跑, 等. 刀鲚水通道蛋白1的分子克隆及高盐作用下的表达分析. 中国水产科学, 2017, 24(3): 449–458]
Watanabe S, Niida M, Maruyama T,. Na+/H+exchanger isoform 3 expressed in apical membrane of gill mitochondrion-rich cells in Mozambique tilapia. Fisheries Science, 2008, 74
Yang SH, Tsai JD, Kang CK,. The ultrastructural characterization of mitochondria-rich cells as a response to variations in salinity in two types of teleostean pseudobranch: Milkfish () and Mozambique tilapia (). Journal of Morphology, 2017, 278(3): 390–402
Zhao CP, Guo HY, Zhang J,. Molecular characteristics and expression analysis ofa fromunder acute salinity stress. South China Fisheries Science, 2018, 14(4): 56–65 [赵超平, 郭华阳, 张健, 等. 卵形鲳鲹a分子特征及其对急性盐度胁迫的表达响应. 南方水产科学, 2018, 14(4): 56–65]
Zhou JH, Pu JY. Current status and prospects of chloride channel-related kidney diseases. Journal of Clinical Nephrology, 2015, 15(11): 644–649 [周建华, 蒲金赟. 氯离子通道相关肾脏疾病的现状和展望. 临床肾脏病杂志, 2015, 15(11): 644–649]
Response of Aquaporin (AQP1, AQP3) and Ion Channel Protein(CFTR, NHE1) of Turbot () to Low-Salinity Stress
ZHANG Jinsheng1,2,3, LIU Zhifeng1,2,3, MA Aijun1,2,3①, CUI Wenxiao1,2,3, QU Jiangbo4
(1.Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences; Shandong Key Laboratory of Marine Fisheries Biotechnology and Genetic Breeding; Qingdao Key Laboratory for Marine Fish Breeding and Biotechnology, Qingdao 266071;2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306; 3.Laboratory for Marine Biology and Biotechnology, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071; 4.Yantai Tianyuan Aquatic Limited Corporation, Yantai 264003)
Salinity is an important environmental factor affecting the growth and metabolism of fish. The gill, kidney, and intestine are the main osmoregulatory organs involved in the adaptation of fish to changes in environmental salinity, and(), the(), and theNa/H exchanger() are important osmoregulatory genes in these organs. To study the osmoregulatory function of,,, andin turbots () under low salinity stress, their expressions in the gill, kidney, and intestine of turbots at salinity levels of 5 and 10 (5- and 10-salinity groups, respectively) were detected by quantitative real-time PCR. The results showed that the expression ofwas very low in the gill but high in the kidney and intestine. Under low salinity stress, the expression ofin the gill did not change significantly in either of the salinity groups, but it increased significantly in the kidney and intestine (<0.05). The expression ofwas very low in the kidney, high in the gill, and low in the intestine. Under low salinity stress, the expression ofin the kidney did not change significantly in either of the salinity groups, but it increased significantly in the gill and intestine (<0.05). Similarly, the expression ofwas very low in the kidney, high in the gill, and low in the intestine. Under low salinity stress, the expression ofin the kidney did not change significantly in either of the salinity groups, but it decreased significantly in the gill and intestine (<0.05). The expression ofwas low in the gill and intestine but high in the kidney. Under low salinity stress, the expression ofin the gill did not change significantly in either of the salinity groups, but it increased significantly in the kidney and intestine (<0.05). These results indicate that the expressions of the four genes vary according to tissue type, salinity, and time, thus reflecting their functional specificity. Under low salinity stress, these genes responded positively and their expressions changed to varying degrees, thus suggesting the roles of,,, andin the adaptation of turbots to low salt environments. In addition, the results of this study can provide theoretical basis for brackish water aquaculture and desalination aquaculture of turbots as well as theoretical and technical support to improve the breeding of turbot varieties and their adaptation to low salinity environments.
; Low-salinity stress;;; Na/H-exchanger; Quantitative real-time PCR
MA Aijun, E-mail: maaj@ysfri.ac.cn
S967
A
2095-9869(2020)04-0041-09
10.19663/j.issn2095-9869.20190410003
http://www.yykxjz.cn/
张金生, 刘志峰, 马爱军, 崔文晓, 曲江波. 大菱鲆水通道蛋白(AQP1、AQP3)以及离子通道蛋白(CFTR、NHE1)对低盐胁迫的响应. 渔业科学进展, 2020, 41(4): 41–49
Zhang JS, Liu ZF, Ma AJ, Cui WX, Qu JB. Response of aquaporin (AQP1, AQP3) and ion channel protein (CFTR, NHE1) of turbot () to low-salinity stress. Progress in Fishery Sciences, 2020, 41(4): 41–49
* 现代农业产业技术体系建设专项(CARS-47-01)、中国水产科学研究院黄海水产研究所基本科研业务费(20603022019019)、青岛海洋科学与技术国家实验室“鳌山人才”培养计划项目(2017ASTCP-OS04)、国家自然科学基金项目(41706168)和山东省农业良种工程项目(2016LZGC031)共同资助 [This work was supported by China Agriculture Research System (CARS-47-01), Special Scientific Research Funds for Central Non-Profit Institutes, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences (20603022019019), “Aoshan Talents” Training Program Project by Qingdao National Laboratory for Marine Science and Technology (2017ASTCP-OS04), National Natural Science Foundation(41706168), and Shandong Agriculture Seed Project (2016LZGC031)]. 张金生,E-mail: 1451980580@qq.com
马爱军,研究员,E-mail: maaj@ysfri.ac.cn
2019-04-10,
2019-06-03
(编辑 冯小花)

