血清小而密低密度脂蛋白与急性缺血性脑卒中及预后的关系
刘金城,冯文敏,姚璇,任自敬,周佩洋
急性缺血性脑卒中(AIS)是一种严重危害人类健康的脑血管疾病,目前已跃居我国疾病死亡的首要病因[1-2]。AIS是多种因素相互作用的结果,动脉粥样硬化是AIS发生发展的病理基础,其中不稳定的粥样硬化斑块发挥重要作用[3-4]。一些血管危险因素,如高血压、糖尿病、吸烟、饮酒、高血脂、肥胖等,特别是低密度脂蛋白胆固醇(LDL-C)被认为是动脉粥样硬化的传统危险因素[5]。然而越来越多的临床研究发现,这些传统的危险因素只能部分预测AIS的发病风险[6-8]。低密度脂蛋白(LDL)是由密度、体积、理化特性等方面不同的多种颗粒组成,根据主峰颗粒直径大小分为:(1)LDL-C A,胆固醇含量高、粒径大(直径>25.8 nm);(2)LDL-C B,胆固醇含量低、粒径小(直径<25.8 nm),即小而密低密度脂蛋白胆固醇(sdLDL-C)。研究发现,sdLDL-C比LDL-C具有更强的动脉粥样硬化形成能力[9]。sdLDL已证实与心血管疾病风险的增加密切相关[10]。本研究通过检测AIS患者的sdLDL水平,探讨sdLDL与AIS及预后的关系,以期为其评估预后提供理论依据。
1 对象与方法
1.1 对象 (1)AIS组:收集2018年5月至2019年6月就诊于襄阳市第一人民医院,发病后72 h内入院的首次AIS患者338例,均经头颅MRI确诊。男209例,女129例;年龄25~90岁,平均66岁;病程均<72 h。根据卒中TOAST分型,患者分为大动脉粥样硬化型卒中(LAA)亚组179例,小动脉闭塞型卒中(SAO)亚组147例,心源型卒中(CE)亚组9例和其他类型卒中(ODC)亚组3例。排除其他原因所致卒中(TIA、蛛网膜下腔出血、脑出血、烟雾病等)、动静脉畸形、严重系统性疾病(糖尿病除外)以及炎症、肝脏、肿瘤和肾脏疾病所致的卒中。(2)对照组:系同期无神经系统疾病或非卒中相关神经系统疾病的患者103例。男50例,女53例;年龄30~78岁,平均61岁。入组患者均被告知研究目的,并在参与研究前签订知情同意书,认知障碍患者由其亲属签署书面知情同意。全部研究过程均按照赫尔辛基宣言的伦理准则进行规划和执行,研究方案经本院伦理审查委员会批准。
1.2 方法
1.2.1 临床资料的收集 入院时收集患者的临床资料,包括年龄、性别、血压、吸烟及饮酒史、高血压、心血管疾病、糖尿病、高脂血症及服药情况,参照WHO及我国卫生部门对吸烟、饮酒的定义:每日吸烟1支或以上,连续吸烟3个月或以上者可认为其有抽烟史;将每日饮酒>15 g, 且具有5年以上饮酒史或反复大量酗酒史认为其具有饮酒史。收集身高、体质量,计算体质量指数(BMI)。卒中后90 d采用电话或门诊随访患者预后情况,并使用mRS进行评估预后,mRS<3为预后良好,mRS≥3分为预后不良。
1.2.2 血液指标的检测 入组者于禁食12 h后,静脉采血5 ml,3 000 r/min离心10 min分离出血清,利用Lipoprint LDL亚组分检测系统(Quantimetrix公司,美国)进行LDL亚组分检测[11]。通过Lipoprint软件自动分析光密度图,得到脂蛋白分析图谱、脂蛋白各亚组分水平(mmol/L)、LDL颗粒大小及LDL亚组分(LDL1-7)百分比。LDL亚组分中LDL-4、LDL-5、LDL-6、LDL-7为sd-LDL,正常者LDL亚型不含sdLDL。总胆固醇(TC)、LDL、高密度脂蛋白(HDL)、三酰甘油(TG)、同型半胱氨酸(Hcy)均采用标准实验室方法检测。

2 结 果
2.1 AIS组与对照组血脂水平的比较 见表1。AIS组共338例,其中异常sdLDL 304例,占总数89.9%,对照组共纳入103例患者,异常sdLDL共71例,占68.9%,AIS组异常sdLDL发生率较对照明显增高,其中LAA亚组异常sdLDL所占比率较对照组明显升高,差异有统计学意义(均P<0.05),而SAO亚组、CE亚组和ODC亚组的血清异常sdLDL差异无统计学意义(均P>0.05)。

表1 对照组和AIS组血脂水平的比较[x±s,例,%,M(Q25,Q75)]组别例数TC(mmol/L)LDL-C(mmol/L)HDL-C (mmol/L)TG(mmol/L)sdLDL水平(mg/dl)sdLDL异常发生率AIS组3383.7±1.32.0±0.939.5±17.01.1±0.85.0(7.1,9.2)304(89.9)* LAA亚组1793.7±1.42.0±0.938.0±20.01.2±0.8*6.0(7.2,10.0)*161(89.9)* SAO亚组1473.7±0.82.0±0.840.0±14.01.1±0.74.2(6.3,9.4)131(89.1) CE亚组93.6±0.71.9±0.342.0±12.40.9±0.23.3(1.9,5.6)9(100.0) ODC亚组33.6±2.52.6±1.842.0±24.0*1.4±0.52.0(5.9,10.3)3(100.0)对照组1033.8±1.42.1±0.743.4±12.71.0±0.73.0(4.5,7.3)71(68.9)
2.2 AIS组中异常sdLDL亚组与正常sdLDL亚组临床资料的比较 见表2。根据LDL亚组分检测结果AIS组患者分为异常sdLDL亚组287例,正常sdLDL亚组51例。与正常sdLDL亚组比较,异常sdLDL亚组中男性患者占比偏高,冠心病患者发病比率高于正常sdLDL亚组,血清异常sdLDL亚组患者中TC、LDL-C、TG水平及90 d mRS评分、90 d NIHSS评分均显著升高(均P<0.05)。

表2 AIS组sdLDL异常亚组及sdLDL正常亚组临床资料的比较(x±s,例,%)组别sdLDL正常亚组(n=51)sdLDL异常亚组(n=287)年龄(岁)65.0±11.065.0±16.0男性23(45.1)186(64.8)*吸烟12(23.5)93(32.4)饮酒11(21.6)76(26.5)高血压42(82.3)214(74.5)糖尿病17(33.3)69(24.0)冠心病4(7.8)44(15.3)*高脂血症9(17.6)96(33.5)*心房纤颤2(3.9)16(5.5)高Hcy17(33.3)125(43.5)心源性栓塞09(3.0)BMI(kg/m2)23.50±4.7022.10±5.80收缩压 (mmHg)155.50±23.30154.40±22.10舒张压(mmHg)83.50±16.9084.10±17.80TC(mmol/L)3.20±1.073.80±0.90*LDL-C(mmol/L)1.57±0.482.18±0.65*HDL-C (mmol/L)39.00±22.0040.00±16.00TG(mmol/L)0.97±0.681.17±0.76*入院NIHSS评分2.00±5.004.00±6.0090 d NIHSS评分1.00±2.001.00±3.00*90 d mRS评分0.00±1.001.00±3.00* 注:与正常sdLDL亚组比较*P<0.05
2.3 影响AIS预后的相关因素分析 见表3、表4。根据90 d mRS评分结果将患者分为预后良好组(243例)及预后不良组(95例)。与预后良好组患者比较,预后不良组中男性患者所占比率及血清异常sdLDL所占比率均明显增高,两组比较有统计学差异(均P<0.05)。预后良好组中冠心病患者32例(13.2%),预后不良组中冠心病患者16例(16.8%),二者无明显统计学差异(P>0.05)。纳入传统危险因素,进一步行多因素Logistic回归分析显示,男性(OR=0.82,P<0.05)、冠心病(OR=1.25,P<0.05)和血清异常sdLDL(OR=1.10,P<0.05)与预后不良均显著相关。
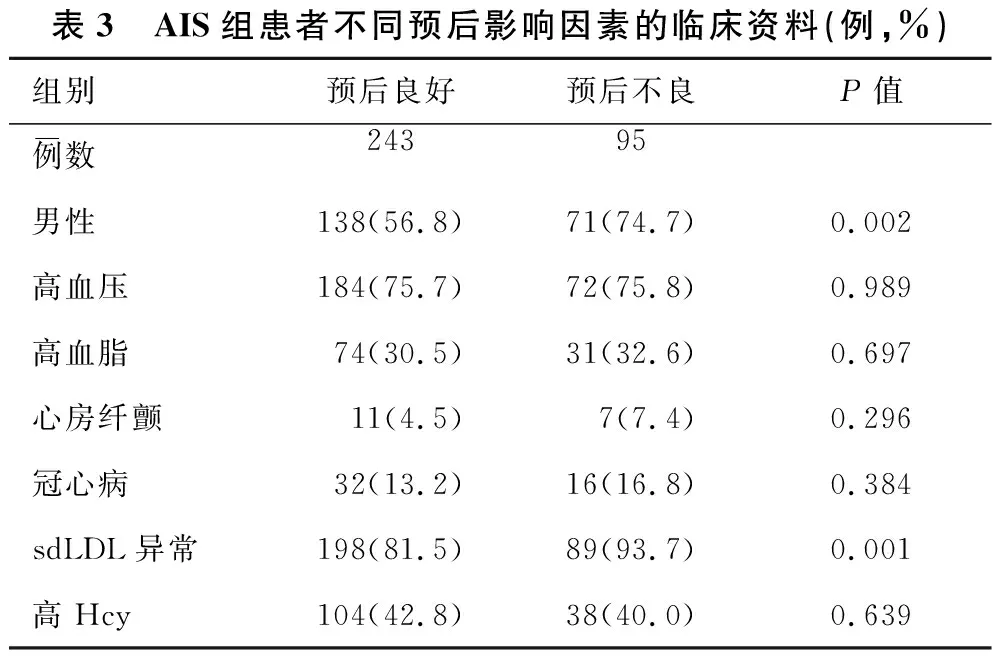
表3 AIS组患者不同预后影响因素的临床资料(例,%)组别预后良好预后不良P值例数24395-男性138(56.8)71(74.7)0.002高血压184(75.7)72(75.8)0.989高血脂74(30.5)31(32.6)0.697心房纤颤11(4.5)7(7.4)0.296冠心病32(13.2)16(16.8)0.384sdLDL异常198(81.5)89(93.7)0.001高Hcy104(42.8)38(40.0)0.639

表4 多因素Logistic回归分析AIS预后的影响因素项目OR值95%CIP值男性0.820.26~0.76 0.003高血压0.040.59~1.850.895糖尿病0.230.71~2.220.430高脂血症0.010.59~1.730.970心房纤颤0.500.59~ 4.610.340冠心病1.250.10~0.800.018sdLDL1.101.00~9.050.041Hcy0.260.46~1.280.320
3 讨 论
有统计超过65%的急性卒中的死亡发生在发展中国家[12-13]。中国承担着世界上最大的急性卒中负担,卒中成为中国人群疾病致死的主要原因[14]。在我国,大约20%的总体死亡可以归咎于卒中,每年有200多万新病例被诊断出来,由于人口老龄化,这一负担正在进一步增加[15]。AIS是由多因素所致的疾病,传统的危险因素包括高血压、糖尿病、高脂血症、吸烟、饮酒、肥胖等[16]。LDL包括大小、密度和组成不同的异质体颗粒,LDL亚组分中的胆固醇浓度只反映了颗粒的一个方面,LDL的其他特征特别是颗粒大小和密度,也可能是导致心脑血管疾病的风险。此外,LDL亚类与AIS亚型之间的关系尚未完全阐明。研究证实,sdLDL比LDL-C更能预测心血管疾病,sdLDL也被认为是缺血性心脏病的一个独立的危险因素,但sdLDL与AIS间的关系尚不十分明确[17-19]。Zafar等[20]研究证实,sdLDLA因颗粒较小、更易氧化、对LDL受体的亲和力低及更容易进入动脉壁等特点,具有更强的动脉粥样硬化形成潜力。这些过程有助于加速动脉粥样硬化斑块的形成,并且至少可以部分解释LDL颗粒大小和密度与心脑血管风险之间的关系。本次研究中一个主要限制是收集使用的血浆检测前均储存在-80 ℃的环境中,然而也有研究表明使用新鲜与冷冻血浆用于sdLDL-C测定的结果几乎相同[21]。本研究中LAA亚型的异常sdLDL发生率明显高于对照组,其他卒中分型亚组的异常sdLDL发生率与对照组无明显差异,且LAA亚型中血清sdLDL水平较对照组也显著增高,而其他卒中亚型同对照组比较却无明显差异。这均提示sdLDL和AIS之间存在相关性,且与LAA明确相关。也进一步证实了血清sdLDL最终通过导致脑血管动脉粥样硬化致病。AIS组及对照组TG、LDL及TC水平差异无统计学意义,表明仅测量常规血脂水平可能不足以准确评估AIS风险,血清sdLDL比传统的LDL-C可能更加敏感的预测卒中发病风险以及其预后。
Sakai等[22]证实,sdLDL-C是一种比LDL-C更有效的心血管事件二级生物标志物,其与心血管事件的发生及预后有明显的相关性。有研究表明,无论基线LDL-C和其他脂质参数水平如何,他汀类药物对sdLDL都具有很强的降低作用,能降低卒中的发生率[23]。本研究显示,预后不良组血清异常sdLDL比例更高,sdLDL异常亚组出院90 d mRS、90 d NIHSS平均评分均明显高于sdLDL正常亚组,表明血清sdLDL与AIS患者临床预后呈正相关。通过纳入传统危险因素行多因素Logistic回归分析也显示,男性患者、冠心病患者及血清sdLDL是影响AIS预后的危险因素。表明血清sdLDL可能是除传统危险因素外,导致AIS患者预后不良的又一个独立危险因素,其对卒中的发生及预后的影响需要引起重视。今后需要多中心的、大型的前瞻性研究,以进一步明确相关结论。

