去除型人皮肤成纤维饲细胞系的建立及其重建角膜表层的研究△
黎颖莉 Tomoyuki-Inoue Fumihiko-Takamatsu Naoyuki-Maeda Yuichi-Ohashi Kohji-Nishida
角膜缘干细胞和口腔黏膜上皮细胞已被成功用于眼表再生医学治疗严重眼表疾病[1-4]。目前,眼表重建研究多使用角膜缘干细胞在3T3饲细胞层上培养形成复层上皮后进行移植。然而,治疗中使用的小鼠3T3成纤维细胞具有给患者传染鼠类疾病的风险。最近有研究表明[5-6],人类胚胎干细胞与小鼠饲细胞共培养后表达小鼠异种抗原Neu5Gc,并能诱发自身免疫反应。因此,需要寻找一种安全有效的人来源的饲细胞替代小鼠3T3细胞。有研究表明,人类皮肤成纤维细胞具有维持角膜缘干细胞和口腔黏膜上皮的干细胞生长及保持上皮细胞生物特性的能力,是一种有望成为替代小鼠3T3细胞的饲细胞[7-8]。然而,在体外培养的正常人类皮肤成纤维细胞的有限增殖能力增加了工作量和生产成本,阻碍了人皮肤成纤维细胞作为饲养层细胞在临床上的应用。此外,饲养层细胞很容易混杂到细胞片成品中,造成再生细胞片污染。我们曾创建过一种可去除的饲细胞培养细胞片的方法[9],并通过研究表明这种方法通过转基因技术创建出了永生化、可标记、可去除的饲细胞。在本研究中,我们的目标是通过转基因手段创建一支永生化、可标记、可去除的人源性饲细胞。
1 材料与方法
1.1 材料丝裂霉素C(mitomycin C,MMC;Kyowa Hakko,Tokyo,日本);I型胶原凝胶(Collagen Gel Culturing Kit,Nitta Gelatin,Osaka,日本);Dispase溶液(BD Biosciences,Bedford,MA,美国);EDTA溶液(Nacalai Tesque,Kyoto,日本);三碘甲状腺原氨酸 (Takeda,Osaka,日本);氢化可的松(Kowa,Tokyo,日本);罗丹明B (Wako,Osaka,日本);anti-K3 (AE5)抗体 (1100;Progen Biotechnik,Heidelberg,德国),霍乱毒素(Calbiochem,La Jolla,美国);anti-K12抗体 (1100,Santa Cruz Biotechnology,Santa Cruz,美国)和anti-P63 (4A4) 抗体(1100,Santa Cruz,美国);Zeiss 荧光显微镜 (Axiovert 200M,Carl Zeiss Jena Gmbh,德国);Applied Biosystems 7900 HT(Applied Biosystems,Foster City,美国)。ΔNp63 (Hs00978339_m1)、K3(Hs00365080_m1)、GAPDH (Hs99999905_m1)序列均购买于Applied Biosystems公司(美国)。
1.2 方法
1.2.1 创建转基因人皮肤成纤维饲细胞参考文献[9],利用Gateway技术构建慢病毒载体。复制缺陷型、自失活的含磷酸甘油酸激酶(PGK)启动子的新霉素抗性基因(pLentiNeo)或含PGK启动子的嘌呤霉素抗性基因(pLentiPuro) 的慢病毒载体为目的载体。将人源端粒酶逆转录酶(TERT)、内部核糖体进入位点(internal ribosome entry site,IRES)和增强型绿色荧光蛋白(EGFP)克隆到pENTR1A载体生成pENTR-TERT-IRES-EGFP载体;单纯疱疹病毒胸苷激酶(HSV-TK)克隆到pENTR1A载体,生成pENTR-TK载体。转入载体(pENTR-TERT-IRES-EGFP 或 pENTR-TK)和目的载体(pLentiNeo或pLentiPuro) 通过LR反应生成慢病毒表达载体pLenti-TERT-IRES-EGFP-Neo或pLenti-TK-Puro。这些表达载体与pLP/VSVG(编码VSV-G包膜蛋白)和包装构造pLP1、pLP2都被转染到293T细胞用于生成目的慢病毒。浓缩的目的慢病毒用来感染人皮肤成纤维细胞。
TERT+EGFP+TK转染的人皮肤成纤维细胞通过两个步骤创建。首先,将正常人皮肤成纤维细胞(KF-4009)感染pLenti-TERT-IRES-EGFP-Neo慢病毒,通过800 g·L-1G418药物筛选,生成TERT+EGFP转染的人皮肤成纤维细胞。接着将TERT+EGFP转染的人皮肤成纤维细胞感染pLenti-TK-Puro慢病毒,通过1 g· L-1嘌呤霉素药物筛选,生成TERT+EGFP+TK转染的人皮肤成纤维细胞(TERT+TK-D)。创建的TERT+TK-D细胞置于含10 g·L-1青霉素-链霉素的Fibrolife S2细胞培养液中常规培养。
1.2.2 更昔洛韦的细胞毒性检测将TERT+TK-D细胞按每孔5000 个细胞接种于96孔培养板中,培养24 h后,分为四组,分别加入含0 g· L-1、 5 g· L-1、25 g· L-1、125 g· L-1更昔洛韦的培养液,置于含体积分数5%CO2、37 ℃培养箱中培养 1~6 d。每24 h用CCK-8法检测一次细胞活性。与平行不加细胞只加培养液孔设为空白对照,最后比色以空白组调零;未用药物处理的细胞孔为阴性对照。更昔洛韦的细胞毒作用通过细胞存活的百分比表示。
1.2.3 饲细胞层的制备TERT+TK-D细胞和3T3细胞分别用加入8 g· L-1MMC的培养基在37 ℃培养2 h。吸去MMC培养基,PBS洗3次,胰蛋白酶消化后,按5000个·cm-2TERT+TK-D细胞或20×103个·cm-23T3细胞密度将饲细胞接种入6孔细胞培养板和铺有I型胶原凝胶的Transwell小室作为饲细胞层。
1.2.4 角膜缘干细胞的分离与培养本研究采用的角膜均来自Northwest Lions Eye Bank (Seattle,WA)。角膜移植后剩余的角膜组织片撕去内皮层后用2400 U·L-1Dispase溶液37 ℃水浴消化 1 h,再用0.2 g· L-1EDTA溶液在室温下孵育2 min。用无菌手术镊沿着角膜缘将上皮细胞刮下,收集的细胞用2.5 g· L-1胰蛋白酶-乙二胺四乙酸(EDTA)在 37 ℃ 孵育15 min。然后加入改良的角化细胞培养基(keratinocyte culture medium,KCM)制成上皮细胞悬液,用于克隆形成率计算和角膜上皮再生细胞片培养的研究。改良的KCM中主要成分:DMEM培养基和Ham’s F12培养基(DMEMF12为 31),体积分数5%胎牛血清(FBS),1 nmol·L-1霍乱毒素,2 nmol·L-1三碘甲状腺原氨酸,0.4 g· L-1氢化可的松,10 g·L-1胰岛素-转铁蛋白-硒添加剂,100×103U·L-1青霉素,100 g· L-1链霉素。
1.2.5 克隆形成率实验将原代角膜缘干细胞按照每孔1000个的密度接种于覆盖有TERT+TK-D或者 3T3 饲细胞层的6孔板,共培养10~13 d。终止培养后,用体积分数10%中性福尔马林固定,10 g· L-1罗丹明B染色。细胞克隆形成率(colony forming efficiency,CFE)=克隆数(克隆直径>2 mm)/接种活细胞数×100%。
1.2.6 角膜上皮再生细胞片的制备将原代角膜缘上皮细胞按每孔(100~200)×103个分别接种在含有饲细胞层的胶原凝胶涂层的Transwell小室。细胞在KCM中培养12 d后,置于含25 g· L-1更昔洛韦的KCM中降低液平面培养6~8 d,而非更昔洛韦处理对照组用不含更昔洛韦的KCM降低液平面培养。每2 d换液一次。
1.2.7 逆转录PCR及定量PCR按RNeasy Mini Kit (Qiagen,Valencia,CA)试剂盒使用说明书提取各组织和细胞的总RNA。采用1st Strand cDNA Synthesis System (Origene,Rockville,MD) 进行逆转录翻译,合成PCR所需的cDNA。PCR热循环条件为:94 ℃预变性5 min;94 ℃变性30 s,60 ℃延伸30 s,72 ℃延伸30 s,共35个循环;最后72 ℃延伸10 min。用20 g· L-1琼脂糖凝胶电泳鉴定PCR产物,紫外投射成像系统观察,凝胶图像分析软件分析目的基因的相对含量。各种基因引物序列如下:肝细胞生长因子(hepatocyte growth factor,HGF)上游引物:5’-GCCTGAAAGATATCCCGACA-3’,下游引物:5’-TTCCATGTTCTTGTCCCACA-3’;角质细胞生长因子2(KGF)上游引物:5’-AGGCTCAAGTTGCACCAGGCA-3’,下游引物:5’-TGTGTGTCGCTCAGGGCTGGA-3’;表皮调节素(epiregulin,EPR)上游引物:5’-AGGAGGATGGAGATGCTCTG-3’,下游引物:5’-TCAGACTTGCGGCAACTCTG-3’;脑源性神经营养因子(BDNF)上游引物:5’-AACAATAAGGACGCAGACTT-3’,下游引物:5’-TGCAGTCTTTTTGTCTGCCG-3’;碱性成纤维细胞生长因子2(bFGF)上游引物:5’-AAGAGCGACCCTCACATCAAGCTA-3’,下游引物:5’-TACTGCCCAGTTCGTTTCAGTGC-3’;神经型钙黏蛋白(neural-cadherin,N-cad)上游引物:5’-CACCCAACATGTTTACAATCAACAATGAGAC-3’,下游引物:5’-CTGCAGCAACAGTAAGGACAAACATCCTATT-3’;GAPDH上游引物:5’-TCCAGAACATCATCCCTGCCTCTA-3’,下游引物:5’-TGTTGAAGTCAGAGGAGACCACCTG-3’。各种基因的表达均使用GAPDH作为内参进行标准化。定量PCR使用Taqman 荧光定量PCR方法,采用Applied Biosystems 7900 HT序列检测仪进行检测、分析。反应条件为:95 ℃预变性10 s;95 ℃变性15 s,60 ℃退火延伸1 min,共45个循环。量化数据用GAPDH作为内参标准化后,用序列检测系统软件(Applied Biosystems)进行分析。最后的结果取3次实验数据的平均值。
1.2.8 PCR检测饲细胞残留实验按QIAamp DNA Mini Kit (Qiagen,Valencia,CA)试剂盒使用说明,将更昔洛韦添加组和更昔洛韦未添加组与TERT+TK-D饲细胞共培养的角膜上皮细胞片组织DNA提取。长末端重复序列(long terminal repeat,LTR)是慢病毒载体的特异序列,通过慢病毒转染人皮肤成纤维细胞时整合到TERT+TK-D细胞基因中。按照之前所述PCR条件,使用LTR特异性引物:上游引物:5’-AAGGGCTAATTCACTCCCAA-3’,下游引物:5’-TGCGTCGAGAGAGCTCTGGTTT-3’;以GAPDH作为阳性对照对提取的细胞片DNA进行检测。
1.2.9 免疫荧光组织化学染色收获的上皮细胞片用Tissue-Tek OCT包埋,用于HE染色和免疫荧光组织化学染色。HE染色按照常规方法进行,免疫荧光组织化学染色按照以下方法进行:切片用40 g· L-1多聚甲醛在4 ℃下固定30 min,40 g· L-1脱脂牛奶PBS溶液(含体积分数0.3%Triton X-100)室温1 h封闭非特异结合,之后加入一抗:anti-K3(AE5)抗体 (1100)[10]、anti-K12抗体 (1100)[11]和anti-P63(4A4)抗体(1100)[12],4 ℃孵育过夜。之后用PBS洗3遍×5 min,加入相应的二抗常温孵育1 h。再用PBS洗3遍×5 min,加DAPI染细胞核,Zeiss 荧光显微镜下观察。切片加入相同浓度非特异性抗体作为阴性对照。
1.3 统计学方法本研究中所有数据均采用SPSS 16.0统计分析软件进行处理。采用独立样本t检验对数据进行分析。检验水准:α=0.05。
2 结果
2.1 人皮肤成纤维细胞基因表达特征人皮肤成纤维细胞基因表达与角膜基质成纤维细胞相似(图1),两者均表达HGF、KGF、EPR、BDNF、bFGF和N-cad。
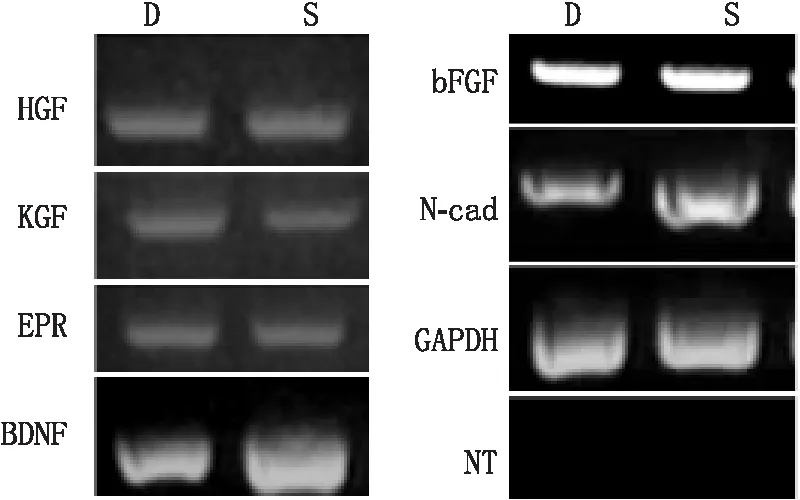
图1 体外培养的人皮肤成纤维细胞与角膜基质成纤维细胞基因表型特征 D:人皮肤成纤维细胞;S:角膜基质成纤维细胞;NT:阴性对照(没有逆转录酶)
2.2 TERT+TK-D饲细胞生物学特性将增强型绿色荧光蛋白(EGFP)、端粒酶逆转录酶(hTERT)和单纯疱疹病毒胸苷激酶(HSV-TK)导入人皮肤成纤维细胞,创建出TERT+TK-D人源饲细胞系。将TERT+TK-D饲细胞在体外连续传代6个月(>50代)仍然保持原代人皮肤成纤维细胞形态(图2A),并且在紫外灯光照射下显示绿色荧光(图2B),并且保持更昔洛韦药物致死性(图2C)。RT-PCR检测结果显示,TK基因和LTR序列在TERT+TK-D细胞中表达,而在正常人成纤维细胞中不表达(图2D)。经过长时间传代后的TERT+TK-D细胞仍保持旺盛的分裂能力(图2E)。细胞毒性实验结果显示,更昔洛韦对TERT+TK-D细胞的毒性作用呈剂量依赖性,随着更昔洛韦剂量的加大,细胞毒作用增强。25 g·L-1更昔洛韦组几乎所有的细胞在6 d内都凋亡了(图2F)。

图2 TERT+TK-D细胞的特性 A:TERT+TK-D细胞与人皮肤成纤维细胞形态一样;B:TERT+TK-D细胞在紫外光照射下显示绿色荧光;C:TERT+TK-D细胞在25 g·L-1 更昔洛韦作用下6 d内全部凋亡;D:TERT+TK-D细胞表达TK基因、LTR序列,而正常人皮肤成纤维细胞不表达;E:TERT+TK-D细胞生长曲线;F:更昔洛韦药物毒性实验显示,TERT+TK-D细胞最小更昔洛韦致死剂量为25 g·L-1
2.3 细胞CFE和特征实验分为3组:20×103个·cm-23T3组(经典密度)、5×103个·cm-23T3组和5×103个·cm-2TERT+TK-D细胞组。共培养10~13 d,所有组均形成了典型的角膜缘干细胞克隆,TERT+TK-D组CFE为(11.77±0.21)%,与同密度3T3组CFE (5.7%±0.89%)相比形成更多典型克隆(P<0.001),与经典密度3T3组相比,CFE差异无统计学意义(P=0.332)。TERT+TK-D细胞组(直径>2 mm; CFE为3.37%±0.35%)比同密度3T3组(直径>2 mm,CFE为1.30%±0.26%)和经典密度3T3细胞组(直径>2 mm, CFE为 2.07%±0.06%)有更多面积大、细胞数多的克隆形成(P=0.01、0.03)。免疫荧光染色结果显示:TERT+TK-D组和3T3组细胞均表达K3 和ΔNp63(图3A、B),然而TERT+TK-D组K3阳性表达低于3T3组。Real-time PCR结果证实了免疫荧光染色的结果:3T3组K3表达高于TERT+TK-D组(P=0.001),而两组ΔNp63表达差异无统计学意义(P=0.982)。
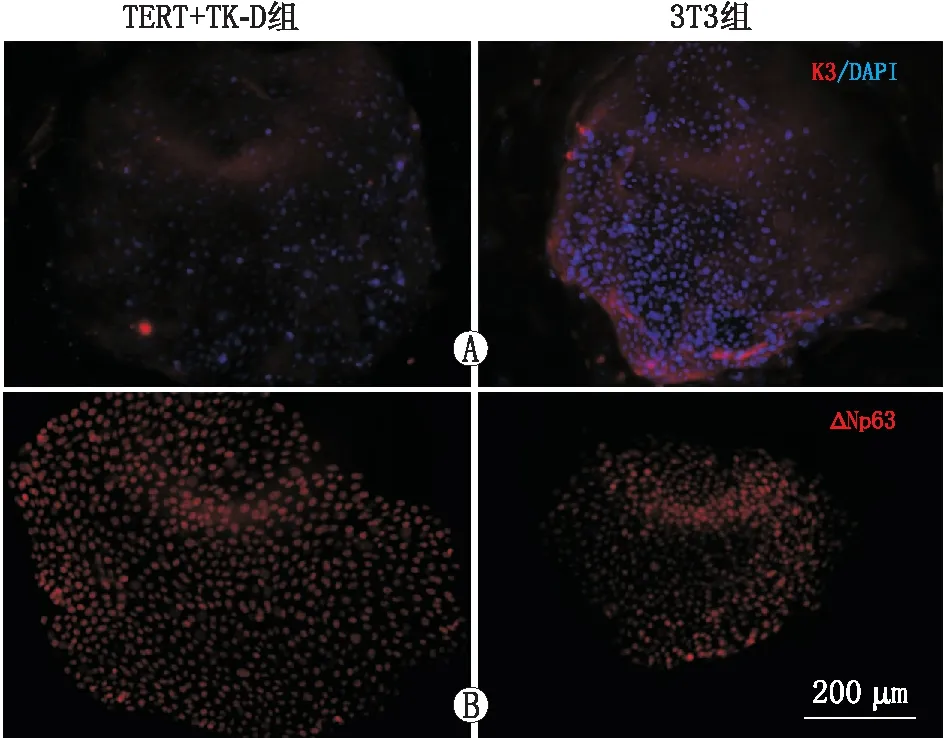
图3 角膜缘干细胞克隆特征 A:TERT+TK-D组与3T3组相比,共培养的角膜上皮细胞较低表达角膜上皮分化标记物K3;B:两组表达角膜缘干细胞标记物ΔNp63无显著差异
2.4 PCR检测饲细胞残留实验按之前所述方法将更昔洛韦添加组和更昔洛韦未添加组培养获得的细胞片的组织和细胞DNA提取,用PCR检测细胞片中慢病毒特异LTR序列的表达。两组细胞片均表达内参GAPDH基因,但是LTR序列只表达于更昔洛韦未添加组。在更昔洛韦添加组,LTR序列不表达(图4)。

图4 PCR方法检测角膜上皮再生细胞片中慢病毒特异LTR序列 GAPDH基因为阳性参照。LTR特异序列在更昔洛韦未添加组显示阳性,而在更昔洛韦添加组未检测到
2.5 培养的角膜缘上皮再生细胞片的特性角膜缘干细胞与TERT+TK-D或3T3细胞共培养形成角膜上皮再生细胞片,这些细胞在KCM培养12 d后,在添加25 g·L-1更昔洛韦 的KCM中降低液平面培养6~8 d促进上皮复层化。经过2~3周共培养,两组都形成了4~5层复层上皮细胞片(图5)。25 g·L-1更昔洛韦对于角膜缘上皮细胞和3T3饲细胞没有毒副作用,而TERT+TK-D饲细胞在添加25 g·L-1更昔洛韦 的KCM中6 d后全部凋亡。细胞片切片免疫荧光染色显示,两组细胞片均表达角膜上皮细胞分化标记K3、角膜缘干细胞标记物ΔNp63以及角膜上皮细胞特异性标记物K12(图5)。与3T3组相比,TERT+TK-D组形成的细胞片较低表达K3,而在基底和翼细胞层较高表达ΔNp63;K12表达两组无明显差异。

图5 角膜上皮再生细胞片的特征 A:经过2~3周的共培养,TERT+TK-D组和3T3组均形成了4~5层复层角膜上皮细胞片;B:与3T3组相比,TERT+TK-D组角膜上皮细胞片较低表达角膜上皮分化标记物K3;C:基底细胞和翼细胞中高表达干细胞标记物ΔNp63;D:角膜上皮细胞特异性标记物K12表达在两组无明显差异
3 讨论
本研究结果证实,转基因、永生化、荧光标记的可去除型人表皮成纤维细胞具有维持角膜缘干细胞生长、分化的能力,同时还可以防止饲细胞污染形成的再生细胞片。为了避免使用动物来源的饲细胞,人源性饲细胞,如骨髓间充质干细胞[13-14]、角膜基质成纤维细胞[15-16]和皮肤成纤维细胞[17],被广泛用于替代3T3成纤维细胞应用于临床。Oie等[7]研究发现,人表皮成纤维细胞在口腔黏膜上皮细胞表面重建中取得良好效果;Sharma等[8]比较了人皮肤成纤维细胞、骨髓间充质干细胞和3T3细胞在体外分别与人角膜缘干细胞和口腔黏膜细胞共培养,发现人皮肤成纤维细胞优于骨髓间充质干细胞,与3T3细胞可以媲美。我们的实验也证实,人皮肤成纤维细胞与角膜基质成纤维细胞许多细胞因子表达相似,都表达HGF[18]、KGF[18]、 EPR[19]、 BDNF[20]、 bFGF[21]和N-cad[22]。我们的预实验也显示,角膜缘干细胞与人皮肤成纤维细胞共培养组的CFE高于与角膜基质成纤维细胞共培养组的CFE。因此,人皮肤成纤维细胞有着替代3T3细胞用于临床的广泛前景。
我们将hTERT基因[23]转导入人皮肤成纤维细胞以防止细胞多次分裂后衰老。目前研究表明,永生化人皮肤成纤维细胞在体外连续传代超过6个月,大于50代,仍保持旺盛的分裂能力,荧光可视,并且对更昔洛韦药物敏感。赋予细胞永生化后,可以大大简化细胞的保存与使用流程,降低了原代培养成本,减少了重复使用慢病毒的风险。TK基因也导入hTERT和EGFP转染的真皮成纤维细胞[24],以防止未知的感染和异种饲细胞污染。我们通过PCR检测LTR序列的实验发现,更昔洛韦处理的与TERT+TK-D饲细胞共培养的细胞片没有受到饲细胞污染,而没有经过更昔洛韦处理的同样条件培养的细胞片却检测到残留的TERT+TK-D饲细胞LTR序列基因。可去除型饲细胞可以灵活、方便地应用于各种需要饲细胞接触培养或者混合培养的情况。此外,饲养细胞可去除的特性也降低了转染外源基因产生的未知风险,增加使用转基因细胞的安全性。
Sharma等[8]比较了人皮肤成纤维细胞与3T3细胞对角膜缘干细胞增殖的作用,发现CFE和角膜缘干细胞标记物的表达两组细胞作用相似,实验证实TERT、EGFP、TK基因转导的人皮肤成纤维细胞保持了纤维细胞形态和旺盛的分裂增殖力,与正常人皮肤成纤维细胞一样具有支持角膜缘干细胞生长的特性。本研究中TERT+TK-D组和3T3组均形成了4~5层复层上皮角膜上皮再生细胞片。角膜缘干细胞的CFE在TERT+TK-D组和经典密度3T3组没有显著差异。值得注意的是,TERT+TK-D组形成了更多面积大(直径>2 mm)的克隆,并且比同密度3T3组的CFE高。此外,免疫组织化学染色和Real-Time PCR结果显示,TERT+TK-D组与3T3组相比低表达角膜上皮分化标记K3,并且更好地维持了角膜上皮层细胞的未分化状态。
Bullock等[25]用人皮肤成纤维细胞成功培养出无动物源性成分人皮肤角质形成细胞。Rodriguez-Piza等[26]在无动物源性成分培养体系下成功分离出原代培养的人皮肤成纤维细胞,结果显示这些细胞既能诱导出多能干细胞,又能作为饲细胞支持多能干细胞的生长。在目前的研究中,我们主要关注创建TERT+TK-D细胞,研究创建的细胞生物学特性和饲细胞作用,结果显示,创建的人皮肤成纤维饲细胞保持了原细胞的生物学特性,具有支持角膜缘干细胞生长的能力,同时变得使用更方便、经济和安全。进一步的研究将在无动物源性成分培养体系下,用人源性成分取代目前常用的动物源性成分,如用人血清替代胎牛血清[27]等。同时,将创建的人皮肤成纤维饲细胞广泛应用于其他再生医疗研究,比如与口腔上皮细胞共培养等。
综上所述,通过转基因手段创建了永生化可去除型人皮肤成纤维饲细胞,并且证实了该细胞安全有效。研究结果表明,转基因人皮肤成纤维饲细胞在角膜再生医疗方面将有着广阔的应用前景。

