a-1, 2岩藻糖基转移酶II在肺鳞癌组织中的表达及对肺鳞癌细胞增殖的影响
王维杰,范赛荣,张光辉,孙海婷,施国富,马璇,朱成楚
(1.温州医科大学附属象山医院 胸外科,浙江 宁波 315700;2.温州医科大学 检验医学院 生命科学学院,浙江 温州 325035;3.温州医科大学附属台州医院 胸外科,浙江 台州 317000)
肺鳞状细胞癌是一种常见的非小细胞肺癌(non-small-cell carcinoma,NSCLC)亚型,每年全球约有30多万人受累[1]。目前,对于肺鳞癌的治疗,以外科手术切除为主,对于不能手术的疾病只能采取细胞毒性化疗和免疫治疗[2]。然而,由于目前缺乏较为特异的早期诊断标志物,大多数患者被发现时已处于临床晚期[3],而错过了最佳治疗期。因此,寻找肺鳞癌特异的早期诊断标志物,显得尤为重要。据报道,a-1,2岩藻糖基转移酶II(a-1,2 fucosyltransferase II,FUT2)可以通过a-1,2糖苷键将岩藻糖基转移到N-乙酰氨基的末端半乳糖上,其在多种肿瘤中均呈现高表达,是肿瘤发生的早期标志物之一[4-5]。然而,关于FUT2在肺鳞癌患者中的差异表达及其对肺鳞癌细胞增殖的影响目前尚未见报道。因此,本研究主要通过生物信息数据分析和FUT2低表达细胞模型来探究FUT2在肺鳞癌中的表达情况,及其对肺鳞癌细胞增殖的影响。
1 材料和方法
1.1 材料
1.1.1 细胞与质粒载体:肺鳞癌细胞H226购自美国菌种保藏中心(American Type Culture Collection,ATCC)细胞库。FUT2的低表达质粒载体psi-U6.1/eGFP/Puro-FUT2(shFUT2)及其对照载体psi-U6.1/eGFP/Puro-NC由美国GeneCopoeia公司设计构建并经测序验证。
1.1.2 试剂:胎牛血清购自美国Hyclone公司,RPMI 1640培养基购自美国Gibco公司,细胞转染试剂Lipofectamine 2000购自美国Invitrogen公司,青霉素-链霉素溶液(×100)、胰酶细胞消化液、BCA蛋白质定量试剂盒、β-actin小鼠单克隆抗体、辣根过氧化物酶标记羊抗兔IgG及鼠IgG均购自上海碧云天生物技术研究所,CCK-8试剂购自日本Dojindo同仁化学研究所,FUT2、Bcl-2、Bax兔单克隆抗体购自美国Abcam公司,PCNA兔单克隆抗体购自美国Cell Signaling Technology公司。
1.2 方法
1.2.1 差异性分析:UALCAN数据库(http://ualcan.path.uab.edu/analysis.html)是根据TCGA临床患者数据,对原发肿瘤样本进行分类,并绘制不同亚组各基因表达水平的数据图,包括临床分期、性别、年龄、组别[6]。应用该数据库分析FUT2在肺鳞癌组织和正常癌旁组织中的表达差异,及FUT2与肺鳞癌患者的临床分期、性别、年龄的相关性。
1.2.2 细胞培养:用含1%青霉素-链霉素、10%胎牛血清及89% RPMI 1640培养基的体系,在37 ℃、5% CO2、95%湿度的培养箱中培养H226肺鳞癌细胞株。实验分组为:NC组(空载体对照组)及shFUT2组(FUT2低表达组)。
1.2.3 细胞瞬时转染:提前于6孔板铺适量H226细胞悬液,待其生长密度达到75%时,进行细胞转染操作,将RPMI 1640培养基与LIPO 2000按照每孔125 μL:5 μL的比例配制转染A液,将RPMI 1640培养基与相应质粒DNA按照每孔125 μL:2500 ng的比例配制转染B液,将A、B液混合室温孵育15 min后以250 μL/孔逐滴加入待转染细胞孔中继续培养48h。
1.2.4 CCK-8实验:将对数期细胞调整成8×105个/mL,接种于96孔板进行正常培养,分别于24 h、48 h及72 h在实验孔以10 μL/孔加入CCK-8试剂,继续培养2 h后,上机检测450 nm处各孔吸光度。
1.2.5 平板克隆实验:细胞以300个/孔接种于6孔板,置于培养箱中培养,待培养皿中出现肉眼可见的细胞克隆团后,用900 μL 4%多聚甲醛固定细胞30 min,结晶紫染20 min,洗去染色液,拍照记录实验结果。
1.2.6 Western blot法:应用BCA试剂检测提取的H226细胞总蛋白浓度,并用5×Loading Buffer及细胞裂解液将样本蛋白浓度均调整为1 μg/μL,随后于金属加热仪100 ℃加热10 min变性得到实验所需样本,随后配至Tris-甘氨酸SDS聚丙烯酰胺凝胶电泳分离胶和浓缩胶、上样、转膜、5%的脱脂牛奶封闭、TBST洗涤、4 ℃一抗孵育过夜、TBST洗涤、孵育相应二抗1 h、TBST洗涤、ECL化学发光检测,最后采用Image Lab图像分析软件进行各组蛋白表达的灰度分析。
1.3 统计学处理方法 应用SPSS17.0统计软件对数据进行统计学分析。计量资料以±s表示,2组间比较采用t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 FUT2在肺鳞癌组织中的表达 UALCAN数据库分析结果显示:与癌旁正常组织(Normal)组相比,FUT2基因在肺鳞癌组织(Primary tumor)中呈现明显高表达趋势,且主要集中表达在stage1、stage2、stage3期(P<0.05),而stage4与Normal组比差异无统计学意义(P>0.05)。在引入年龄因素的情况下,与Normal组相比,FUT2在肺鳞癌患者的41~100岁年龄段中呈现高表达趋势,但是各年龄组之间差异无统计学意义(P>0.05)。此外,不同性别肺鳞癌患者之间FUT2表达量差异无统计学意义(P>0.05)。见图1。
2.2 FUT2低表达细胞模型的鉴定 为进一步在细胞水平验证FUT2对肺鳞癌的影响,我们通过瞬时转染技术构建敲减FUT2的H226细胞模型,通过Western blot实验验证其低表达效果,结果显示,与NC组相比,shFUT2组的FUT2蛋白表达水平明显降低(3.26±0.16vs.1.87±0.28),差异有统计学意义(P<0.01),可以应用于后续实验。
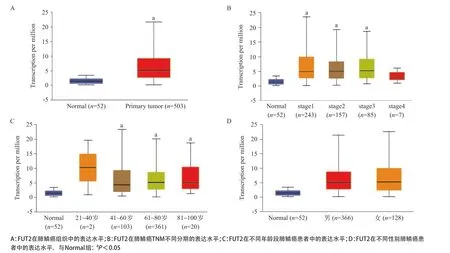
图1 应用UALCAN数据库分析FUT2在肺鳞癌患者中的差异性表达
2.3 FUT2低表达可以抑制H226细胞的增殖 采用CCK-8实验连续监测3 d的细胞生长速率,结果显示,与NC组比,shFUT2组的细胞增殖率在48 h和72 h均受到明显抑制,差异有统计学意义(P<0.05)。在平板克隆形成实验及Western blot实验中,敲减FUT2的表达后,单克隆细胞团的形成数及细胞增殖因子PCNA蛋白的表达(1.39±0.07vs.1.05±0.17)均明显下调,差异有统计学意义(P<0.01),见图2。
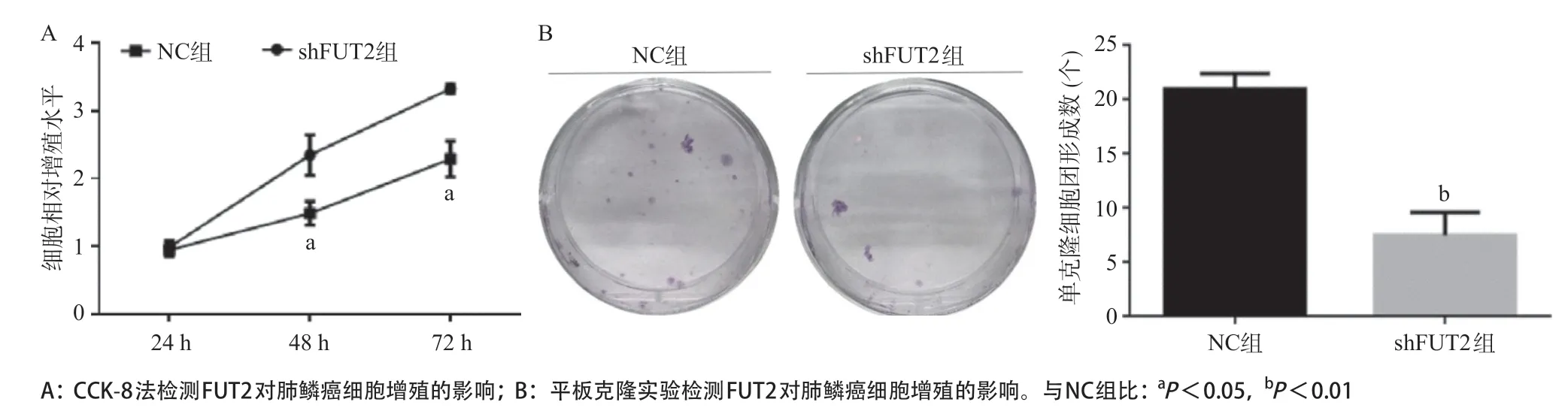
图2 FUT2对肺鳞癌细胞增殖的影响
2.4 FUT2对H226细胞凋亡相关因子的影响 与NC组相比,FUT2低表达后,细胞凋亡负调因子Bcl-2蛋白表达水平受到明显抑制(2.10±0.04vs.1.20±0.26,P<0.01),同时,又促进了凋亡正调因子Bax蛋白的表达,差异有统计学意义(0.89±0.30vs.1.65±0.51,P<0.05)。
3 讨论
岩藻糖基化是一种重要的蛋白质翻译后修饰类型,被认为是肿瘤发生发展的普遍标志[3,7-8]。在肿瘤细胞中常常表现出岩藻糖基化的增加,这一改变,极大地影响了肿瘤细胞与细胞的黏附、细胞与基质的相互作用、细胞信号传递、代谢、血管生成和免疫调节,最终导致肿瘤的进展和转移[7,9]。岩藻糖基化修饰异常的基础是岩藻糖基转移酶的异常改变,而FUT2是岩藻糖基转移酶家族成员之一。近年来,对肿瘤细胞的岩藻糖基化修饰的研究越来越多。有研究报道,岩藻糖基转移酶可以促进肺腺癌的发生发展,其基因亦可能作为循环标志物被应用于肺癌的早期检测诊断[10-11]。但是,关于FUT2对肺鳞癌影响的研究目前尚未见报道。
本研究借助生物信息学数据和FUT2低表达细胞模型,探究了FUT2在肺鳞癌患者中的差异表达及其对肺鳞癌细胞增殖和凋亡的影响,结果表明FUT2在肺鳞癌患者中呈现明显的高表达趋势,并且主要在肺鳞癌TNM分期的Stage1、Stage2和Stage3高表达,而其与年龄和性别无关。此外,平板克隆实验、CCK-8实验及对经典的增殖因子PCNA蛋白表达水平的检测,均证明了敲减FUT2的表达后,明显抑制了H226细胞株的增殖能力。Bcl-2是一种抗凋亡蛋白,其主要功能是抑制细胞凋亡,并通过阻滞细胞周期的G0/G1期来延长细胞的存活[12-13]。当Bcl-2与凋亡正调因子Bax的表达水平失衡,会引起线粒体功能发生紊乱,从而诱导细胞凋亡[14]。本研究发现,敲减FUT2能明显抑制抗凋亡蛋白Bcl-2的表达,相反地,促进了促凋亡蛋白Bax的表达水平,说明低表达FUT2可以促进肺鳞癌细胞的凋亡能力,但仍需要继续进行明确及验证。
综上所述,FUT2在肺鳞癌患者中显著高表达,并且经过进一步对临床分期的数据分析发现:FUT2与肺鳞癌TNM分期的Stage1、Stage2和Stage3期均有关联,而其与TNM分期的Stage4期及患者年龄、性别并无明显关联。由此表明FUT2可能影响着肺鳞癌疾病的发生发展,且主要发生在其早中期。细胞水平实验结果表明,FUT2可能通过上调增殖因子PCNA蛋白的表达从而促进肺鳞癌细胞的增殖,同时,可以抑制肺鳞癌细胞的凋亡能力进而促进肺鳞癌细胞的生长。但具体影响和机制如何,有待于后续进一步更深层次地探究和论证。

