新生儿先天性梨状窝瘘2例救治体会
吴诗媛,项海杰,陈波蓓
(温州医科大学附属第二医院育英儿童医院 耳鼻咽喉科,浙江 温州 325027)
先天性梨状窝瘘(congenital pyriform sinus fistula,CPSF)是一种罕见的先天性畸形,为起源于第三或第四鳃囊,发生于咽部梨状窝的鳃源性内瘘[1]。CPSF常表现为复发性颈部脓肿或囊肿,颈部蜂窝织炎,急性化脓性甲状腺炎等典型症状。然而,在新生儿中喉鸣及呼吸困难是其常见的表现,这和年龄较大的儿童不同[2]。本文报道了2例温州医科大学附属第二医院育英儿童医院耳鼻咽喉科收治的CPSF合并呼吸困难的患儿。现报告如下。
1 临床病例
例1:患儿,男,40 d,因“出生后发现颈部肿块1个月余,气促10 d余”来我院就诊。患儿出生后发现左侧颈部肿块,当时未予重视,后肿块逐渐增大,并出现阵发性咳嗽,伴气促、喉鸣,伴发绀。入院查体:三凹征(+),左侧颈部可及一5 cm×6 cm大小肿块,质中,两肺呼吸音粗,对称,可闻及呼吸相干啰音,未闻及湿啰音。辅助检查:胎儿超声示胎儿颈部囊性包块(约24 mm×9 mm)。颈部超声示左侧颈部囊性包块(约58 mm×37 mm×54 mm)。颈部增强CT示左侧颈部囊性占位,向咽旁、颈前间隙蔓延,左颈总动脉、颈静脉受压向外后移位,左侧甲状腺、气管及食道向右前方推压改变,病灶大小约50 mm×44 mm,病灶上至悬雍垂水平,下至左锁骨上窝水平,囊壁稍厚,边缘粗糙,增强扫描囊内未见强化,舌骨平面气道变窄。予行颈部囊肿切除术,术中暴露梨状窝处瘘管口,沿瘘口处注入少许美蓝,追踪囊壁根部位于左侧梨状窝处,显露并保护左侧喉返神经,翻起左侧甲状软骨板,显露内瘘口处并缝合。术后病理结果示鳃裂囊肿伴肉芽组织增生。见图1。
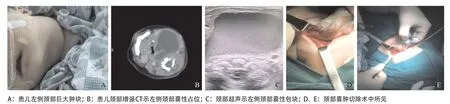
图1 例1患儿辅助检查及术中所见
例2:患儿,男,5 d,因“呼吸费力2 d”入院。患者2 d前出现呼吸费力,无发绀,无喘鸣,伴颈部肿块进行性增大,于外院行气管插管、机械通气等治疗后转至我院,于外科颈部肿物穿刺后撤呼吸机,呼吸仍费力。入院查体:左侧颈部可及一约3 cm×3 cm肿块,三凹征(+),双肺呼吸音粗,可闻及吸气性喉鸣音。辅助检查:颈部超声示左侧颈部混合回声团(40 mm×25 mm)。颈部CT示甲状腺左侧(梨状窝-左侧锁骨上份层面)可见一范围约22 mm×15 mm团块状低密度阴影,边界欠清,其内可见引流管影,内可见少许积气密度影,甲状腺左叶及气管受压变形移位。喉镜示咽后隆起,左侧劈裂水肿,梨状窝暴露欠佳,会厌抬举欠佳,声门暴露欠佳,左侧梨状窝可见亚甲蓝。予行左颈侧囊肿及瘘管切除术+气管瘘修补术。术中见颈侧囊性肿物,约2.5 cm×2.0 cm,质韧,见包块位于颈侧,斜向上走行,紧贴气管左侧侵及食管前方,其瘘管终于左侧梨状窝,肿物与周围软组织及甲状腺、气管粘连明显,第1、2、3气管环左侧发育缺陷,局部见气管瘘。术后病理结果示(左颈部性生物)先天性发育异常伴瘘管形成及周围大量急慢性炎细胞浸润,局部纤维组织内可见发育不良的甲状腺组织。
2 讨论
CPSF是一种罕见的先天性畸形,为起源于第三或第四鳃囊,发生于咽部梨状窝的鳃源性内瘘[1]。完全先天性第三和第四鳃瘘占所有鳃裂畸形的1%~10%[3]。目前为止,鳃裂畸形的病因并不完全确定,鳃沟与咽囊在胚胎发育中未完全闭合的理论被广泛接受[4]。由于在胚胎发育过程中第三或第四鳃囊未能在子宫内闭塞,第三鳃囊和第四鳃囊通过咽管与咽部相连,因此导致与梨状窝相通的窦道存在。窦道起源于梨状窝,因此称为梨状窝瘘。据统计表明90%发生于左侧,这可能与哺乳动物胚胎发育过程中第四鳃弓转变形成主动脉和无名动脉的不对称性或右侧消失较早有关[5]。大多数病变是单侧的,并且在大多数情况下没有家族史。
CPSF在出生时就可能被发现为左侧颈部囊性肿块,然而在大多数情况下会被诊断为颈部囊肿。若发现新生儿颈部囊性肿块在左侧,更应该首先怀疑CPSF[6]。因为婴儿吞咽唾液、配方奶粉或牛奶时肿块会迅速增大,导致气管压迫和呼吸窘迫,因此该病在新生儿中较为危险[2,7]。新生儿的气管软骨比大龄儿童更弱,更不结实,更容易因压力而变形,因此新生儿气管偏曲的发生率高于儿童[8]。本组2例患儿皆为CPSF,均因气管压迫出现呼吸窘迫及喉鸣音。由于CPSF导致危及生命的气道阻塞在新生儿中不常见,文献中只有少数病例报告[2,9-11]。因此,本次报告的病例似乎是CPSF的罕见表现。
CPSF的诊断和治疗是有挑战性的,经常会被误诊为淋巴管瘤、甲状腺囊肿、水囊瘤、食管囊肿等[12],尽早意识到这种疾病的可能可以避免延迟诊断以及反复感染。超声、CT、钡剂食管造影、MRI、喉镜有助于诊断。超声扫描常被用作儿童颈部肿块的筛查工具,显示与甲状腺左上极密切相关的炎症过程或囊肿,为诊断提供依据,超声显示该区域内有气体也被视为梨状窝瘘的特征。钡剂食管造影是一种成功率较高的方法,但在新生儿中的阳性率却低于大龄儿童,这可能因为在新生儿期为首次发作,在炎症期,瘘口被炎症或水肿阻塞,从而阻止了钡剂造影剂的渗透,从而导致假阴性结果[8]。当不能明确诊断时,可采用颈部CT或MRI扫描。CT/MRI显示一个巨大的充满空气和液体的囊肿,炎性和水肿的内孔或可阻止钡剂进入瘘管,但不能阻止空气,因此如果在梨状窝开口的囊肿或腔道内见到空气,扫描结果可定性为阳性[8]。MRI可能不能较好显示病变中的空气,CT扫描可较好显示瘘管的解剖路径和与甲状腺的关系,因此,在新生儿中,CT扫描具有较高的阳性率,是一种重要的影像学检查[8],建议新生儿患者行CT增强扫描,助于鉴别肿块性质。综上,CPSF的诊断具有一定难度,首先进行超声检查,辅以CT扫描,一旦感染的最初症状消失,喉镜及吞咽钡剂有助于确认是否存在瘘口及窦道。明确诊断就可以通过避免多发感染使手术更容易进行。最终精确的诊断需要手术探查结合组织学检查。
新生儿CPSF相对于年龄较大儿童的特点是瘘口宽,形成一个较大的囊肿,易造成呼吸窘迫[13]。本组2例患儿均因压迫呼吸道引起呼吸窘迫而就诊,其中例2的患儿曾在外院行气管插管、机械通气治疗。由于新生儿气管软骨较弱,囊肿较大,易造成气道阻塞,在行气管插管时应特别注意。例1患儿曾在气管插管麻醉过程中出现气道阻塞情况,导致氧饱和度降低。当时紧急予以囊肿穿刺抽吸,后情况好转,氧饱和度上升,插管过程顺利。因此此类患儿行气管插管等气道操作时应注意氧饱和度情况,如果出现紧急情况,应及时处理。
CPSF最初的治疗包括切开、引流脓肿和广谱抗生素,但若仅使用抗生素临时治疗,或切开引流或简单结扎而致病变复发时则应选择手术治疗[7,13]。手术术式有开放术式及内镜术式[14],本组2例患儿均采用开放术式。CPSF解剖结构复杂,走行与喉上神经、喉返神经、甲状腺等关系密切,手术时应仔细鉴别,避免造成声带麻痹、Horner综合征、咽瘘、伤口感染、颈部瘢痕畸形等并发症[14]。新生儿CPSF一般为初次发作,若为复发型,反复感染粘连及解剖结构复杂则更容易造成复发及并发症,手术时应追踪到梨状窝内瘘口层面并结扎,寻找该瘘管时需在美蓝等染料注射辅助下进行。染料可能渗漏造成术野识别不清,也有术者使用内镜下插入导管来识别瘘管走行。在插入导管时应注意保护梨状窝壁,若损伤则可能导致复发[15]。新生儿期由于初次发作,没有反复感染导致的粘连,手术相对安全,并发症概率较小,通过早期完全的手术干预,可以实现更快治愈[12,16],但也有文献报道新生儿期开放性手术有声带暂时性麻痹等并发症[7]。近年来,内镜下瘘口灼烧术也频繁应用于临床治疗,尤其是低温等离子治疗,可减少传统灼烧对喉返神经的热辐射影响[5]。但是对于新生儿CPSF,内镜灼烧比较困难且也有较高风险,因此开放术式仍是一个推荐的安全且可靠的手术方式[2]。
研究表明出生后1~7 d是进行手术治疗的最佳时期[2],因此,应尽早诊断明确。使用产前超声和MRI检查,有些病变可以在出生前发现[12]。MRI可用于产前评估气道阻塞,本组例1胎儿超声曾发现颈部囊肿,但是很遗憾并没有进一步行MRI检查。因此,如果产前超声提示有颈部肿块,应常规进一步行MRI检查,用于评估颈部肿块性质,及气道阻塞程度[12]。如果产前检查发现有压迫气道,应联合新生儿科、产科、麻醉科、耳鼻咽喉科进行干预,需要时进NICU观察[10],甚至需要剖宫产、产后予以肿块切排等操作。如果产前检查提示胎儿颈部有囊性包块,而出生时未发现明显包块,应仔细随访,因为一旦开始喂养,囊肿很有可能因为感染而增大,影响患儿呼吸运动。

