苹果膳食纤维对猪肉肌原纤维蛋白凝胶性能的影响
曹云刚 王 凡 艾娜丝 刘树兴 马文慧 黄峻榕
(1.陕西科技大学食品与生物工程学院, 西安 710021; 2.北京工商大学北京食品营养与人类健康高精尖创新中心, 北京 100048;3.北京市食品添加剂工程技术研究中心, 北京 100048)
0 引言
肉制品是人类膳食的重要组成部分,不仅能提供蛋白质,同时也是脂类、维生素、矿物质等营养物质的重要来源[1]。肉制品富含饱和脂肪酸和胆固醇,其过量摄入被认为与肥胖、高血压、高血脂、冠心病等疾病有直接关系[2-3]。直接去除脂肪会造成肉制品品质下降,引起消费者排斥。因此,选用一种合适的脂肪替代物至关重要。
膳食纤维是一种不被人体小肠消化吸收、在大肠内能部分或全部发酵的多糖,对预防高血压、高血脂、肥胖等疾病有一定的作用。同时,膳食纤维具有很强的吸水性、持油性、保水性以及膨胀性[4-5]。近年来,已有不少研究将膳食纤维添加至低脂肉制品中,以提高肉制品的品质或代替脂肪,减少热量的摄入,提高人体健康,如甘蔗膳食纤维[6]、小麦麸皮膳食纤维[4]、瓜尔-黄原胶[7]等。但现有研究结果并不一致,相关机制仍需进一步探索。
肌原纤维蛋白是肉制品中含量最高、最重要的蛋白质,决定着肉的加工性能及肉制品的品质[8]。目前,关于膳食纤维对肌原纤维蛋白凝胶性能影响的研究较少,尤其是苹果膳食纤维对其影响的相关研究尚未见报道。我国是世界上最大的苹果生产国和消费国,苹果汁的消费也日益增长。苹果汁加工副产物苹果渣中含有大量的膳食纤维,不溶于水、无味无害、有益于健康。目前,苹果渣除极少部分被用于饲料和深加工外,绝大部分被丢弃,既浪费资源又污染环境,因此苹果渣亟待深度应用开发。如果能将苹果膳食纤维合理应用于肉制品加工中,既能提高肉制品的健康性,又能拓宽苹果渣的应用范围。为此,本文探究不同含量苹果膳食纤维(Apple dietary fiber,ADF)对肌原纤维蛋白(Myofibrillar protein,MP)凝胶性能的影响,为苹果膳食纤维作为添加剂或脂肪替代物在肉制品中的应用提供理论参考。
1 材料与方法
1.1 材料及试剂
猪外脊肉(Longissimuslumborum),购于陕西省西安市未央区润家超市,置于冰盒中运回实验室,剔除可见脂肪组织后,垂直于肌纤维走向切成100 g左右的肉排,真空包装,置于-18℃冷冻备用。
乙二醇双(2-氨基乙基醚)四乙酸(EGTA)、二硫苏糖醇(DTT)等,购于生工生物工程(上海)股份有限公司;ADF直径小于0.074 mm,由陕西嘉禾生物科技股份有限公司提供。
1.2 仪器与设备
HR/T20MM型立式高速冷冻离心机,湖南赫西仪器装备有限公司;CP213型电子天平,奥豪斯仪器(常州)有限公司;PHS-25型数显pH计,上海仪电科学仪器股份有限公司;TA.Plus型物性测试仪,英国Stable Micro System公司;Mini-PROTEAN 3 Cell型电泳仪,美国Bio-Rad公司;CM-5型分光测色计,柯尼卡美能达(中国)投资有限公司;Thermo Scientific-HAAKE Mars60型流变仪、Thermo Scientific-DXR 2xi型显微拉曼成像光谱仪,美国赛默飞世尔科技公司;冷冻干燥机,上海比朗仪器制造有限公司;FEI Q45+EDAX Octane Prime型扫描电镜,美国FEI公司。
1.3 方法
1.3.1肌原纤维蛋白的提取
参照文献[9]的方法进行肌原纤维蛋白的提取。将冷冻肉在4℃下静置12 h进行解冻,用刀将猪外脊肉切成若干小条称量,放置于组织捣碎机中,加入4倍体积的僵直液(0.1 mol/L NaCl,2 mmol/L MgCl2,10 mmol/L Na3PO4,1 mmol/L EGTA,pH值7.0),进行匀浆捣碎(15 s,4次),离心15 min(2 000g,4℃),弃上层液,所得沉淀再次加入4倍体积的僵直液,重复上述步骤共3次。所得沉淀加入4倍体积的0.1 mol/L NaCl溶液,搅拌均匀后经纱布过滤,使用0.1 mol/L HCl将滤液的pH值调至6.25,离心,所得沉淀即为MP。全部提取过程保持在0~4℃,将所得蛋白置于离心杯中,保存于碎冰中,并保证在48 h内使用。采用双缩脲法测定蛋白浓度。
1.3.2肌原纤维蛋白-膳食纤维混合体系的制备
使用25 mmol/L pH值6.2的磷酸盐缓冲液(含0.4 mol/L NaCl)将MP蛋白膏稀释为45 mg/mL,分别加入不同含量的ADF,用上述缓冲液对体系进行稀释,使得最终蛋白质量浓度为30 mg/mL,ADF添加量(占蛋白质量分数)分别为0、1%、2%、3%、5%、10%、20%和50%,用玻璃棒轻轻搅拌均匀,将样品放置4℃下储存12 h。
1.3.3十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析
参照文献[10]的方法,用25 mmol/L pH值6.2的磷酸盐缓冲液(含0.4 mol/L NaCl)稀释肌原纤维蛋白-膳食纤维混合体系,使其中蛋白最终质量浓度为2 mg/mL,与等体积电泳样品稀释缓冲液混匀后,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析(SDS-PAGE)法分别在还原和非还原条件下对蛋白交联和聚集进行电泳分析,其浓缩胶和分离胶的质量分数分别为4%和12%,每孔上样量20 μg。然后染色、脱色、拍照,并对电泳条带进行分析。
1.3.4流变学性能的测定
根据文献[11]的方法进行动态流变学的测定。将样品混合物置于塑料离心管中离心(4℃,1 000g,1 min)脱气,将脱气后的样品置于间距为1 mm的流变仪平板之间,下压后轻轻拭去平板周围多余的样品,用硅油进行密封,防止水分的流失,平衡2 min,在振荡模式下使样品以1℃/min的升温速率从20℃加热至75℃后开始凝胶化。其振荡频率为0.1 Hz,最大应变为0.02。记录实验中的弹性模量G′作为评价指标。
1.3.5热诱导凝胶的制备
准确称取5 g上述混合物样品置于小玻璃瓶中,封口,将其放置水浴锅中,以1℃/min的速度从20℃加热至75℃,且在75℃保温10 min,取出后立即放置冰水浴中冷却30 min,将所得凝胶于4℃冰箱中静置12 h[12]。测定凝胶性能前,需将凝胶样品在室温(20℃)下平衡2 h。
1.3.6蒸煮损失
用小铲轻轻将凝胶与瓶壁剥离,并倒扣于滤纸上,静置20 min,使其蒸煮汁液流尽之后,对凝胶进行称量[13]。蒸煮损失率C计算公式为
(1)
式中M0——蒸煮前溶胶质量
M1——蒸煮后溶胶质量
1.3.7凝胶白度
凝胶白度测定参照文献[14]方法,略作修改。使用分光测色计进行测定,通过仪器的自检及零点、白板的校正之后,开始测定样品。每个样品做3组平行,取其平均值。凝胶白度W计算公式为
(2)
式中L*——亮度
a*——红度(正值表示偏红,负值表示偏绿)
b*——黄度(正值表示偏黄,负值表示偏蓝)
1.3.8凝胶质构
采用TPA质构分析法[15],测定凝胶的硬度、弹性、内聚性、咀嚼性和回复性等指标。使用小铲子轻轻将凝胶与小玻璃瓶壁剥离,将凝胶取出放置于平板上进行质构测定。测定参数设置如下:测前、测中、测后速率均为2 mm/s;下压百分比30%;两次下压时间间隔5 s;探头型号P/75;触发力10 g。
1.3.9拉曼光谱
参照文献[16]的方法略微修改。拉曼数据采集参数设置如下:显微拉曼成像光谱仪波长785 nm;激光功率35 mW;10×/0.25 BD显微镜;孔径50 μm;估计分辨率4.7~8.7 cm-1;估计光斑直径3.1 μm;收集曝光时间30 s;样品曝光次数3次。光谱数据由OMNIC软件收集,使用LabSpec软件对所得光谱进行平滑、基线校正以及在1 003 cm-1处的苯丙氨酸带进行归一化处理。
1.3.10凝胶微观结构
参照文献[17]的方法稍加修改,借助扫描电镜对凝胶微观结构进行观察。使用刀片将凝胶样品切块(3 cm×3 cm×3 cm),用含2.5%戊二醛的0.2 mol/L的磷酸盐缓冲液固定4 h后,用磷酸盐缓冲液(pH值7.4)清洗3次,随后依次在体积分数为50%、70%、90%、95%和100%的乙醇中浸泡30 min进行脱水,在-70℃冷冻干燥后对样品喷金,并使用扫描电镜观察其微观结构,加速电压为15 kV,放大倍数3 500倍。
1.4 数据统计分析
每组实验重复2~3次,采用Statistix 9.0分析软件进行方差分析和显著性分析,P<0.05时差异显著;采用SigmaPlot 12.5软件进行数据绘图。
2 结果与分析
2.1 MP混合溶胶中蛋白交联聚集
通过SDS-PAGE分析ADF添加量对MP交联聚集的影响(图1)。在非还原条件(图1a),随着ADF添加量的增加,分离胶中MP样品的肌球蛋白重链(MHC)和肌动蛋白(Actin)条带等并没有发生明显变化,同时浓缩胶顶端的大分子聚合物条带也基本相似。在还原条件(加入DTT后,图1b),浓缩胶顶端的聚合物条带明显减少,同时分离胶中MHC和Actin条带明显加粗,说明在非还原条件下形成的聚合物中主要包含肌球蛋白重链和肌动蛋白,并且这些聚合物主要是通过二硫键交联而成的,但仍有极少部分聚集物条带并没有消失,表明聚合物中可能有其他共价键存在[11]。综合上述分析可知,ADF添加对MP的交联聚集几乎没有影响,且二者之间不存在共价交联。
2.2 MP动态流变行为
不同ADF添加量对混合凝胶弹性模量G′的影响如图2所示。ADF添加量为1%~20%时,其G′曲线极其接近,导致曲线之间过度重叠,为便于分析与阅读,此处选择ADF添加量为20%的G′曲线作为代表性曲线。未添加ADF的MP样品的G′在44~53℃范围内显著上升,这是因为肌球蛋白头部的变性及交联,从而形成较弱的凝胶网络结构;53~61℃急剧下降,这是由于肌球蛋白的尾部展开破坏了已形成的网络结构;在最后的加热过程中(61~75℃)G′随温度升高持续上升,说明蛋白质进一步发生交联聚集,最终形成了永久性、不可逆的、更强的凝胶网络结构[18-19]。不同文献报道中MP在加热过程中的热转变峰值存在差异[20],这可能与实验所用猪外脊肉、实验条件等的不同有关。低ADF添加量(1%~20%)对MP弹性模量无显著影响,加热终点(75℃)的G′与对照基本一致。高ADF添加量(50%)完全破坏了MP在加热过程中的凝胶网络形成,导致整个加热过程中混合体系的G′都非常低。这可能是由于ADF含量过大,其吸水溶胀后严重阻碍了蛋白质之间的交联。
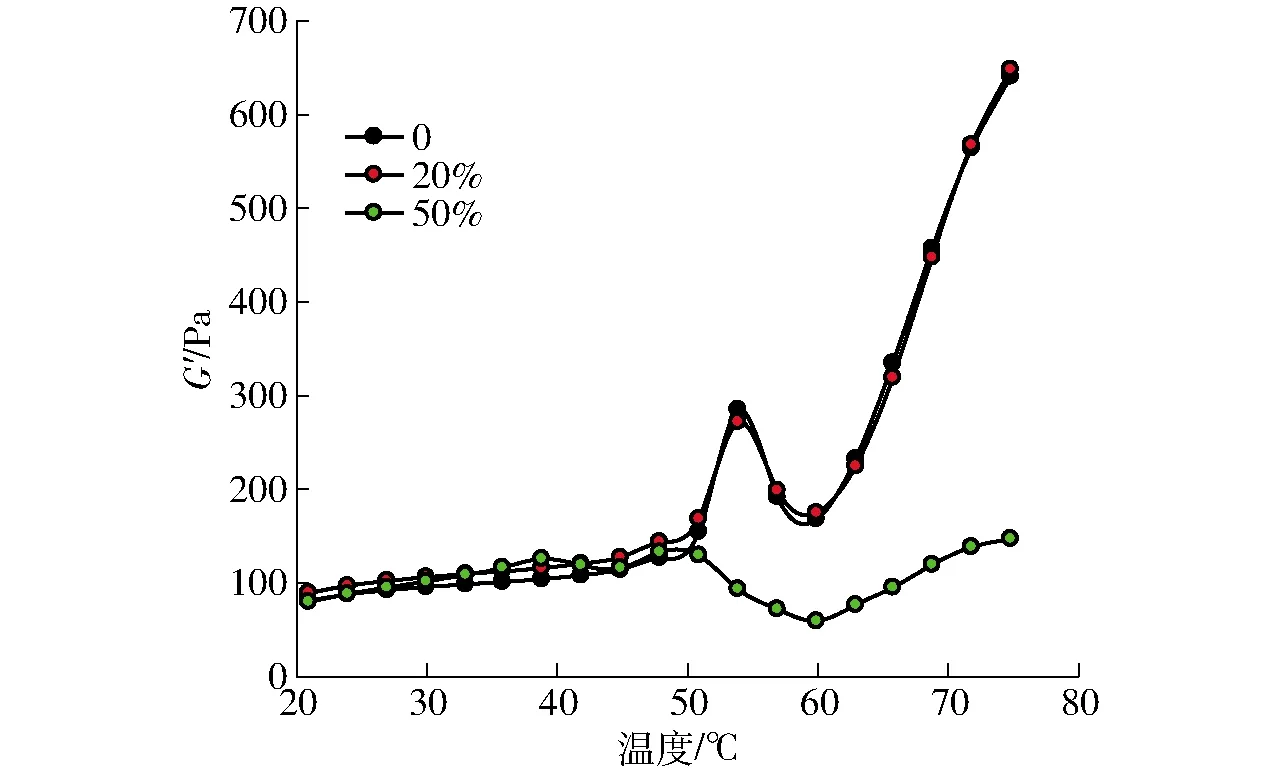
图2 ADF添加量对加热过程中混合溶胶弹性模量G′的影响Fig.2 Effect of ADF content on elastic modulus G′ of mixed sol during heating
2.3 MP混合凝胶蒸煮损失与凝胶白度
肉在蒸煮的过程中会造成水分、脂肪等的流失,此现象称之为蒸煮损失[12]。不同ADF添加量对MP凝胶蒸煮损失率的影响如图3(图中不同字母表示差异显著,下同)所示。未添加ADF的MP热诱导凝胶的蒸煮损失率为14.96%,从统计学意义上看1%~5%的ADF添加量对MP热诱导凝胶的蒸煮损失无明显影响,但从数值上看添加5%ADF的混合凝胶具有最小的蒸煮损失率(14.44%)。当ADF添加量大于10%时,MP热诱导凝胶的蒸煮损失率随ADF添加量增大呈上升趋势,当添加量为50%时,其蒸煮损失率增大至18.45%,与空白对照相比提升了23.32%。如前所述,添加50%的ADF严重破坏了MP凝胶网络的形成,因而导致其蒸煮损失明显增大。文献[21]研究发现,添加大豆膳食纤维可使鱼糜凝胶的蒸煮损失降低,不一致的实验结果可能与实验所用膳食纤维种类及添加量不同有关。
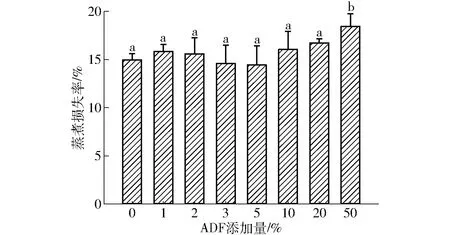
图3 ADF添加量对热诱导混合凝胶蒸煮损失率的影响Fig.3 Effect of ADF content on cooking loss rate of heat induced mixed gels
不同ADF添加量对MP凝胶白度的影响如图4所示。随着ADF添加量增加,所形成凝胶的白度呈逐渐下降趋势;且当ADF添加量大于3%时,混合凝胶白度下降趋势肉眼可见(P<0.05),这是由于ADF本身具有颜色(棕色)。
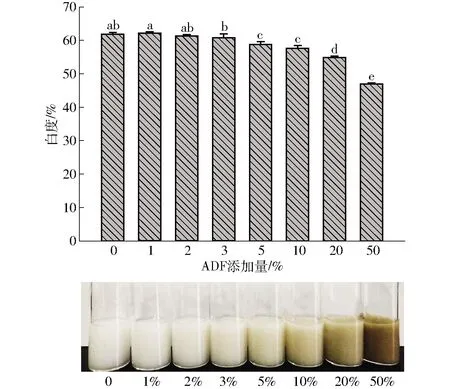
图4 ADF添加量对热诱导混合凝胶白度的影响Fig.4 Effect of ADF content on whiteness of heat induced mixed gels
2.4 MP混合凝胶质构
根据美国食品科学技术学会委员会规定,食品的质构是指眼睛、口中的豁膜及肌肉所感觉到的食品的性质,包括粗细、滑爽、颗粒感等。食品质构是与食品的组织结构及状态有关的物理性质,其机械特性测定指标通常包括硬度、弹性指数、内聚性指数、咀嚼性指数和回复性指数等。硬度是描述与食品变形或穿透产品所需的力有关的机械质地特性,是食品保持形状的内部结合力。弹性指数表示物体在外力的作用下发生形变,撤去外力后可以恢复原来状态的能力。内聚性指数反映的是咀嚼食物时食物抵抗受损并紧密连接,可以使食物保持完整的性质。咀嚼性指数是指与硬度、内聚性和弹性有关,将固体食品咀嚼到可吞咽时需做的功的大小。回复性指数反映了食品以弹性变形保存的能量,表示变形样品在与导致变形同样的速度、压力条件下回复的程度[22]。不同ADF添加量对MP混合凝胶质构的影响如表1所示。与对照相比,添加5%和20%ADF的MP热诱导凝胶的内聚性指数分别提高了17.9%和14.3%。除此之外,添加1%~20%的ADF对MP热诱导凝胶的硬度、弹性指数和内聚性指数几乎无影响,当添加量为50%时,凝胶的硬度、弹性指数和内聚性指数与对照相比分别下降了约30%、16%和34%。添加1%~10%的ADF对MP热诱导凝胶的咀嚼性指数和回复性指数影响不显著,但添加20%和50%的ADF显著降低了凝胶的咀嚼性指数和回复性指数(P<0.05),且ADF添加量越大负面效应越明显,当添加量为50%时,凝胶的咀嚼性指数和回复性指数与对照相比分别下降了约62%和52%。整体来看当ADF添加量低于10%时,对热诱导凝胶的质构特性无负面影响,这与流变的实验结果大体一致。综合来看,添加5%ADF的MP热诱导凝胶质构特性最好。

表1 ADF添加量对热诱导混合凝胶质构的影响Tab.1 Effect of ADF content on texture profile of heat induced mixed gels
2.5 MP混合凝胶中非共价相互作用
2.5.1疏水作用力
凝胶的拉曼光谱可以显示出芳香族氨基酸侧链的变化,可以提供局部环境下蛋白质的三级结构信息,拉曼谱带在760 cm-1处的归一化强度与色氨酸残基环的伸缩振动有关,可用于研究色氨酸残基的微环境,进而反映蛋白质凝胶的疏水相互作用[23]。如表2所示,随ADF添加量增大,MP混合凝胶760 cm-1处归一化强度整体呈增大趋势,但当ADF添加量在0~20%之间时,归一化强度并无显著差异(P>0.05)。当ADF添加量达到50%,归一化强度明显增大,表明更多的色氨酸残基处于较疏水的微环境中。这可能是由于ADF添加量过大,竞争性吸收了体系中大量的水分,阻碍了MP的水化,使得色氨酸残基的微环境更加疏水。
2.5.2氢键
利用830 cm-1和850 cm-1附近的双拉曼光谱可以监测酪氨酸残基周围的微环境。酪氨酸双峰比值(I850/I830)可用于检测酪氨酸残基是否暴露于溶剂中,其相对强度反映了氢键的性质和酪氨酸侧链中酚羟基的状态[2,23]。当酪氨酸双峰比值(I850/I830)在0.7~1.0之间时,通常表明酪氨酸残基埋藏在蛋白分子中,当酪氨酸双峰比值(I850/I830)在0.90~1.45之间时,则表明酪氨酸残基暴露于溶剂当中[24-25]。如表2所示,所有混合凝胶的酪氨酸双峰比值(I850/I830)均在1.0附近,表明酪氨酸残基上的OH既与H2O2形成氢键又与蛋白质上其他中性基团形成氢键;所有混合凝胶的酪氨酸双峰比值(I850/I830)无显著差异(P>0.05),说明ADF添加对混合凝胶中的氢键无显著影响。与本实验结果类似,文献[2]研究发现添加不同含量的甘蔗不溶性膳食纤维对MP混合凝胶中的氢键无显著影响。

表2 ADF添加量对MP混合凝胶760 cm-1处归一化强度及酪氨酸双峰比值(I850/I830)的影响Tab.2 Effect of ADF content on normalization intensity 760 cm-1 band and I850/I830 band of mixed gels
2.6 混合凝胶微观结构
肌原纤维蛋白在加热过程中会发生变性及聚集,最终形成紧致、细密的三维网络结构[2]。不同ADF添加量对MP混合凝胶微观结构的影响如图5所示。从图5可以看出,当添加中低添加量ADF(0~5%)时,混合凝胶的微观结构并没有发生明显变化,可能是添加量较少时ADF能较好地填充于蛋白网孔空隙中。但当添加高添加量ADF(10%~50%)时,随着ADF添加量增大,混合凝胶体系网络结构逐渐疏松、粗糙、孔隙变大,这可能是因为膳食纤维添加量过大,竞争性吸水溶胀,阻碍了肌原纤维蛋白的水化及蛋白之间的交联[3]。这也就进一步解释了高浓度ADF添加导致混合凝胶持水性下降和凝胶质构性能降低。
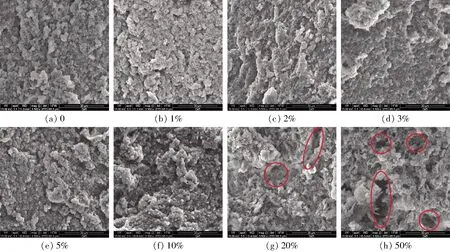
图5 不同ADF添加量下混合凝胶微观结构图Fig.5 Microstructure of heat induced MP gels with different contents of ADF
3 结束语
探究了ADF添加量对MP凝胶性能的影响。实验结果表明:ADF与MP蛋白质之间并无共价交联行为;当添加量为1%~20%时,对混合溶胶体系的流变学特性无显著影响,当添加量为50%时,其流变学特性遭到严重破坏;低ADF添加量(1%~5%)对混合凝胶的性能无负面影响,且添加5%时的混合凝胶蒸煮损失最小、综合质构特性最好;高ADF添加量(10%~50%)时,过度竞争性吸水及溶胀抑制了MP的水化及交联,导致混合凝胶网络结构粗糙、空隙变大,蒸煮损失增大,硬度、弹性、咀嚼性和回复性等均降低。此外,由于ADF自身的颜色,其添加量增大会导致混合凝胶的白度下降。

