晋岚绒山羊多胎性能4 个候选基因的研究
郭慧慧,周胜花,张 丽,赵 鹏,郭宏宇,毛杨毅,李 俊
(山西省农业动物科学学院,山西太原 030032)
晋岚绒山羊是以辽宁绒山羊为父本、吕梁黑山羊为母本杂交选育的绒山羊新品种,具有产绒量高、绒细度好、耐粗饲、抗逆性强等特性[1]。通过在山西省境内调研发现,晋岚绒山羊多数产单胎,平均产羔率在100%~120%,生长速度低于绵羊,其低产羔率已成为制约产业快速发展的主要瓶颈之一。由于绒山羊的繁殖力属于低遗传力,因此利用分子标记辅助选择可以加快晋岚绒山羊多胎性状的选育进程,提高养殖户的经济效益。
生长分化因子9(Growth Differentiation Factor 9,GDF9)定位于绵羊5 号染色体,是由卵母细胞分泌的一种生长因子,骨形态发生蛋白15(Bone Morphogenetic Protein 15,BMP15)定位于X 染色体,是一种在卵巢表达的卵母细胞衍生因子,两者同属于转化生长因子,BMP15与GDF9基因共同作用于卵泡,影响优势卵泡的选择和闭锁卵泡的形成,调控颗粒细胞的增殖和分化[2-6]。促卵泡素(Follicle Stimulating Hormone,FSH)是一种由垂体前叶分泌的糖蛋白激素,它与性腺细胞受体结合,促使颗粒细胞增殖,刺激类固醇合成,从而调节配子细胞的发育和成熟,FSH 由α和β2 个亚基组成,β亚基决定着FSH 的生物活性。FSHβ基因在山羊的繁殖过程中起着重要作用[7]。促性腺素释放激素受体(Gonadotropin-releasing Hormone Receptor,GnRHR)通过与促性腺激素释放激素(GnRH)结合促进黄体素和FSH 的合成与释放,促进性腺的生长、成熟,调控动物的繁殖力,如激素的合成、装置配体的生成等。抑制GnRH基因及其受体基因的表达,哺乳动物的生殖活动就会被限制[8]。
已有研究表明,GDF9、BMP15、FSHβ以及GnRHR基因对羊繁殖性状有重要影响,但在晋岚绒山羊上尚无相关研究。因此,本研究以晋岚绒山羊为研究对象,采用直接测序和SNaPshot 方法分析GDF9、BMP15、FSHβ以及GnRHR基因多态性与晋岚绒山羊繁殖性状之间的相关性,以期获得更准确全面的遗传信息,为高繁殖力的晋岚绒山羊品系选育的标记辅助选择提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 171 只晋岚绒山羊经产母羊选自山西晋岚绒山羊育种中心、晋岚绒山羊种羊场,其中每胎产双羔母羊90 只,每胎产单羔母羊81 只,连续记录3 年母羊产羔数。颈静脉采血2 mL,无菌抗凝管EDTA 抗凝。
1.1.2 主要试剂及仪器 PCR 仪(PT-200 型)购自BIORAD 公司,台式高速冷冻离心机(2-16PK 型)购自Sigma 公司,测序仪(3730XL)购自ABI 公司,电泳仪(DYY-6C 型)购自北京市六一仪器厂,GnRH DNA 聚合酶购自Qiagen 公司,SNaPshot 试剂盒:ABI PRISM®SNaPshotTMMultiplex Kit(ABI公司),SAP酶(Fermentas公司)、ExoI 酶和CIP 酶(New England Biolabs,Inc)。
1.2 方法
1.2.1 血液基因组DNA 提取 根据血液基因组DNA 提取试剂盒的方法,对171 只母羊血液进行基因组DNA提取,溶于100 μLTris-EDTA(TE)缓冲液中,-80℃冻存。取2 μL DNA 样本,0.8%琼脂糖凝胶电泳检测。
1.2.2 候选基因引物设计 根据NCBI 发布的山羊BMP15基因(登录号:KY780297)、GDF9基因(登录号:NC_030814)、FSHβ基因(登录号:NC_030822)、以及GnRHR基因(登录号:NC_030813)序列,用Primer5.0 软件在编码区上下游设计9 对引物,送上海英骏生物技术有限公司合成,引物序列见表1。
1.2.3 PCR 扩增 根据产羔记录,随机选取双羔母羊20 只,单羔母羊20 只,扩增4 个基因全部编码区序列。PCR扩增体系25 μL:上、下游引物(10 μmol/L)各1 μL,5×Pfu Buffer(含Mg2+)5 μL,dNTPs(2.5 mmol/L)2 μL,Pfu polymerase(2.5 U/μL)0.5 μL,DNA模板 2 μL,加ddH2O 至25 μL。PCR 扩增条件:95℃预变性5 min;94℃变性30 s,退火40 s,72℃延伸30 s,36 个循环;72℃延伸8 min;4℃保存。PCR 产物进行1.0%琼脂糖凝胶电泳检测,PCR 产物条带回收纯化后送北京美吉桑格生物医药科技有限公司测序。
1.2.4 SNPs 位点筛选及SNaPshot 分型技术检测 利用DNASTAR 软件对GDF9、BMP15、FSHβ及GnRHR4 个候选基因全部编码区进行测序结果的序列拼接,根据测序峰图进行SNP 位点判读。在171 只经产母羊(双羔母羊90 只,单羔母羊81 只)大群体中进行了SNaPshot 分型技术检测[9],引物信息见表2。
1.2.5 多重PCR 反应 PCR 反应体系10 μL:10×Buffer I 1 μL,dNTP(2.5 umol/L)0.8 μL,Hs Taq polymerase(5 U/μL)0.1 μL,上下游引物(5 umol/L)各2 μL,DNA 模板(10~20 ng/μL)2 μL,加ddH2O 至10 μL。PCR 扩增条件:94℃预变性5 min;94℃变性30 s,65℃退火30 s,72℃延伸30 s,共10 个循环,每个循环下降1℃;94℃变性30 s,55℃退火30 s,72℃延伸30 s,共25 个循环;72℃延伸10 min,取2 μL 上样,2%琼脂糖凝胶电泳检测。PCR 产物4 μL,虾碱酶(SAP)(1 U/μL)1.33 μL,外切酶Ⅰ(Exo Ⅰ)(20 U/μL )0.27 μL 进行纯化,37℃温浴1.0 h,75℃灭活20 min 。

表1 引物序列信息

表2 SNaPshot 检测引物序列信息
1.2.6 单碱基延伸 反应体系5 μL:纯化后扩增产物1.2 μL,Primers Mix 2 μL,ABI Mix 0.5 μL,10×Buffer I 0.5 μL,加ddH2O 至5 μL。延伸条件:96℃变性 10 s,50℃退火5 s,60℃延伸30 s,共30 个循环。延伸产物纯化:延伸反应产物5 μL 加入1 μL CIP 酶;37℃温浴1.0 h,75℃灭活15 min。96 孔板中每孔加入分子量内标和甲酰胺混合液(0.5:8.5)9 μL,PCR 产物1.0 μL;95℃变性3 min,3730XL 测序仪检测。
1.2.7 统计分析 利用卡方检验群体是否处于哈代温伯格平衡状态。配合下列模型进行最小二乘方差分析,比较产羔数在各个基因型间的差异:
yij=μ+Fi+Gj+eij
其中,yij为产羔数;μ 为群体均值;Fi为场(次)效应值;Gj为基因型效应值;eij为随机残差效应。采用SPSS 18.0 统计软件中的GLM 过程对BMP15基因和GDF9基因多态性与产羔数进行关联分析,不同基因型对应的产羔数用最小二乘均值±标准误表示。使用Cervus软件计算多态信息含量(PIC)和期望杂合度(He),PIC<0.25 为低度多态;0.25<PIC<0.5 为中度多态;PIC>0.5 为高度多态。
2 结果
2.1 PCR 扩增 由图1 可知,引物P1~P9 的PCR 扩增条带清晰、明亮,无杂带,产物大小均与预期一致。
2.2 SNP 位点检测结果 4 个候选基因全部编码区共筛选出17 个SNPs 位点,其对应的氨基酸位置见表3,FSHβ基因2 个外显子编码130 个氨基酸,GDF9基因2 个外显子编码454 个氨基酸,BMP15基因2 个外显子编码395 个氨基酸,GnRHR基因3 个外显子编码329 个氨基酸。17 个SNPs 位点中包含11 个错义突变和6 个同义突变(FSHβ基因5 个SNPs 位点、GDF9基因6 个SNPs位点、BMP15基因3 个SNPs 位点、GnRHR基因3 个SNPs 位点)。

表3 SNP 位点及相应编码氨基酸
2.3 SNaPshot 检测结果 根据各个SNP 位点基因型在单双羔母羊群体中的分布,选取BMP15基因A735G 位点以及GDF9基因A959C 位点,对171 只经产母羊(双羔母羊90 只,单羔母羊81 只)进行了SNaPshot 分型技术检测。GDF9基因A959C 位点共检测到3 种基因型:野生型AA,杂合型AC,突变型CC;BMP15基因G735A 位点共检测到3 种基因型:野生型GG,杂合型AG,突变型AA。其中GDF9基因编码区959 位点的A →C 的突变导致第320 位编码氨基酸由谷氨酰胺(Q)变成脯氨酸(P)。BMP15基因编码区735 位点的G →A 突变为同义突变,未导致编码氨基酸的改变(图2)。
2.4GDF9基因和BMP15基因的基因型频率、等位基因频率、PIC 及He 由表4 可见,该群体GDF9基因A959C 位点A 等位基因频率高于C 等位基因频率,A 为优势等位基因;AA 基因型频率高于AC 和CC,AA 基因型为优势基因型,该位点属于中度多态,经卡方检验,该位点处于哈代-温伯格平衡状态。该群体BMP15基因G735A 位点G 等位基因频率显著高于A等位基因频率,G 为优势等位基因;GG 基因型频率高于AG 和AA,GG 基因型为优势基因型,该位点属于低度多态,经卡方检验,该位点处于哈代-温伯格平衡状态。

表4 GDF9 基因和BMP15 基因的基因型频率、等位基因频率、PIC 及He
2.5GDF9基因、BMP15基因不同基因型与产羔数的关联分析 由表5 可知,该晋岚绒山羊群体中GDF9基因CC、AC 基因型个体的产羔数显著高于AA 基因型个体,表明GDF9基因A959C 位点的A/C 突变中,C 等位基因与晋岚绒山羊高产羔数呈显著正相关;BMP15基因AA、AG 基因型个体的产羔数显著高于GG 基因型个体,表明BMP15基因G735A 位点的G/A 突变中,A 等位基因与晋岚绒山羊高产羔数呈显著正相关。
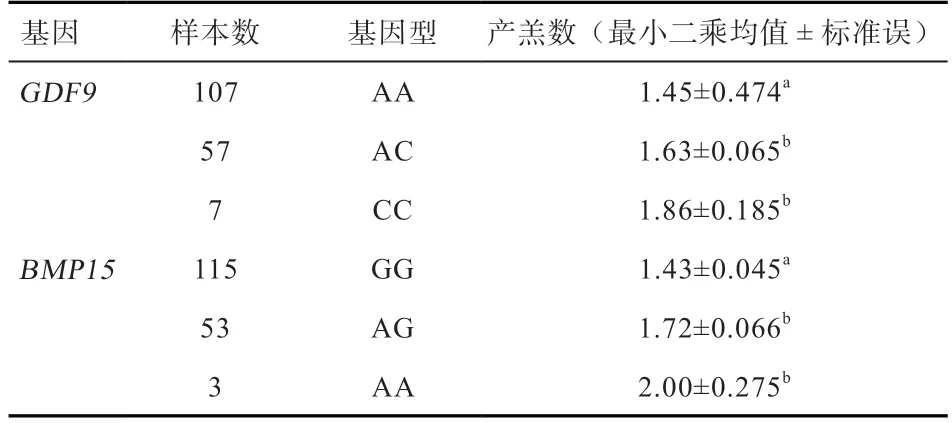
表5 GDF9 和BMP15 基因不同基因型对产羔性能的影响
3 讨 论
3.1GDF9基因与山羊产羔数的相关性 在山羊卵巢中,GDF9mRNA 和蛋白在卵泡期和黄体期均有表达。GDF9基因中的多个突变对绵羊的排卵率有影响[10],其中有4 个突变确定对绵羊的繁殖性能有影响[11-12]。在GDF9基因959 位点,基因型分布在高产和中、低产羊品种中呈现明显的差异[3,13-14]。Wang 等[13]报道959 位点突变对陕北白绒山羊的产羔数起着非常重要的作用。在济宁青山羊中CC、AC 基因型的产羔率极显著高于AA 基因型[3]。Zhao 等[14]也报道GDF9基因Q320P 在内蒙古绒山羊世代单羔母羊和产双羔母羊中差异表达。本研究中,晋岚绒山羊群体GDF9基因编码区959 位点存在多态,检测到3 种基因型:AA、AC、CC,该突变使得GDF9基因第320 位编码氨基酸由谷氨酰胺变成脯氨酸。该位点的CC、AC 基因型个体的产羔数极显著高于AA 基因型个体,表明等位基因C 与晋岚绒山羊高产羔数呈显著正相关。
3.2BMP15基因与山羊产羔数的相关性BMP15与GDF9同属于TGF-β超家族成员,对卵泡发育起重要调控作用,BMP15与卵巢自身生成的GDF9协同作用于卵泡,以自分泌或旁分泌形式对优势卵泡的发育及卵母细胞的生长产生影响[15]。在人、小鼠、大鼠和绵羊卵泡发育前期,卵母细胞中均有BMP15基因的表达[16]。Yan 等[17]研究表明,BMP15基因对雌性小鼠的繁殖性状有重要影响。BMP15基因突变纯合雌性个体的每窝产仔数和每月窝数都显著低于BMP15突变杂合雌性个体。Otsuka 等[18]确定了BMP15的两个主要作用,其一是通过抑制颗粒细胞中FSH 受体的表达,进而抑制FSH 的表达;其二是通过促进颗粒细胞增殖,从而促进早期卵泡的发育。国外研究表明BMP15外显子上存在5 个影响绵羊繁殖性能的SNPs 位点:FecXH(C67T)、FecXI(T92A)、FecXB(G100T)、FecXL(G321A)、FecXG(C718T),但在本实验群体中均未发现以上突变。关于BMP15基因G735A 突变位点的报道很少,该位点是由Ahlawat 等[19]2013 年首先在印度本土山羊品种中检测到,但该突变在印度本土高、低产山羊中差异不显著。本研究中,晋岚绒山羊群体BMP15基因编码区735 位点存在多态,检测到3 种基因型:GG、AG、AA,该突变未导致编码氨基酸改变。该位点的AA、AG 基因型个体的产羔数显著高于GG 基因型个体,表明等位基因A 与晋岚绒山羊高产羔数呈显著正相关。
3.3GDF9基因和BMP15基因的联合效应 Hanrahan等[20]报道BMP15基因和GDF9基因对绵羊排卵数具有联合加性效应,2 个基因的基因型均为突变杂合子时,绵羊具有更高的排卵数。Liao 等[21]、Alexandra 等[22]报道当BMP15和GDF9基因一起表达时,BMP15基因加工和分泌功能消失,GDF9基因加工和分泌功能严重受损。因此,如果绵羊BMP15基因突变纯合和GDF9基因突变纯合同时发生,其排卵数更低。由此可推测BMP15基因编码区735 位点的突变虽未引起编码氨基酸改变,但有可能是与GDF9基因进行联合作用,进而影响晋岚绒山羊的产羔率。
4 结 论
本研究结果表明,在该群体中GDF9基因和BMP15基因与晋岚绒山羊产羔率显著相关,初步认为GDF9基因和BMP15基因是影响晋岚绒山羊繁殖性能的主效基因,可扩大群体规模对以上两位点进行进一步验证,若确定此位点是影响晋岚绒山羊产羔率的主效基因,可以作为分子标记对晋岚绒山羊进行辅助育种,同时初步排除FSHβ基因和GnRHR基因突变对晋岚绒山羊多胎性能影响的可能性。

