贝伐单抗联合FOLFIRI治疗晚期大肠癌疗效与循环内皮细胞相关性分析
吴芳 刘忠 黎军和 卢致辉 史克志 李璇
(南昌大学第一附属医院肿瘤科 江西 南昌 330006)
大肠癌严重危害人类健康的主要肿瘤之一,我国大肠癌的发病率和病死率呈现逐年上升趋势。晚期大肠癌治疗以靶向药物联合化疗为主。贝伐珠单抗(bevacizumab,BEV)是一种重组的人源化IgGl单克隆抗体,其通过抑制人类血管内皮生长因子的生物活性而起作用。2004年美国食品和药物管理局(FDA)批准将BEV联合化疗用于转移性结直肠癌的一线治疗[1]。目前贝伐单抗治疗晚期大肠癌还没有公认的,特异性的疗效预测指标。循环内皮细胞(circulating endothelial cells,CEC)是指从血管壁上脱落至循环外周血中的一类成熟的、终末分化的内皮细胞[2]。此类细胞在正常人外周血中数量极少。CEC计数增加反映了血管新生状态[3]。肿瘤患者体内的CEC计数与健康人群比较有明显的差异。多项研究结果表明CEC计数能够作为肿瘤患者的预后情况与治疗反应的预测因子[4]。本研究探讨贝伐单抗联合化疗治疗晚期大肠癌疗效与循环内皮细胞的相关性。
1.资料与方法
1.1 一般资料
选取2014年1月—2018年1月在我科住院的40例Ⅳ期大肠癌患者,所有患者均经组织学病理确诊为大肠癌,其中结肠癌24例,直肠癌16例,出现局部复发或有不同程度肝脏、肺、淋巴结等器官的转移。血常规、肝肾功能、心电图正常,EC0G评分≤2分,估计生存期在3个月以上。年龄30~78岁,平均年龄为57岁,男26例,女14例。本研究20例建康志愿者,来自本院体检人群。均签署知情同意书。
1.2 治疗方法
全部患者使用贝伐单抗联合FOLFIRI方案,贝伐单抗的用量为5mg/kg,FOLFIRI方案:伊立替康180mg/m2静脉滴注d,四氢叶酸注射液200mg/m2,静脉滴注2h,dl-2,5-FU 400mg/m2静脉推注d1-2;600mg/m2,持续静脉输注46h。2周重复用药。至少完成4个周期。每四个周期后,即评定疗效。患者用药前及用药2周期后,4周期后检查患者CECs计数。
1.3 疗效评价评估
近期疗效评价参照实体瘤客观疗效评定标准(RECIST)1.1版分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。有效率(RR)为CR+PR,疾病控制率(DCR)为CR+PR+SD。
1.4 CEC检测
采用流式细胞检测计数的方法,于化疗前、42周期后、4周期后检测外周血中CEC的含量,晨起空腹时采血2m1,取2个进样管分别标上对照管和CEC管;将CD45 15ul分别加入对照管和CEC管,实验管加入CD45-PE。大鼠CD146- FITC。重悬细胞,每管中加入0.5ml含1%多聚甲醛的PBS固定细胞,低速混匀,固定30min,上机检测。上机前以标准荧光微球调整仪器的变异系数并稳定在2以内,以目标细胞群设门,上机后选取1万个细胞,根据细胞发出的荧光测定表达率并计算CD45-CD146+细胞(aCECs)数。见图。

图 大肠癌患者外周血CEC计数流式细胞检测
1.5 统计学分析
两组间有效率的比较采用Fisher的确切概率法。定量资料比较采用成组t检验。P≤0.05为有统计学意义。
2.结果
2.1 40例晚期大肠癌患者的基线CEC的情况
40例晚期大肠癌患者,均完成8至少4周期化疗。患者外周血CEC为(248.32±176.02)个,高于20例健康志愿者的(82.84±58.35)个,差异有统计学意义(P<O.05)。
2.2 40例晚期大肠癌化疗疗效表1。

表1 40例晚期大肠癌化疗疗效
2.3 大肠癌患者化疗前后CEC含量变化
40例晚期大肠癌患者化疗前,CEC计数为(248.32±176.0)个;2个周期后CEC计数为(176.52±107.46)个,4个周期后CEC计数(165.24±102.22)个。化疗后患者外周血中的CEC含量较化疗前降低,差异有统计学意义(P=0.024;0.022),化疗前:2周期后、2周期后:4周期后、化疗前:4周期后P分别为0.024、0.825、0.022.而化疗过程中CEC含量变化不大(P=O.825)(表2)。
表2 大肠癌患者的基线CEC计数(±s)
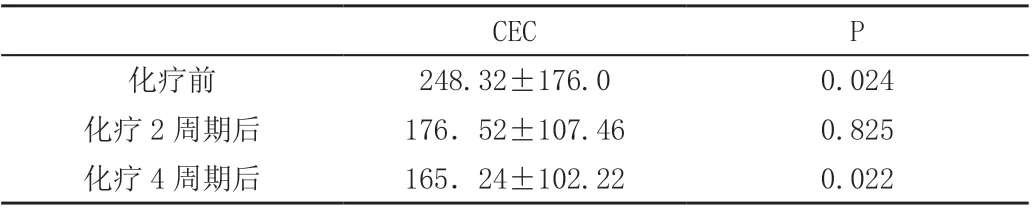
表2 大肠癌患者的基线CEC计数(±s)
CEC P化疗前 248.32±176.0 0.024化疗2周期后 176.52±107.46 0.825化疗4周期后 165.24±102.22 0.022
2.4 大肠癌患者化疗后临床获益组和临床进展组CEC含量比较
临床获益患者31人,化疗前外周血CEC含量为256.23±152.20;临床进展患者9人,化疗前外周血CEC含量为199.58±122.22。取得临床获益的患者化疗前外周血中CEC含量高于临床进展患者,差异有统计学意义(P=O.039)(表3)。

表3 临床获益组和临床进展组化疗前CEC含量比较
在化疗过程中,临床获益患者外周血中CEC含量是逐渐降低的,其差异有统计学意义(P=0.015:P=0.006)。进展患者化疗前和化疗2周期后相比,外周血CEC含量变化不大(P1=0.723),化疗4周期后CEC含量升高,与化疗前相比差异具有统计学意义(P2=0.046)(表4)。

表4 临床获益组和临床进展组化疗过程中CEC含量比较
3.讨论
在我国,大肠癌发病率为所有肿瘤第三位。贝伐单抗用于晚期大肠癌治疗后,患者生存时间明显延长,但仍有部分患者耐药。目前贝伐单抗治疗晚期大肠癌还没有公认的、特异性的疗效预测指标。循环内皮细胞(CEC)取材方便,而流式细胞技术操作简易,CEC计数增加反映了血管新生状态,本研究探讨CEC能否预测贝伐单抗疗效。1994年Barden等提出CDl46标记是血管内皮细胞的免疫标志,且目前公认CDl46是内皮细胞特异性最强的免疫标志。特异性的表达于所有血管内皮细胞,同时在活化的T淋巴细胞中也有表达。因此用CD45(造血系统来源细胞的标记)将其与活化的T淋巴细胞加以区别,即可定义CEC:CDl46+CD45-。本研究采用了CDl46+CD45-这种免疫标记。本研究探讨贝伐单抗联合化疗治疗晚期大肠癌疗效与循环内皮细胞的相关性。
本研究显示40例晚期大肠癌患者使用贝伐单抗联合FOLFIRI方案,部分缓PR32.5%,SD45%,与文献报道一致。大肠癌患者的外周血CEC计数,高于20例健康志愿者的,差异有统计学意义。这与国内外文献报道一致[5]。患者经治疗后外周血CEC计数逐渐下降。取得临床获益的患者治疗前外周血中CEC含量高于临床进展患者,差异有统计学意义。在化疗过程中,临床获益患者外周血中CEC含量是逐渐降低的,其差异有统计学意义。进展患者治疗前和治疗2周期后相比,外周血CEC含量变化不大,治疗4周期后CEC含量升高,与治疗前相比差异具有统计学意义。研究结果初步说明CEC在治疗中的变化趋势可以反映疗效,CEC含量降低提示取得疗效的可能性大,反之CEC升高则有进展的可能。临床获益患者治疗前CEC含量高于临床进展患者,提示治疗前CEC含量高的患者更易临床获益。
本研究显示,CEC与贝伐单抗治疗晚期大肠癌疗效具有相关性。我们观察到晚期大肠癌患者在治疗有效的患者中CEC含量是下降的。与一些文献报道结果一致[6]。目前也有一些文献并不支持CEC与肿瘤客观反应率相关。这可能与CEC检测或标记方法不同有关。目前科研和临床上较常应用的是流式细胞计数法和免疫磁珠分离法。免疫磁珠分离法灵敏度高,对细胞破坏小,然而成本过高,仅局限于少数科研领域的应用。采用流式细胞检测计数的方法来检测CEC,结果可靠且方法简单易行,易在临床上推广。但是如何检测标记CEC,尚未统一,值得我们进一步研究。我们还观察到临床获益患者治疗前CEC含量高于临床进展患者,提示治疗前CEC含量高的患者更易临床获益。有研究表明贝伐单抗联合化疗治疗脑胶质瘤,治疗后CEC数值明显升高,与患者预后相关,而贝伐单抗单药治疗后CEC数值与预后无关。CEC数值是否可成为贝伐单抗等抗血管生成药物的疗效预测指标还值得进一步探讨。

