30例胃肠道间质瘤KIT与PDGFRA基因突变检测结果分析
黄晓青
(浙江大学医学院附属第二医院 浙江 杭州 310008)
胃肠道间质瘤(Gastro intestinal stromal tumor,GIST)是消化道间叶来源肿瘤中最常见的类型,约占消化道恶性肿瘤的1~3%,肿瘤起源于Cajal间质细胞[1]。使用CD117抗体进行免疫组化检测可以鉴定胃肠道间质瘤中CD117特征性的表达[2]。约90%的胃肠道间质瘤中KIT基因发生了功能性的突变,该突变是GIST最主要的驱动突变类型。KIT基因编码的KIT蛋白是一种跨膜受体蛋白,受体结合干细胞因子。KIT蛋白的细胞浆内结构功能为酪氨酸激酶。因此,一旦KIT基因发生功能性突变将导致受体酪氨酸激酶的持续性激活进而引起细胞的增值能力异常升高[3]。以往研究认为胃肠道间质瘤对肿瘤化疗耐药,而且由于缺乏有效的治疗手段而预后较差。甲磺酸伊马替尼是一种针对KIT、PDGFRA以及BCR-ABL的酪氨酸激酶抑制剂靶向药物,被批准用于治疗胃肠道间质瘤。在胃肠道间质瘤中,除了KIT基因突变外,还有小部分的KIT野生型患者携带血小板衍生生长因子受体α(Platelet derived growth factor receptor-α,PDGFRA)基因突变,伊马替尼同样能结合并抑制PDGFRA[4]。
以往研究表明,KIT和PDGFRA基因突变对胃肠道间质瘤具有预后和预测的潜力,KIT基因突变往往伴随着肿瘤的侵袭性更强临床预后更差,而PDGFRA突变的胃肠道间质瘤生物学表型更偏向良性[5]。此外,KIT和PDGFRA基因突变对伊马替尼药物的疗效都具有重要的预测作用[6]。近年来研究表明,免疫组化和基因突变检测对辅助诊断胃肠道间质瘤非常有帮助,因为大约95%的肿瘤表达CD117蛋白(KIT基因编码蛋白),而且大约90%的肿瘤携带KIT基因突变,大约5%携带PDGFRA突变。尽管CD117免疫组化阳性表达被认为是诊断胃肠道间质瘤的金标准,近年来有文献报道存在部分间质瘤CD117、CD34、S-100或SMA表达阴性的情况,因此明确诊断往往存在困难。[7]分子研究表明,胃肠道间质瘤患者携带KIT基因第9外显子突变往往表现为对伊马替尼敏感度较弱,而携带KIT基因第11外显子突变的患者对伊马替尼敏感性较强。KIT基因外显子13突变对伊马替尼敏感度与外显子11突变类似,而外显子17突变患者往往对伊马替尼和舒尼替尼都耐药[8]。上述研究结果表明KIT与PDGFRA基因突变、CD117等标志物对胃肠道间质瘤患者的临床治疗具有较大临床意义。本研究主要分析胃肠道间质瘤中KIT、PDGFRA基因突变分布及其与CD117表达、临床病理特征之间的相关性,为GIST的靶向治疗提供依据。
1.资料和方法
1.1 标本选取
本研究选取2018年—2019年存档在浙江大学医学院附属第二医院的福尔马林固定石蜡包埋胃肠道间质瘤标本30例,每例标本由2位病理医生重新复查确认。
1.2 免疫组化检测
蜡块标本进行3~5微米连续切片,切片在二甲苯中脱蜡10分钟,重复2次,再进行梯度酒精洗脱,使用柠檬酸钠缓冲液进行抗原修复,CD117抗体1:100稀释后滴加在切片组织上,湿盒中室温2小时,PBS清洗3次,滴加二抗(北京中杉金桥公司),湿盒中室温30分钟后用DAB显色,苏木素复染后树胶封片。细胞膜棕色染色为阳性染色。
1.3 核酸提取
蜡块使用切片机切取蜡卷3~5片,使用二甲苯和酒精对蜡卷进行脱蜡,用蛋白酶K对组织进行消化裂解,根据试剂盒说明书使用QIAamp DNA FFPE Tissue Kit(Qiagen,德国)提取石蜡包埋组织中基因组DNA。
1.4 基因外显子扩增和DNA测序
使用PCR对KIT基因外显子9、11、13、17以及PDGFRA基因外显子12、18进行扩增,扩增产物清洁后使用ABI3130XL测序仪进行正向与反向测序。
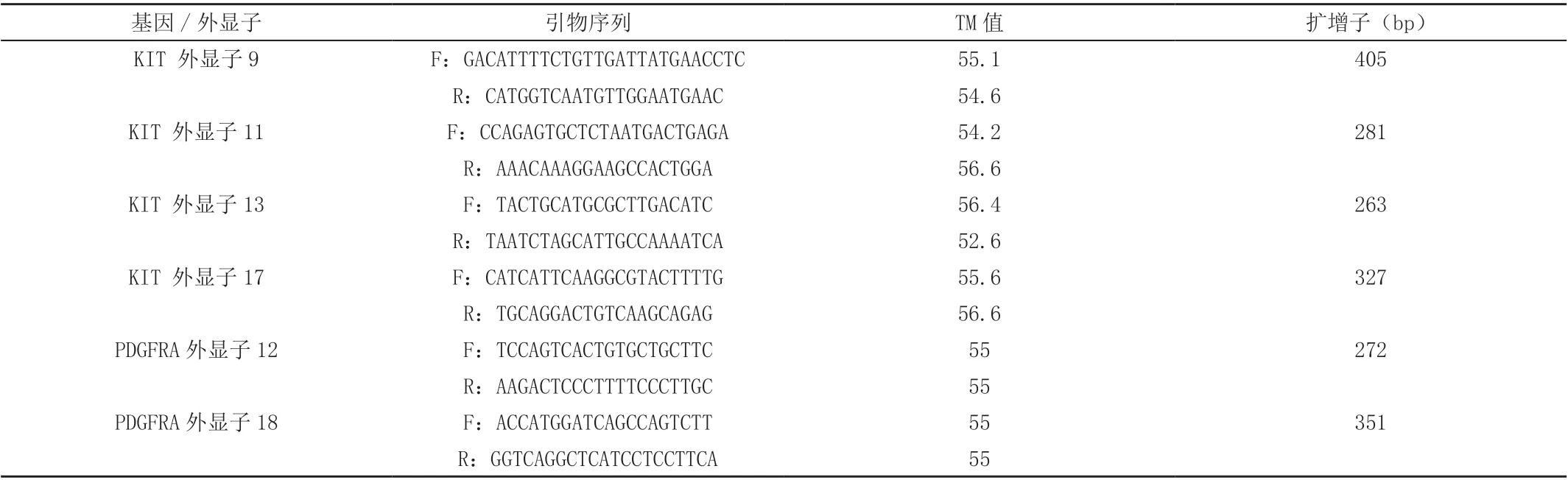
表1 扩增KIT与PDGFRA基因外显子引物列表
2.结果
2.1 患者一般资料
30例胃肠道间质瘤中,男性16例,女性14例,男女比为1.14:1,平均年龄54岁(23~87岁)。
2.2 肿瘤特点
肿瘤发生部位在尾部的13例(占43.3%),肠7例(占23.3%),肠道外10例(占33.3%,包括腹腔7例、盆腔2例、腹膜1例)。
2.3 KIT基因突变分析
30例胃肠道间质瘤中,共25例检测到了KIT基因突变,且均为CD117免疫组化表达阳性,其中23例为KIT基因外显子11突变阳性,1例为外显子9突变阳性,1例外显子11与外显子13双突变,1例外显子13突变阳性。在CD117阳性的患者中,KIT基因突变率为86.2%(25/29)。所有突变均为杂合性突变。在所有外显子11的突变中,最常见的形式为缺失突变,占86.3%(19/22),单碱基突变4例,约占18.1%,最常见的突变位点为p.V559D。KIT外显子9突变1例为插入重复突变,具体类型为p.Y503_F504insAY,与以往文献报道一致。1例外显子13的突变为点突变,具体类型为p.K642E,1例双突变为外显子11缺失突变+外显子13点突变p.K642E(表2)。
2.4 PDGFRA基因突变分析
本研究纳入的30例胃肠道间质瘤标本中(包括6例KIT基因野生型标本)未检测到PDGFRA基因的突变,可能与GIST发病率较低,入组数量不足有关。文献报道PDGFRA基因的突变一般存在于KIT基因野生型GIST中,以外显子18突变为主,主要突变形式为p.D842V点突变。
2.5 KIT与PDGFRA突变与临床病理特征的相关性
KIT、PDGFRA基因突变与胃肠道间质瘤侵袭性危险度评分无明显相关性,与肿瘤体积、核分裂像、细胞形态、器官累及等特征也无明显的相关性。

表2 KIT、PDGFRA、CD117检测结果表
3.讨论
近年来,靶向酪氨酸激酶治疗在胃肠道间质瘤中扮演了越来越重要的角色,研究表明KIT与PDGFRA基因的突变与靶向治疗的疗效高度相关,KIT与PDGFRA基因的突变导致受体酪氨酸激酶的持续活化使得细胞增殖失控,因此GIST标本KIT与PDGFRA基因突变的临床检测变得越来越重要。
在本次研究中,我们回顾性地检测并分析了30例GIST标本的KIT与PDGFRA基因突变情况,并比较了基因突变与CD117表达、临床病理特征的相关性,研究结果展示了KIT与PDGFRA基因突变的突变频率、突变类型。我们的KIT基因突变率与类型基本与以往的研究报道数据接近,但未发现PDGFRA突变,可能由于PDGFRA基因的突变频率较低,而本研究入组的病例数太少有关。未来有必要进一步地扩大入组标本进行更详细的研究。另外,本次入组的病人中还检测到了1例患者同时携带2种驱动突变,该类患者的预后及对靶向治疗的反应有待未来积累更多数据进行进一步随访研究。本研究数据为胃肠道间质瘤的预后及靶向治疗提供一定的支持。

