蛋白质组学揭示宰前温和驱赶改善猪肉品质的潜在机制
邹 波,何广捷,赵 迪,闫 静,张 泽,徐幸莲,周光宏,李春保*
(南京农业大学食品科学技术学院,肉品加工与质量控制教育部重点实验室,农业农村部肉品加工重点实验室,江苏 南京 210095)
猪肉品质与宰前应激密切相关,应激来源包括生猪运输、入栏、驱赶、季节、宰杀方式等[1-3]。不当的宰前管理方式会给动物造成强烈应激[4],从而加剧机体细胞无氧呼吸程度以及肌肉能量代谢进程,导致肌肉中的糖原大量消耗,乳酸迅速积累,最终造成肌肉pH值迅速下降。较低的pH值会导致肌原纤维蛋白变性,肌肉收缩功能改变,持水力下降,大量的水分从肌肉表面溢出,在极端情况下就会形成PSE(pale, soft, exudative)肉[5-6]。
宰前驱赶是生猪屠宰过程中必不可少的过程,其涉及屠宰场的众多区域,包括卸载区域、驱赶通道以及电击区域等[7]。国内生猪驱赶基本以人工为主,并运用各种辅助工具如赶猪板、电击棍等,在宰前驱赶的方式和设备方面没有创新性的发展[8]。欧美等国家有为畜禽驱赶精心设计的专用系统,能够很好地保证驱赶过程温和地进行[9]。虽然欧美等国家在这方面设计更加精细合理,但在驱赶过程中避免不了对生猪进行恐吓与拍打。目前,大多数国家传统的驱赶方式仍然是利用电击、鞭打等方式驱赶生猪快速前行[10-11],动物应激非常严重[12]。而在大型屠宰场,由于同一时间内驱赶大批生猪,宰前驱赶应激将变得更加严重。所以,相对温和的驱赶方式更为合理,温和驱赶是指避免生猪遭遇大量或强烈的宰前应激驱赶方式,包括利用挡板让生猪自由前行的完全温和驱赶方式以及如利用声音驱赶生猪前行的其他驱赶方式[13]。然而,关于温和的驱赶方式如何减少宰前应激,进而改善肉品品质的具体机制尚未明确。所以有必要对此进行更深入的研究。
蛋白质组学是一种非常重要的现代生物鉴定技术,可以鉴定和探究一个细胞或组织所表达的全部蛋白质及它们的表达方式和调控规律,是对机体在蛋白水平定量、动态、相互作用的全面研究[14]。利用蛋白质组学对肌肉细胞中各种蛋白质的识别和定量,可确定它们在细胞内外的定位、活性和相互作用,进而探索宰前驱赶应激对肌肉细胞中催化酶或调控蛋白的调控作用,并能够有效地阐明温和驱赶改善肉品品质的机制。
因此,本实验对比研究了完全温和驱赶、声音温和驱赶及传统驱赶方式对生猪应激程度、肉品品质以及宰后肌肉能量代谢的影响,并利用蛋白质组学分析肌肉能量代谢与肌肉收缩相关的差异蛋白,旨在探索温和驱赶改善肉品品质的潜在机制,以期为企业的生产提供理论和技术指导。
1 材料与方法
1.1 材料与试剂
三元杂交公猪,180 日龄(已去势),由江苏某屠宰企业提供。
血清中肌酸激酶(creatine kinase,CK)、乳酸脱氢酶(lactate dehydrogenase,LDH)、肌糖原试剂盒、热休克蛋白70(heat shock protein 70,HSP70)、皮质醇(cortisol,CORT)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒 南京建成生物工程研究所;ATP测定试剂盒 碧云天生物技术研究所;尿素、4-羟乙基哌嗪乙磺酸(2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid,HEPES)、β-甘油磷酸钠、钒酸钠、焦磷酸钠、二硫苏糖醇、碘乙酰胺、三氟乙酸、甲酸 美国西格玛奥德里奇有限公司;胰蛋白酶美国Promega公司;SEP PAK Classic C18固相萃取柱美国Waters公司;BCA试剂盒 美国Pierce公司。
1.2 仪器与设备
M2e多功能酶标仪 美国MD公司;Avanti J-E高速冷冻离心机 美国Beckman Coulter公司;pH计 德国Testo公司;漩涡仪 上海沪西分析仪器有限公司;纯水机、LTQ-Orbitraq XL纳升级液相色谱串联质谱(nanoliquid chromatography tandem mass spectrometry,Nano-LCMS/MS) 美国Thermo公司;AUY120电子分析天平日本岛津公司;均质器破碎仪 法国Bertin公司;色差仪 日本柯尼卡美能达公司。
1.3 方法
1.3.1 实验设计及分组
完全温和驱赶(mild driving,MD)组(以下称全温组):工人不对生猪进行任何电击和拍打行为,仅利用挡板向前推进,生猪自由向静养圈以及电击区域移动;声音温和驱赶(sound driving,SD)组(以下称声温组):工人利用驱赶声音代替电击棍和皮鞭,敦促生猪向前快速行走;传统驱赶(traditional driving,TD)组(以下称传统组):根据屠宰场现有驱赶流程,生猪在电击、鞭打下进入静养和电击区域。每个处理组15 头生猪。电击晕后取其血液,3 000 r/min离心10 min取上清液,获得血清,分装后置于-80 ℃冰箱中;同时取背最长肌置于4 ℃冷库中,分别在宰后45 min和3、12、24 h取10 g肉样(去除筋膜、脂肪、结缔组织)于冻存管,并放入液氮,之后保存于-80 ℃冰箱中用于测定糖原、ATP以及蛋白质组学分析;剩余肉样置于4 ℃贮存,用于测定肉色、pH值、蒸煮损失。
1.3.2 指标测定
1.3.2.1 血清CK活力的测定
血清CK活力测定按照试剂盒说明书的操作步骤,取20 µL血清样品于2 mL离心管中,加入300 µL三磷酸腺苷和肌酸溶液,提供的试剂,混匀并37 ℃水浴,再加入100 µL钼酸铵,3 500 r/min离心10 min,之后利用定磷剂显色后,45 ℃水浴15 min,在660 nm波长处测定吸光度[15]。每个样品测3 次,取平均值。
1.3.2.2 LDH活力的测定
LDH活力测定按照试剂盒的操作步骤,取20 µL血清于10 mL离心管中,分别加入双蒸水、标准溶液20 µL,再加入基质缓冲液50 µL并于37 ℃水浴15 min,之后用250 µL 2,4-二硝基苯肼显色并在37 ℃水浴中孵育15 min,加入2.5 mL 0.4 mol/L NaOH溶液,在660 nm波长处测定吸光度[16]。每个样品测3 次,取平均值。
1.3.2.3 HSP70及CORT质量浓度的测定
HSP70及CORT质量浓度的测定按照ELISA试剂盒的操作步骤,分别将50 µL样品和标准品加入含有抗体的96 孔板中,然后加入生物抗原工作液,37 ℃孵育30 min,用洗涤液清洗5 次,拍干;加入50 µL亲和素-HRP,37 ℃反应30 min,洗板5 次,再加入显色液A、B,37 ℃显色10 min,加入终止液,450 nm波长处读取吸光度[17-18]。每个样品测3 次,取平均值。
1.3.2.4 肉的颜色测定
参照NY/T 2793—2015《肉的食用品质客观评价方法》[19]:沿肌纤维垂直方向切取厚度不低于2.0 cm的肉块,将肉样平放在红色塑料板或托盘上,新切面朝上。之后,置于-1.5~7 ℃环境中避光静置25~30 min。然后将色差仪的镜头垂直置于肉面上,镜头紧扣肉面(不能漏光)。测量时保持样品表面平整,避开结缔组织,分别记录肉样的亮度L*值、红度a*值、黄度b*值。每个样品重复3 次,取平均值。
1.3.2.5 蒸煮损失率的测定
参照NY/T 2793—2015[19]:样品在4 ℃冷库中存放24 h后取出,放在室温下平衡0.5 h。然后沿着与肌肉自然走向(肌肉的长轴)垂直的方向切取2.54 cm厚的肉块,并去除样品表面的结缔组织、脂肪和肌膜,使其表面平整。将肉块放入塑料蒸煮袋中,将温度计探头由上而下插入肉块中心,记录肉块的初始温度,将蒸煮袋口密封起来。将包装的肉块放入72 ℃水浴中,水浴液面需完全浸没肉块,袋口不得浸入水中。当肉块中心温度达到70 ℃时,立即取出肉样,冷却称质量。肉块蒸煮前后的质量损失占原质量的比例即为蒸煮损失率。每个样品测3 次,取其平均值。
1.3.2.6 pH值测定
参照NY/T 2793—2015[19]:将校准后的便携式pH计金属头直接插入肉块中(避开结缔组织、血瘀和可见脂肪),待pH计读数稳定后,读取数值。每个样品测3 次,取平均值。
1.3.2.7 糖原含量测定
按照试剂盒的操作步骤稍作改进。将肉样从-80 ℃取出,每个肉样取适量质量切碎,再准确称取90 mg放入0.27 mL KOH溶液中,沸水浴20 min,再将溶液稀释16 倍,加入显色液,沸水浴5 min,冷却后于620 nm波长处测定吸光度[20-21]。
1.3.2.8 ATP含量测定
切取100 mg肉样放入ATP裂解液中,用均质器破碎仪在低温条件下将组织匀浆。裂解后,4 ℃、12 000×g离心5 min,取上清液用于后续测定。利用ATP标准品分别配制成0.002、0.005、0.01、0.05、0.1 µg/mL的ATP标准溶液。每个样品及标准品取20 µL加入ATP工作液中,用多功能酶标仪测定每个样品的Luminometer(RLU)值[22]。
1.3.2.9 蛋白质组学分析
每组随机抽取8 头生猪,对宰后45 min样品进行蛋白质组学分析,蛋白提取采用Svinkina等[23]的方法并做适当修改。将100 mg的肉样放入10 mL的尿素裂解液(9 mol/L尿素、20 mmol/L HEPES、1 mmol/L β-甘油磷酸钠、1 mmol/L钒酸钠、2.5 mmol/L焦磷酸钠)中匀浆,之后于20 000×g离心15 min。取1 mL上清液,加入3.6 µL 1.25 mol/L二硫苏糖醇,55 ℃下还原30 min。加入20 µL 0.5 mol/L碘乙酰胺在20 ℃下烷基化15 min。之后用20 mmol/L HEPES(pH 8.0)将样品稀释4 倍,加入40 µL 1 mg/mL胰蛋白酶消化过夜。取出消化好的肽,用200 µL 20%三氟乙酸进行酸化,并用C18脱盐柱脱盐纯化。最后用2 mL洗脱液(含体积分数40%乙腈、0.1%三氟乙酸)洗脱肽段,真空干燥后,-80 ℃保存。
质谱分析按照Shi Xuebin等[24]的方法,采用LTQ-Orbitraq XL Nano-LC-MS/MS进行分析。真空干燥后的样品在130 µL体积分数0.1%甲酸溶液中充分溶解,利用Nano-LC系统将2 µg的肽段加入到C18trap column中。随后,肽段被洗脱到Acclaim PepMap®C18分析柱中,在250 nL/min流速下运行120 min。原始质谱数据用MaxQuant 1.5.0.30软件分析[25],物种为猪(Sus scrofa)(88 375 个蛋白序列)。差异表达蛋白的筛选依据是fold change不低于1.5或不高于0.667,P<0.05。
1.4 数据统计处理
采用SAS 9.2统计分析软件对血液、肉品品质指标进行单因素方差分析,用OmicsBean软件对蛋白质组学数据进行生物信息学分析。
2 结果与分析
2.1 不同驱赶方式对血液生化指标的影响
动物在正常的生理情况下,细胞没有受到损坏,其细胞膜起到屏障作用,CK与LDH主要存在于胞内;在应激状态下,细胞膜遭到破坏,两种酶会被释放进入到血液中[26]。与此同时,应激刺激大脑,进而通过边缘系统、下丘脑到达肾上腺皮质,最终导致糖皮质激素的分泌,其中就包括CORT[27]。由图1可知,与传统驱赶方式相比,全温组中CK、LDH活力以及CORT质量浓度显著下降(P<0.05),而HSP70质量浓度没有显著差异(P>0.05);声温组中CK、LDH活力均处于中间水平。赵慧等[28]研究生猪在强烈的应激情况下同样发现血液中的CK、LDH、COR含量均显著升高,龙定彪等[29]发现宰前受到较低应激的生猪,其血液中的CK、LDH活力显著下降。
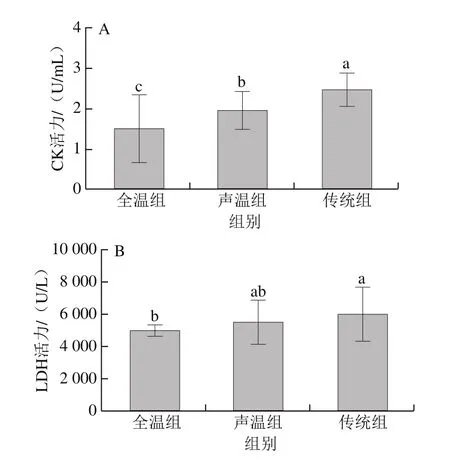
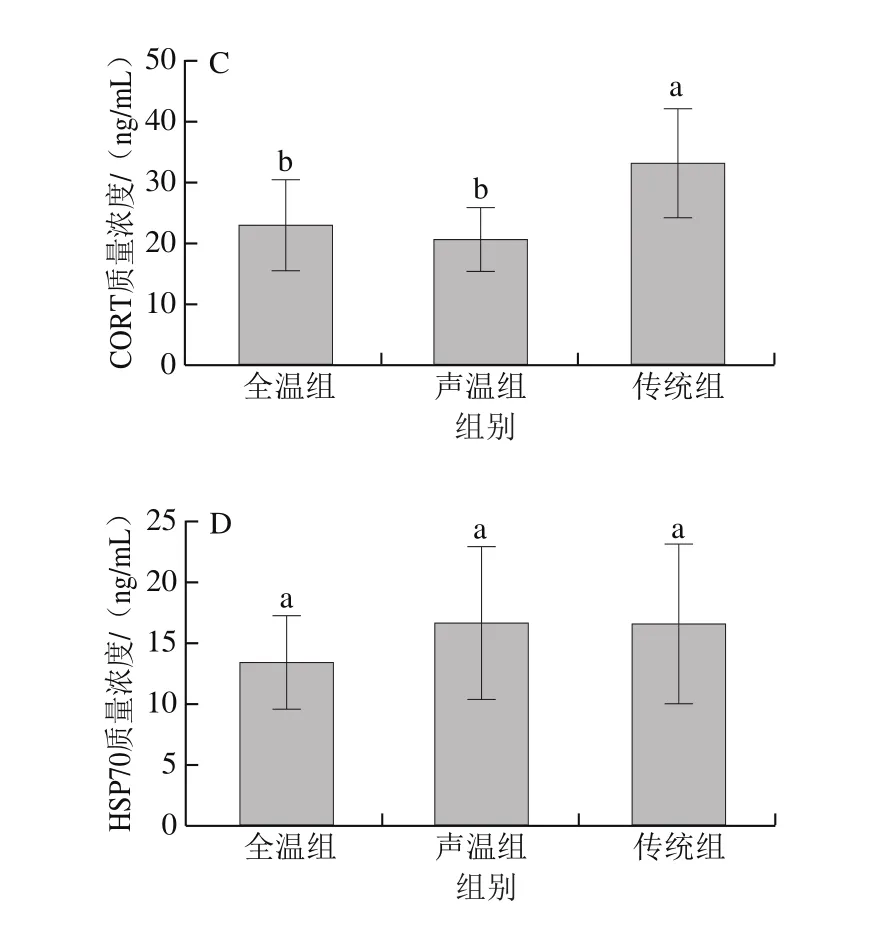
图1 不同驱赶应激下血液应激指标的变化Fig. 1 Changes in stress-related blood indicators under different driving stress conditions
2.2 不同驱赶应激对肌肉品质指标的影响
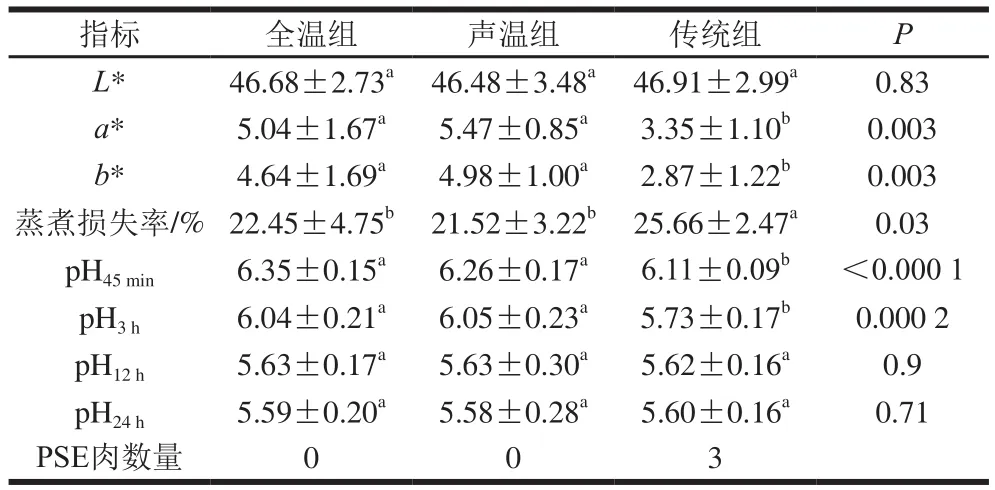
表1 不同驱赶应激对肌肉品质的影响Table 1 Effects of different driving stress treatments on muscle quality
颜色是肉的重要品质指标,会影响消费者的购买欲望[30]。由表1可以看出,全温组和声温组的红度a*值和黄度b*值都显著高于传统组(P<0.05),而亮度L*值没有显著差异。这表明传统组的肉色相对其他两组更加苍白。同样全温组和声温组的蒸煮损失率显著低于传统组(P<0.05),持水性能更好。为了更客观地反映两组之间肉品质量的差异,依据宰后45 min的pH值判定PSE肉的发生率(pH45min<6.0)[31],可以看出全温组及声温组没有PSE,而传统组为3 例。在宰后45 min和3 h后,全温组和声温组的pH值显著高于传统组(P<0.05),宰后短时间内pH值没有快速下降。宰后12 h后,pH值都处于较低的值,3 组之间没有显著差异(P>0.05)。同样朱良齐等[32]调研生猪宰前的环境对PSE肉发生率的影响,发现较为强烈的应激环境之下,PSE肉发生率较高,宰后早期pH值下降迅速。
2.3 不同驱赶应激对肌肉理化指标的影响
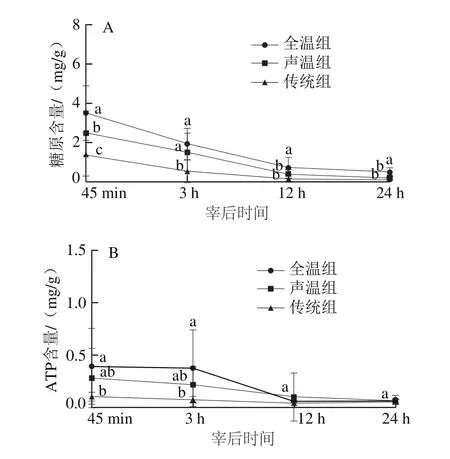
图2 不同驱赶应激下肌肉糖原和ATP含量的变化Fig. 2 Changes in muscle glycogen and ATP contents under different driving stress conditions
动物屠宰之后,其肌肉细胞氧气供应停止,细胞的呼吸方式转变为无氧呼吸。而在屠宰之前受到较大应激会导致生猪体内肌糖原和ATP消耗过度,宰后初期形成较低的pH值[31]。所以对宰后肌肉糖原和ATP的测定至关重要。宰后45 min和3 h,全温组的糖原和ATP含量显著高于传统组(P<0.05)(图2)。而声温组中的生猪由于受到一定的应激,其糖原和ATP含量处于中间水平。宰后12 h和24 h,全温组的糖原含量仍然显著高于其他两组(P<0.05),但ATP含量没有显著性差异(P>0.05)。这与Li Xiao等[33]研究结果类似,PSE肉发生率越高,糖原和ATP的含量下降迅速。
2.4 蛋白质组学分析结果
2.4.1 蛋白质组整体蛋白差异分析结果
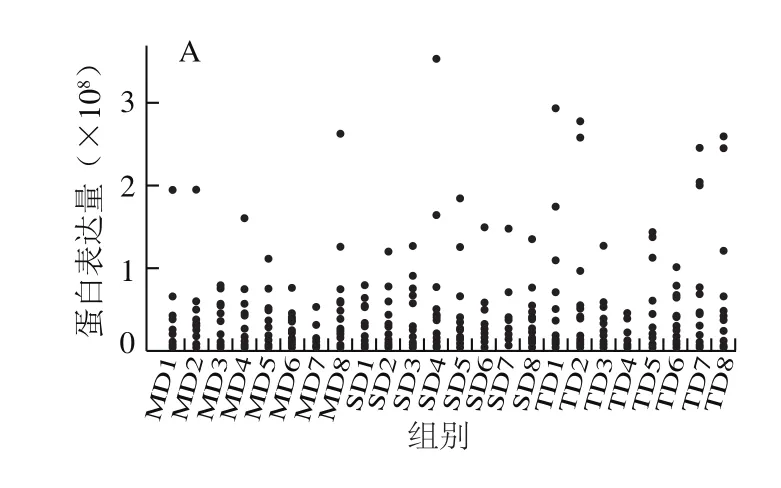
图3A为原始的蛋白表达谱,归一化处理后,蛋白表达量的中间值保持在一个标准合理的数值范围内(图3B),以进行后续分析。图3C的主成分分析图显示,全温组样品和声温组样品有一定的区分度,声温组受到一定的应激,但传统组样品与其他两组样品呈现显著差异。
2.4.2 具体差异蛋白分析结果
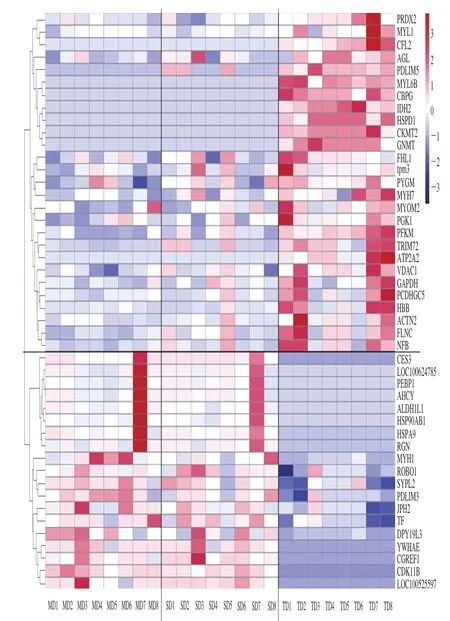
图4 差异蛋白及样品之间的差异程度Fig. 4 Analysis of proteins that differed between MD and TD groups
全温组、声温组和传统组总共鉴定到170 种蛋白,其中46 种蛋白发生差异表达。如ATP依赖性6-磷酸果糖激酶(ATP-dependent 6-phosphofructokinase,PFKM)、α-1,4-葡聚糖磷酸化酶(α-1,4-glucan phosphorylase,PYGM)、糖原脱支酶(glycogen debranching enzyme,AGL)等与能量代谢相关的蛋白以及MYH1、肌球蛋白7(myosin-7,MYH7)等肌肉收缩相关蛋白。图4显示了46 种差异蛋白在各个样品间的具体差异程度,可以看出传统组中的众多蛋白与其他两组区分明显,声温组与全温组中的一些蛋白也有差异。
2.4.3 差异蛋白生物功能分析结果
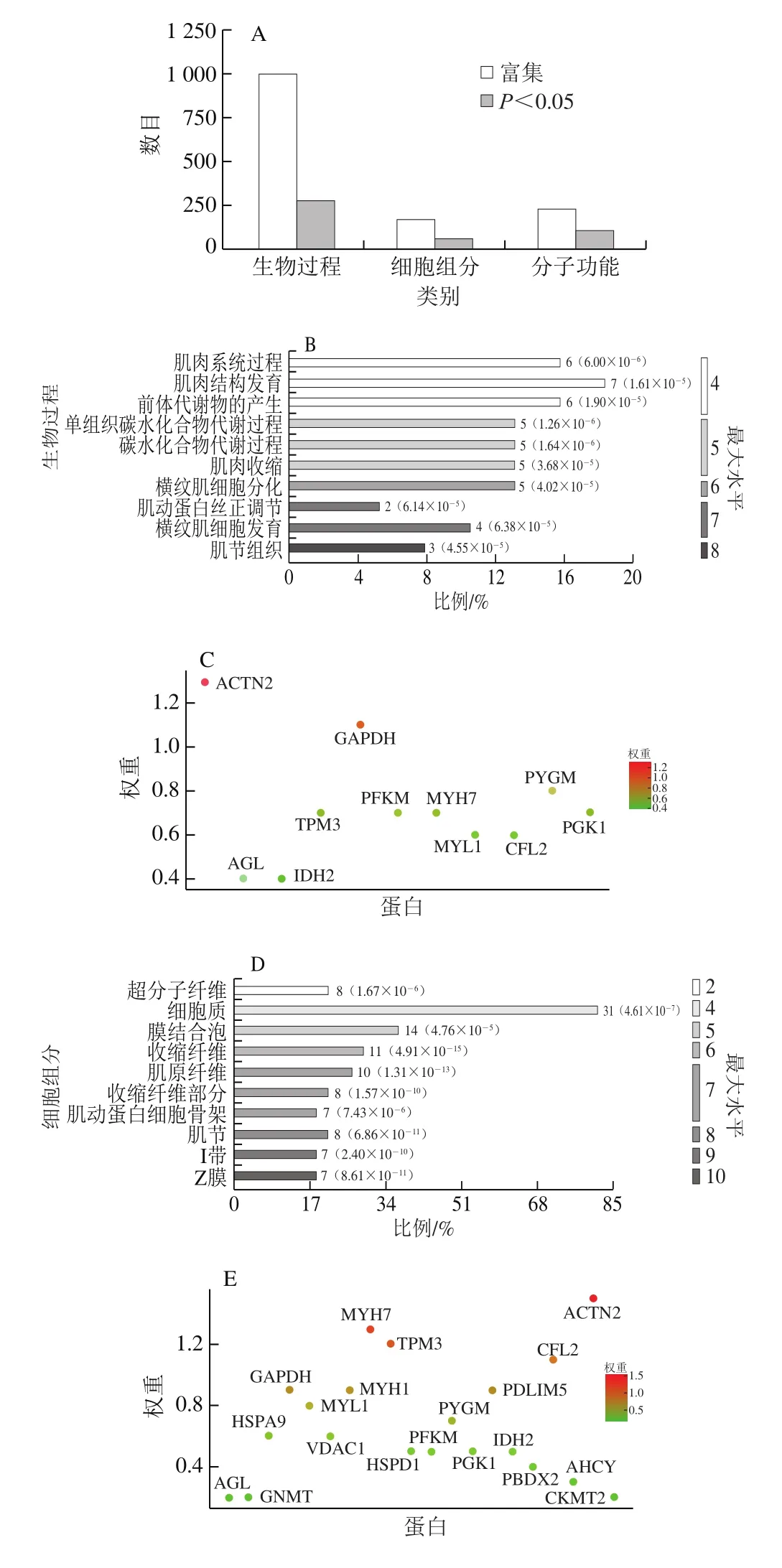
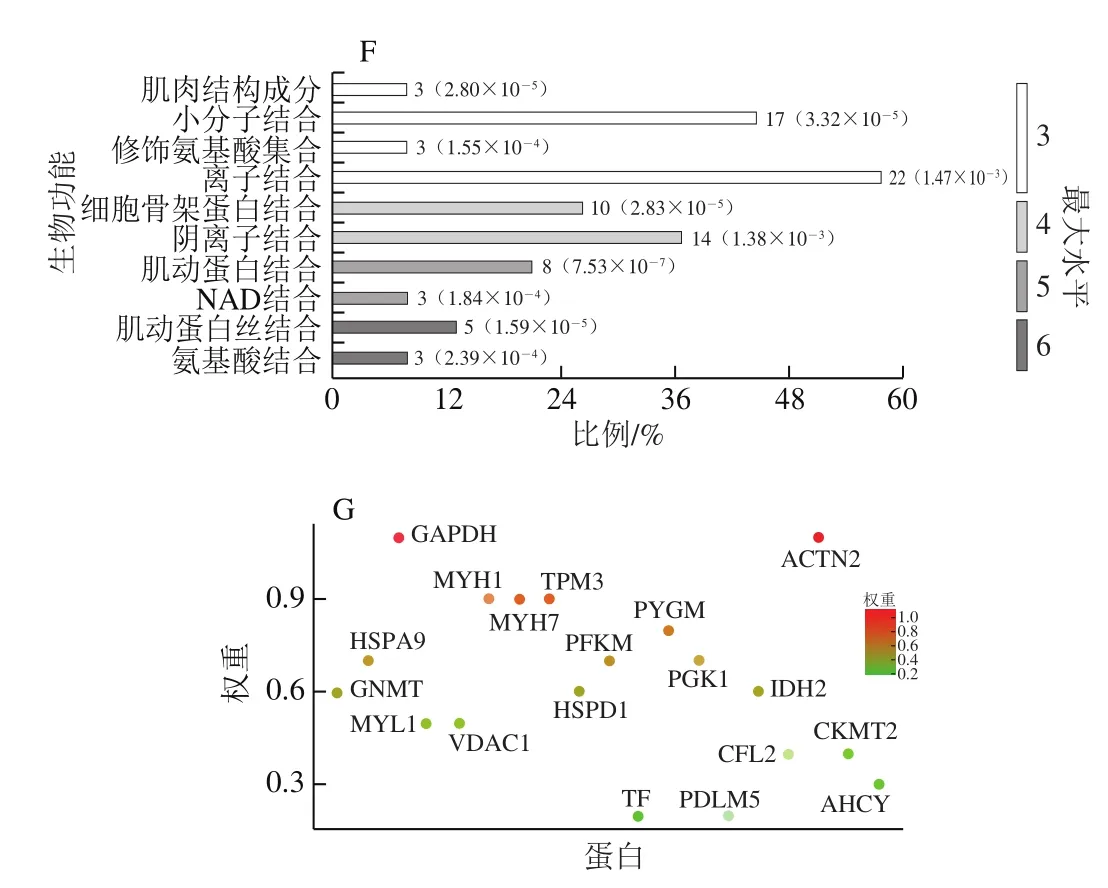
图5 差异蛋白的GO功能富集分析Fig. 5 Gene ontology enrichment of differential proteins
GO(gene ontology)富集分析表明46 个差异表达蛋白富集到的286 个生物过程、64 个细胞组分和113 种分子功能产生差异,包括碳水化合物分解代谢过程和肌肉收缩(图5A)。在生物过程方面,3 种处理组在单组织碳水化合物代谢过程、糖原分解代谢过程方面存在显著差异,这些生物过程调控能量代谢,其相关的基因(蛋白)数量为2~7 个(图5B);图5C显示,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、PYGM和PFKM等蛋白在这些能量代谢生物过程中发挥关键作用。在细胞组分方面,收缩纤维、肌原纤维等与肌肉收缩相关的细胞成分差异显著,所涉及的基因(蛋白)数在7~31之间(图5D),辅肌动蛋白α2(actinin alpha 2,ACTN2)、MYH7和原肌球蛋白(tropomyosin 3,TPM3)等蛋白对细胞组分的差异有很大的贡献(图5E)。分子功能差异显著的包括小分子结合、氨基酸结合、骨架蛋白结合等(图5F),参与的蛋白有PYGM、ACTN2、MYH1和GAPDH等(图5G)。
为了探究导致不同肉品品质形成的具体代谢通路,需要对差异蛋白进行KEGG(Kyoto encyclopedia of genes and genomes pathway analysis)通路分析。与传统组相比,完全温和处理和声音温和处理极显著改变了碳代谢、糖酵解、紧密连接等通路途径(P<0.01)(图6A)。参与调控相关代谢通路的PFKM、ACTN2、PYGM、GAPDH、TPM3、线粒体肌酸激酶2(mitochondrial creatine kinase 2,CKMT2)等蛋白下调,类突触小泡蛋白2(synaptophysin like 2,SYPL2)、钙调素(regucalcin,RGN)、MYH1上调(图6B)。
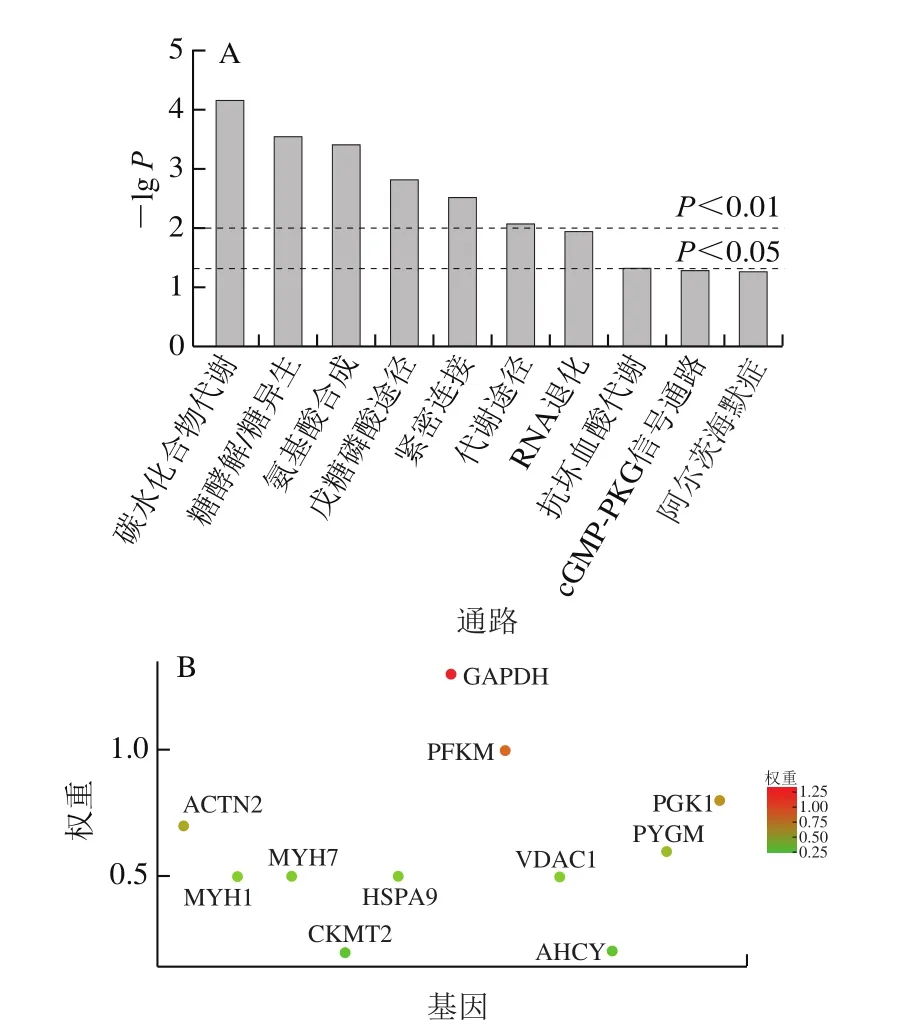
图6 差异蛋白KEGG通路分析Fig. 6 KEGG pathway analysis of differential proteins
由蛋白交互网络图分析发现23 个差异表达蛋白和10 种KEGG通路之间有相互作用。中心网络图表明与能量代谢(PFKM、AGL、异柠檬酸脱氢酶2(isocitrate dehydrogenase 2,IDH1)、CKMT2、GAPDH、磷酸甘油酸激酶1(phosphoglycerate kinase 1,PGK1)、PYGM)以及肌肉收缩相关(ACTN2、MYL1、丝切蛋白(cofilin 2,CFL2)、MYH1、MYH7、TPM3)蛋白存在众多交互作用。其中,糖酵解、碳代谢、紧密连接等通路与蛋白之间相互作用明显,参与调控肌肉品质的形成(图7)。
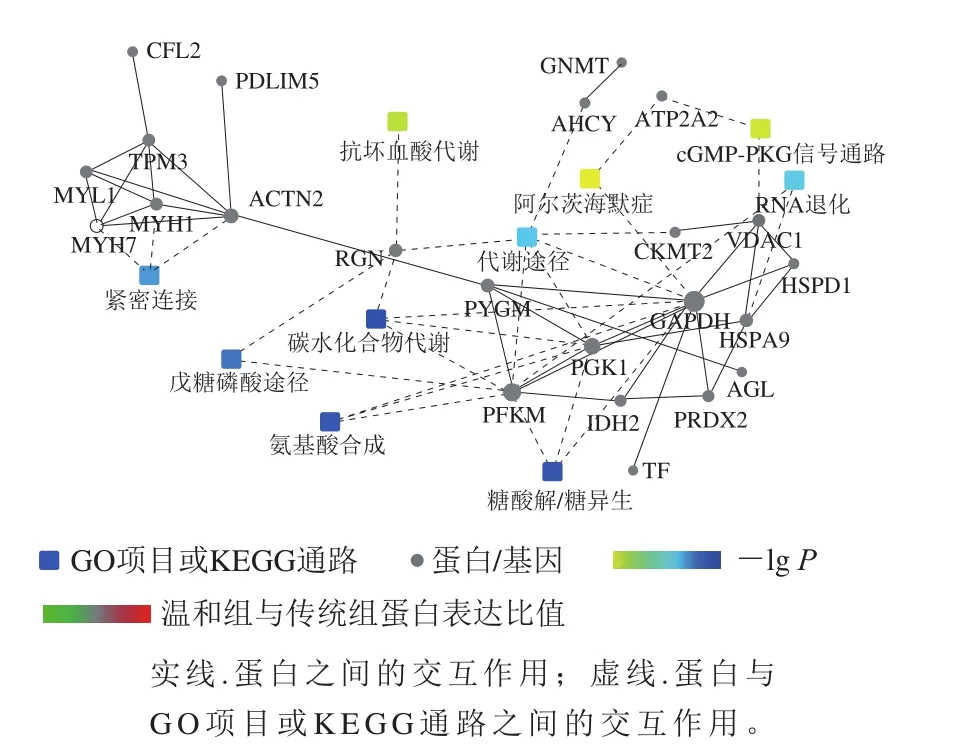
图7 差异蛋白交互网络图Fig. 7 Protein-protein interaction network of differential proteins
在全温组和声温组中,19 种上调蛋白与细胞组分及氨基酸合成代谢相关(如腺苷高半胱氨酸酶(adenosylhomocysteinase,AHCY)、RGN、PDLIM3),维持细胞正常的生物活性。例如,AHCY参与葡萄糖醛酸盐合成l-抗坏血酸的子通路的第3步,是催化抗坏血酸生物合成的关键步骤,对维持细胞的正常活性起着重要作用。另外,传统组中有27 个上调蛋白与能量代谢和骨骼肌调节相关(PFKM、PYGM、GAPDH、PGK1、AGL、LDH2、ACTN2、TPM3、MYL1、CFL2)。PFKM通过ATP催化D-果糖6-磷酸为果糖-1,6-二磷酸,这是糖酵解的第一个关键步骤[34-35]。PYGM和AGL参与调节糖原代谢、葡萄糖代谢等多种能量通路,其表达量的增加将促进肌肉能量代谢进程[36-37]。GAPDH是3-磷酸甘油醛氧化反应的催化酶,此反应是D-甘油醛-3-磷酸合成丙酮酸第一步子途径,对糖酵解途径的进程起到重要的调控作用。GAPDH能够催化3-磷酸甘油醛氧化脱氢并磷酸化生成含有1 个高能磷酸键的1,3-二磷酸甘油酸,脱下的氢和电子转给脱氢酶的辅酶NAD+生成NADH+和H+。传统组中GAPDH表达量的增加促进了3-磷酸甘油醛氧化反应。PGK1是催化1,3-二磷酸甘油酸的高能磷酸键转移反应的关键酶。在PGK1的催化下,1,3-二磷酸甘油酸将会生成3-磷酸甘油酸,同时其C1上的高能磷酸根转移给ADP直接生成ATP。此激酶催化的反应是可逆的,也是D-甘油醛-3-磷酸合成丙酮酸的子途径的第2步。传统组肌肉中PGK1催化酶表达量的增加能够将经过GAPDH加速催化后的糖酵解途径进一步加速催化,底物向丙酮酸的转化速率不断加快。IDH2和CKMT2也参与能量代谢,调控肌肉品质形成。以上结果表明,传统驱赶产生强烈的驱动应激会导致肌肉当中PFKM、PYFM、GAPDH、PGK1、AGL、IDH2、CKMT2等蛋白的高表达,进而加速能量代谢。相反,完全温和驱赶和声音温和驱赶可以缓解宰前应激,抑制能量代谢相关蛋白的高表达,缓解能量代谢速率。与此同时,肌肉收缩相关蛋白也参与调控肉品品质的形成。ACTN2和MYH7与肌动蛋白结合和钙离子结合有关,对肌肉收缩有重要影响。传统组中这两种上调蛋白可能改变肌肉的收缩功能,导致持水力下降,进而影响肉品质量。另外,声音温和组中GAPDH、AGL、PYGM等能量代谢相关的蛋白的表达量高于完全温和组,这说明从蛋白组角度分析,声音驱赶还是造成生猪一定程度宰前应激并加速了糖原和ATP的部分消耗。Kiran等[38]对宰后牛肉的蛋白质组进行研究,发现丙酮酸脱氢酶E1组分亚单位、PGK1和磷酸甘油酸突变酶2在急性宰前应激下表达量升高,加速糖酵解过程。另外,以往的蛋白质组研究也表明不同宰前管理方式影响与能量代谢和肌肉收缩相关的蛋白表达[39]。然而,不同类型的应激可能导致不同的蛋白质表达,特别是能量代谢和肌肉收缩相关蛋白,这需要进一步的研究来解释其潜在机制。综上所述,完全温和驱赶和声音温和驱赶降低了参与能量代谢和肌肉收缩相关蛋白的表达,减缓了肌肉糖原和ATP的消耗,维持了宰后肌肉正常的pH值。正常的pH值以及相对较低表达的肌肉收缩相关蛋白保证了温和组肌肉良好的持水能力和正常的肉色,减少PSE肉的发生率(图8)。
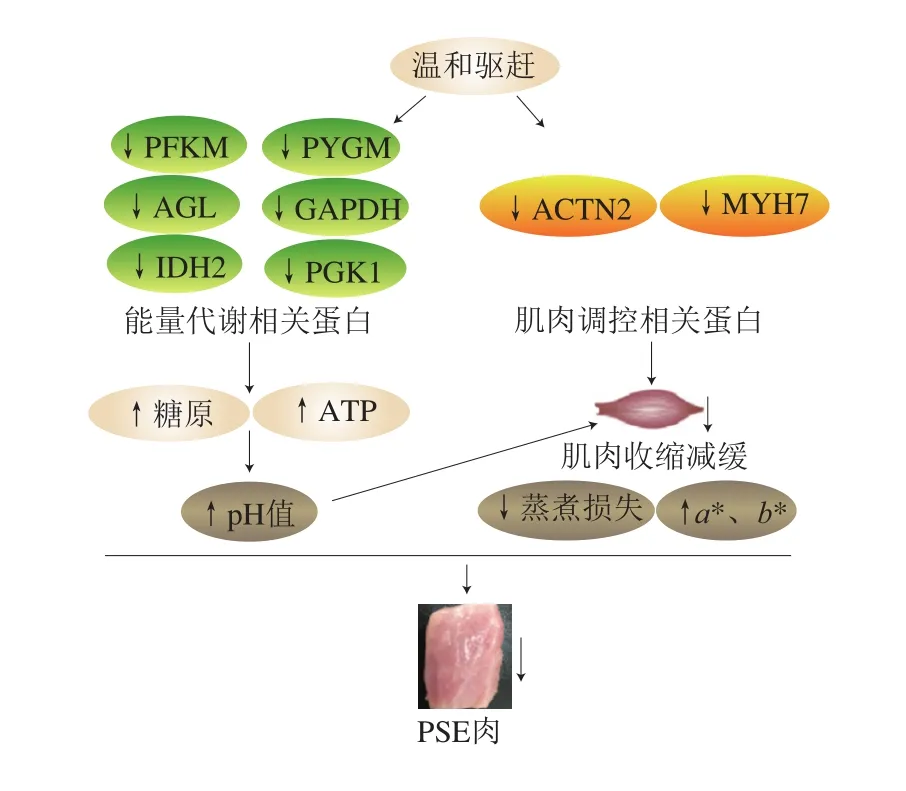
图8 温和驱赶改善猪肉品质的潜在机制Fig. 8 Mechanism for improving pork quality by mild driving
3 结 论
本实验对比研究了完全温和驱赶、声音温和驱赶和传统驱赶这3 种方式对生猪血液应激指标和肉品质的影响。发现相对于传统驱赶,完全温和驱赶和声音温和驱赶能够有效降低生猪血液应激相关的酶活性,并降低肌肉中能量代谢和肌肉收缩相关蛋白的表达,减缓宰前肌肉能量的快速消耗,从而降低PSE肉的发生率。与此同时,声音温和驱赶也会带来一定程度上的应激。因此,肉品生产企业应当重视生猪宰前管理中的驱赶环节,做出必要的改进以减少生猪在此环节的应激反应,提升肉品质。

