不同浓度氯化钾对洛川县苹果树腐烂病菌的影响
刘向阳,李前进,常爱莉,王娜娜,张海鹏,任小玲
(陕西省洛川县苹果研发中心,陕西 洛川 727400)
苹果树腐烂病的发生严重影响树势,降低苹果产量和品质。该病轻度发生时,引起果树枝干树皮腐烂和小枝枯死,严重发病时引起主枝、主干树皮大面积腐烂,整树枯死甚至毁园,造成重大的经济损失[1]。洛川县作为陕西优质苹果的主产区,其75%以上的苹果树龄已达到10年以上,正值苹果腐烂病的高发期,成为苹果产业发展的主要障碍,已构成苹果安全生产的隐患[2]。目前,苹果树腐烂病的发生和流行原因尚不十分明确,在生产实践中缺乏有效的防治对策。本研究对洛川县不同镇村的苹果树腐烂病进行采样,初步了解其生物学特性,再挑选3 种不同采集地不同生物学特性的苹果树腐烂病菌分离株,通过不同浓度氯化钾处理,探究不同浓度氯化钾对苹果树腐烂病菌的影响,为苹果树腐烂病的防治提供理论依据。
1 材料与方法
1.1 供试菌株的采集和分离
2018年11月在陕西洛川县的槐柏、土基、石头、老庙、旧县、永乡等镇采集苹果树腐烂病的病枝和病皮,按常规的组织分离法[3]分离,经单胞分离后选出在PDA培养基上培养性状不同的3 个分离株作为研究对象。将接种不同分离株的PDA 平板放置25 ℃条件下培养,从第24 h 开始每24 h 观察菌落的颜色、形状、气生菌丝的疏密程度,直到菌落长满皿(规格为75 mm),继续培养并记录子实体形成的时间。
1.2 不同浓度氯化钾对菌丝生长的影响
分别称取氯化钾1、5、10、15、20 g,土豆200 g,加蒸馏水1 000 mL沸水煮30 min,过滤上清液,加入蒸馏水补至总体积1 000 mL;加琼脂20 g煮至琼脂融化,再加入蒸馏水补至总体积1 000 mL;加入称取好的氯化钾1 g搅拌均匀,以121 ℃、30 min高温灭菌,并备注K=1 000 mg/L。同理,将其他4 个称量的氯化钾加入培养基中,依次标注K=5 000 mg/L、K=10 000 mg/L、K=15 000 mg/L、K=20 000 mg/L;不放氯化钾的普通培养基标注CK。共6个处理,3次重复。供试菌株为槐柏镇上兰村分离的(1)、旧县镇分离的(8)和菩建乡分离的(9)。
1.3 不同浓度氯化钾处理的分离株对枝条感病的影响
在塔里木大学校园内园艺实验站后的果园于中午12—13 时采集健康且生长一致的苹果树枝条,截成15 cm 长小段,用蒸馏水冲洗3 遍,之后用75%酒精擦拭,再用无菌水冲洗3 遍;用无菌打孔器在酒精灯上烧热后在枝条上打出5 mm 圆形伤口,将不同浓度氯化钾处理的苹果腐烂病菌用打孔器打成5 mm 菌饼接种在伤口处;每个枝条接种1 个菌饼,每个浓度处理3 个枝条,之后将枝条放入消毒盘中,并倒入适量无菌水以保湿,最后用保鲜膜将消毒盘口封住,在25 ℃全光照培养箱中培养观察。
1.4 测定项目与方法
1.4.1 发病率计算
计算接种不同浓度氯化钾处理的苹果腐烂病菌于苹果树枝条的发病率,计算公式如下:
枝条发病率(%)=发病组织数/接种组织数×100
1.4.2 采用十字交叉法测(枝条组织)病斑扩展速度
测定不同浓度氯化钾对苹果腐烂病菌扩展速度以及接种不同浓度氯化钾处理的苹果腐烂病菌于苹果树枝条的病斑扩展速度采用十字交叉法。计算公式如下:
病斑扩展速度=(病斑直径a+病斑直径b)/2/扩展天数
1.4.3 采用区域分割法计算累计产孢量
测定不同浓度氯化钾对苹果腐烂病菌累计产孢量的影响,采用区域分割法。具体方法如下:先通过规格为75 mm 培养皿中心画两条垂直的线段,再在横向纵向各画两条平行等距的线段,这样就把培养皿划分成16 个区域,计数产孢量时,统计每个区域孢子数,再把每个区域的孢子数相加便得到累计产孢量[4。
1.5 统计与分析方法
统计数据釆用DPS 软件进行分析,处理间的差异显著性釆用Duncan’s multiple Range Test 进行。
2 结果与分析
2.1 不同菌源地菌株的分离与培养
观察结果(表1)表明:各培养基中菌落直径为78~87 mm,平均值为84.5 mm。各分离株在PDA 培养基上均能生长,培养特征差异较大。各分离株菌落边缘均为放射状;槐柏镇不同村的分离株菌落颜色和气生菌丝量差异较大;分离株3、4、8 的菌落颜色相同,菌落直径和气生菌丝量(3 与4、5、8)差异明显,分离株8 至第3天无子实体产生;分离株2 和5 菌落颜色和气生菌丝量接近(仅菌落边缘颜色存在细微差别);分离株6-1、6-3、7、9、10 菌落边缘颜色均为白色,中心颜色差异较大,分离株7 和10 至第3 天均无子实体产生。
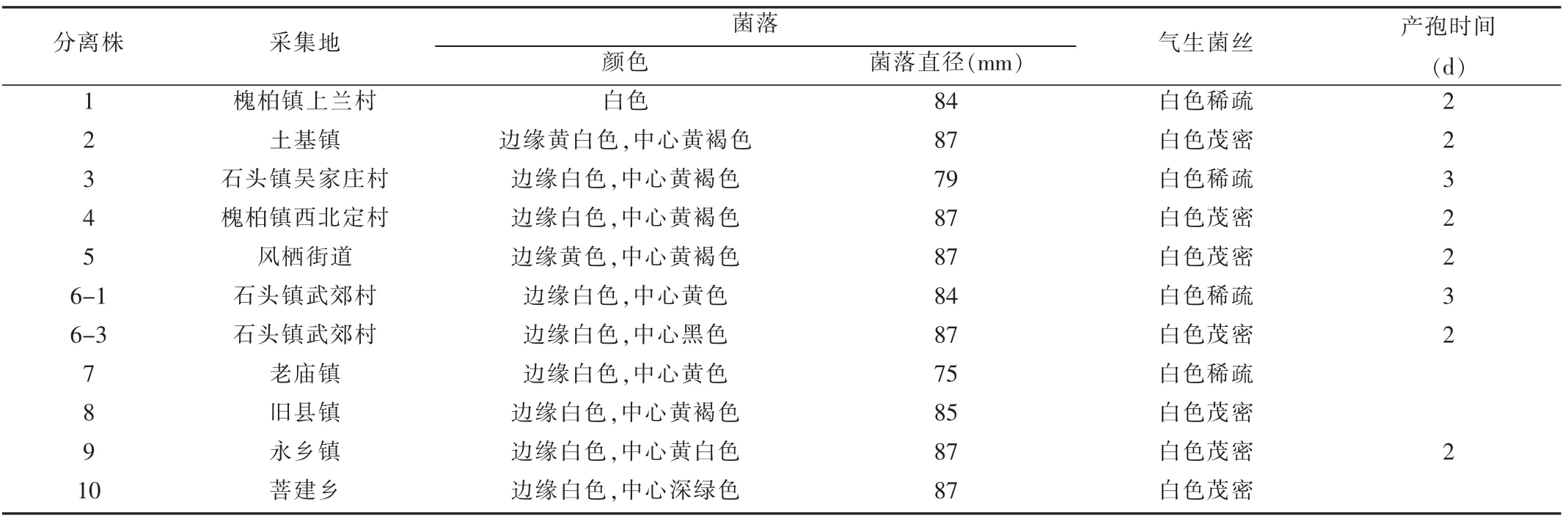
表1 各分离株在PDA 培养基上的菌落特征
2.2 不同浓度氯化钾对分离菌株生长的影响
2.2.1 不同处理时间不同浓度氯化钾对苹果树腐烂病菌的影响
观察结果(表2)表明,随着处理时间的加长,不同分离株的生长量增加;随着培养基中氯化钾浓度的升高,不同分离株1、8、9 菌落生长量和产孢量出现下降。当氯化钾浓度为20 000 mg/L 时,不同分离株菌丝生长速度明显下降,菌株1、8、9 在24 h 时为0.1、0 和0 cm;当氯化钾浓度为10 000 mg/L 时,菌株1、8、9 产孢量出现明显下降,分别为360、387 和354,明显低于对照。培养基中氯化钾含量对苹果树腐烂病病原菌菌丝生长及产孢有明显的抑制作用。
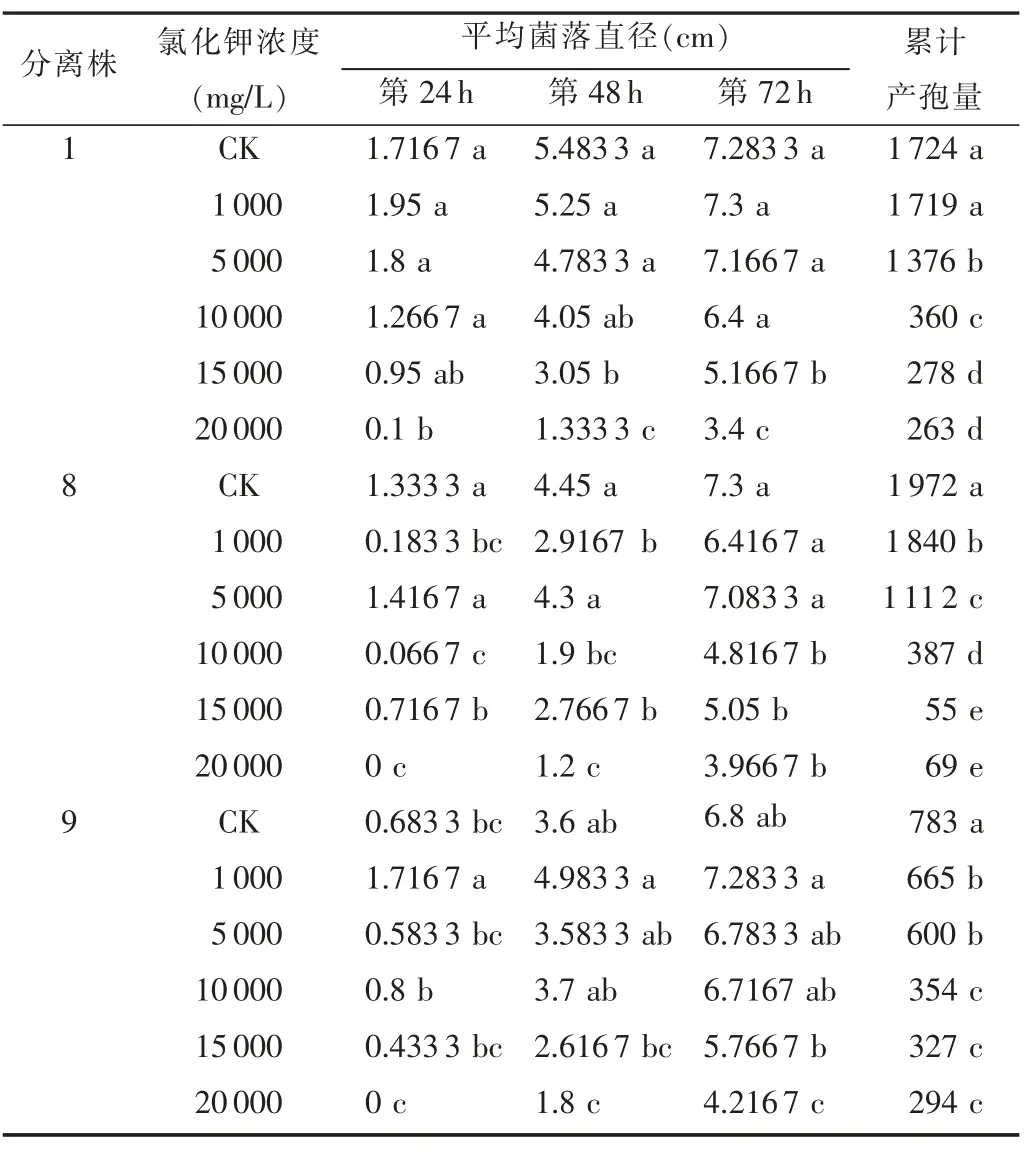
表2 不同浓度氯化钾对不同分离株菌丝生长和产孢量的影响
2.2.2 不同浓度氯化钾在48 h 时对苹果腐烂病菌落直径的影响
观察结果(图1)表明:3 个分离株随着氯化钾浓度增大,平均菌落直径呈下降趋势,浓度为15 000 mg/L 和20 000 mg/L 时,3 个分离株的平均菌落直径最为接近,对3 个分离株生长的抑制程度大致相同。分离株1 随着氯化钾浓度的升高平均菌落直径呈平滑下降趋势,氯化钾浓度越高对生长抑制越强,即浓度为0 时平均菌落直径最大;分离株8 随着氯化钾浓度的升高平均菌落直径上下浮动,但整体呈下降趋势,高浓度对生长有抑制作用,浓度为0 时平均菌落直径最大;分离株9在氯化钾浓度为1 000 mg/L 时平均菌落直径最大,然后随浓度的升高平均菌落直径呈下降趋势,即氯化钾浓度越高越抑制分离株9 的生长。由此说明,较高浓度氯化钾能够抑制苹果树腐烂病菌的生长。
2.2.3 不同浓度氯化钾对苹果腐烂病菌产孢量的影响
观察结果(图2)表明,随着氯化钾浓度的升高,3个苹果腐烂病菌分离株的产孢量均呈逐渐下降趋势,说明氯化钾能够抑制苹果腐烂病菌株产孢。氯化钾浓度为0时累计产孢量最大,浓度为10 000 mg/L时3个苹果腐烂病菌分离株的产孢量在同一水平;浓度为20 000 mg/L时累计产孢量最小。
分离株1 在氯化钾浓度为0、1 000 mg/L时,累计产孢量无显著性差异;浓度为15 000 mg/L和20 000 mg/L时累计产孢量也无显著性差异,但浓度为5 000 mg/L和10 000 mg/L的累计产孢量差异显著。
分离株8在氯化钾浓度为15 000、20 000 mg/L时累计产孢量无显著性差异,但与浓度为0、1 000、5 000、10000mg/L的累计产孢量差异显著。
分离株9 在氯化钾浓度为1 000、5 000 mg/L时累计产孢量无显著性差异;浓度为10000、15000、20000mg/L时累计产孢量也无显著性差异,但与浓度为0 时的累计产孢量差异显著。
氯化钾浓度为10 000 mg/L 时对于苹果树腐烂病的产孢量抑制率较大,而15 000、20 000 mg/L 与之相比变化不大。由此说明,浓度为10 000 mg/L 即可达到良好的抑制率。
2.3 不同浓度氯化钾对苹果腐烂病菌致病性的影响
观察结果(表3)表明,不同浓度氯化钾苹果腐烂病菌均能使苹果树枝条发病,且显症时间均为第3 天。产孢体出现时间和病斑扩展速度无显著性差异,变化趋势不明显;发病特征上有明显差异。
分离株1 接种到苹果树枝条上后,氯化钾浓度为0、1 000、5 000 mg/L 的枝条发病特征相同,白色菌丝较多;浓度为10 000、15 000、20 000 mg/L 的枝条发病特征相同,白色菌丝较少,与浓度为0、1 000、5 000 mg/L的枝条发病特征有明显差异。
分离株8 和分离株9 接种到苹果树枝条上后,氯化钾浓度为0、1 000、5 000 mg/L 的枝条发病特征相同,枝条较干枯,白色菌丝较少;浓度为10 000、15 000、20 000 mg/L 时,分离株8 接种的枝条发病特征大致相同(白色菌丝较多),分离株9 接种的枝条发病特征大致相同(白色菌丝较少),二者的发病特征有明显差异,与浓度为0、1 000、5 000 mg/L 的枝条发病特征也有明显差异。
由此可知,不同浓度氯化钾对于苹果树腐烂病的致病性影响并无差异,但会影响其发病特征。
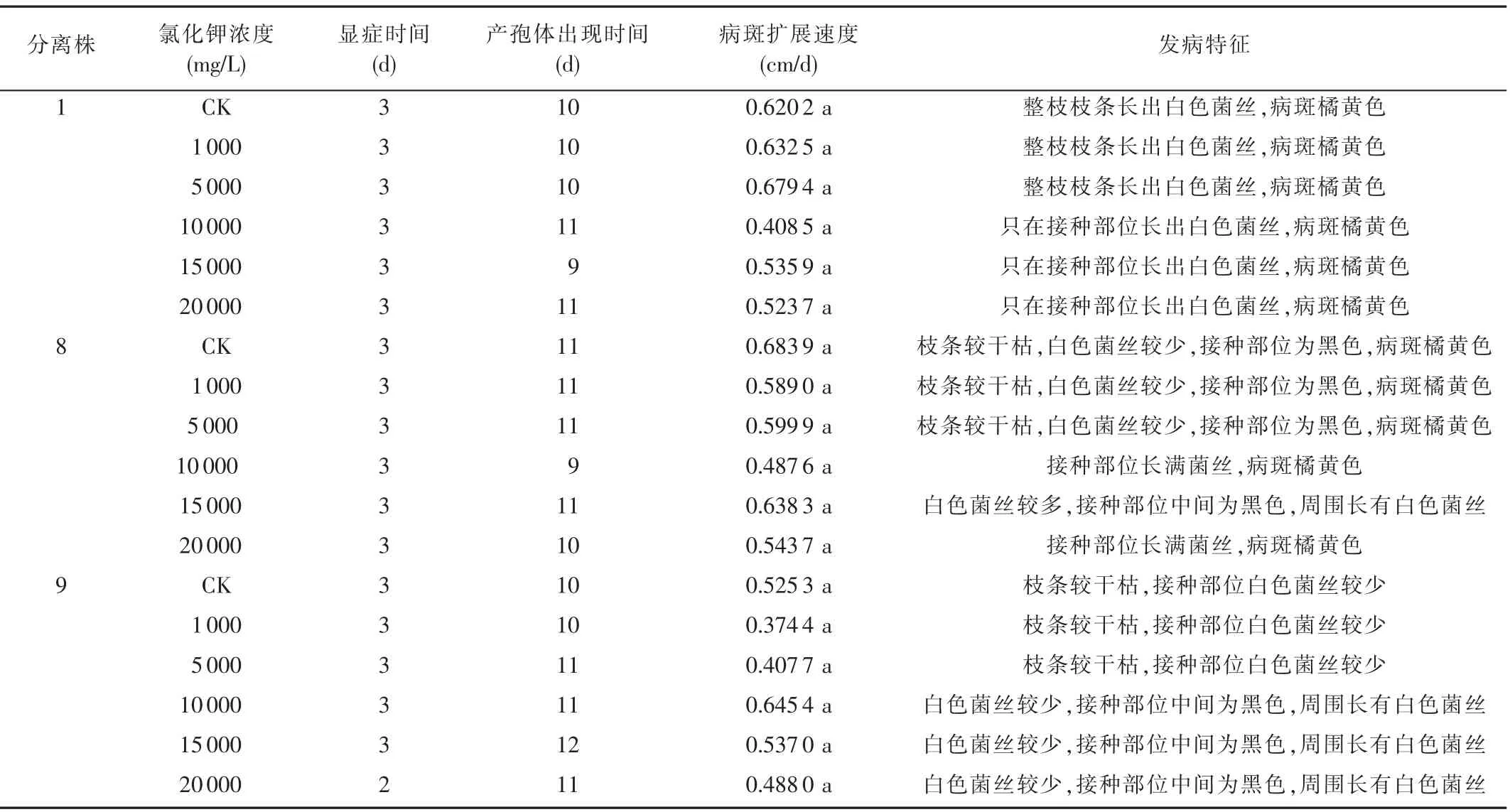
表3 不同浓度氯化钾处理的苹果腐烂病菌对苹果树枝条的致病性测定
3 讨论
将洛川县不同采集地的3 种苹果腐烂病菌分离株,在不同浓度氯化钾培养基中培养72 h,均能生长和产孢。48 h 时随着氯化钾浓度的升高,平均菌落直径整体呈下降趋势,且存在显著性差异;产孢量随着氯化钾浓度的升高呈逐渐下降趋势。说明氯化钾浓度越高越抑制苹果树腐烂病菌分离株的生长和产孢。与王金友等[5]研究(树皮含钾量与苹果树腐烂病发生程度之间呈极显著负相关)、季兰等[6]研究(苹果树腐烂病病害程度与土壤钾含量呈显著的负相关)、杨文渊等[7]研究(土壤钾含量与苹果树腐烂病发生程度呈极显著负相关)的结论基本一致。
不同浓度氯化钾处理的苹果腐烂病菌均能使健康的苹果树枝条发病,产孢体出现时间和病斑扩展速度与氯化钾浓度无显著性差异,即变化趋势不明显。与孙广宇等[8]研究(结果钾含量提高时,组织抗腐烂病菌扩展能力提高的结果有明显差异,钾在植物抗病性中具有重要作用,钾的缺乏导致低分子量的碳水化合物和可溶性氮含量提高,进而抗病性降低[9])的结论基本一致。
本研究表明,随着氯化钾浓度的升高,发病程度减轻,说明氯化钾会抑制苹果树腐烂病的发生,减轻苹果树腐烂病病害的危害程度。

