Fe2O3-CeO2/生物炭活化过硫酸盐处理有机污染物
仙 光,李乾岗,张光明,阳 帆,魏 婷,张 毅,邹志国
(1.中国人民大学环境学院,北京100872;2.陆军勤务学院军事设施系,重庆401311;3.山东公用控股有限公司,山东济宁277200)
以染料为代表的难降解有机物具有潜在致畸致癌性和毒性,传统水处理方法难以有效处理〔1〕。活化过硫酸盐(PS)工艺可产生强氧化性硫酸根自由基(),有效分解此类物质。
Fe 氧化物常被用于活化PS,但其催化能力有限〔2〕。在Fe 氧化物中掺入Ce 可提高催化剂储释氧能力和氧空位数量,增强催化活性〔3〕。然而,易团聚、金属离子易溶出等问题依旧存在〔4-5〕。在催化剂中引入比表面积大、孔结构发达、氧官能团丰富的生物炭载体有助于缓解上述问题,不仅能分散和稳定金属组分,减少团聚和组分流失,而且能集聚污染物〔5-6〕。但目前鲜有关于铁铈氧化物与生物炭结合活化PS 的报道。
本研究制备了生物炭负载的铁铈氧化物(Fe2O3-CeO2/BC)催化剂,用于活化PS 处理典型难降解有机染料。考察了催化剂表面性质和催化性能,探讨了反应条件的影响和对多种污染物的去除效果,以期为PS 体系高效去除难降解有机污染物提供新的思路。
1 材料与方法
1.1 实验主要药品
实验药品均为分析纯,Na2S2O8、CeO2、Fe2(SO4)3、C6H8O7·H2O、Fe(NO3)3·9H2O、Ce(NO3)3·6H2O、FeSO4·7H2O,购于国药集团化学试剂公司;有机染料酸性橙7(AO7)、甲基橙(MO)、罗丹明B(RhB),购于天津福晨化学试剂公司。 实验用水为去离子水, 生物炭(BC)制备原料为稻壳粉,自然湖水取自河北省白洋淀。工业废水取自华北某印染企业处理出水,COD在30~80 mg/L,pH 约为7.8。
1.2 催化剂的制备
BC 制备采用限氧焙烧法。将过0.85 mm 孔径筛的稻壳粉于氮气气氛下500 ℃焙烧6 h,用1 mol/L盐酸浸泡12 h 去除灰分,水洗至中性后烘干、研磨。
Fe2O3-CeO2制备采用溶胶凝胶法〔7〕。取适量CeO2和一水合柠檬酸,溶解,常温磁力搅拌2 h,加入、Ce、柠檬酸物质的量比为1∶1∶2),60 ℃搅拌至水蒸干,胶状物于80 ℃干燥过夜后在马弗炉中500 ℃焙烧4 h,水洗,研磨。
通过改进的浸渍-沉淀法〔5〕制备Fe2O3-CeO2/BC。取2 g BC 加入到100 mL 0.12 mol/L溶液中,将混合液在50 ℃下搅拌24 h,浸渍后产物洗净,常温自然干燥,于马弗炉中300 ℃焙烧2 h,获得CeO2/BC。 取1.5 g CeO2/BC 置于50 mL 0.82 mol/L 的Fe2(SO4)3溶液中,磁力搅拌条件下逐滴加入NH3·H2O 至pH 达12,80 ℃下继续搅拌1 h,沉淀物水洗至中性,烘干,于马弗炉中300 ℃焙烧2 h,研磨获得Fe2O3-CeO2/BC 粉末。
1.3 催化剂的表征
采用SmartLab 多功能衍射仪(日本理学公司)对催化剂进行X 射线衍射(XRD)表征;通过扫描电子显微镜(SEM,JSM-6700F,日本JEOL 公司)观察催化剂形貌结构;比表面积测定使用中国贝士德仪器科技有限公司3H-2000PS2 型比表面积分析仪;利用X 射线光电子能谱(XPS,K-Alpha X,美国Thermo Scientific 公司)分析催化剂表面元素化学态;采用固体添加法检测催化剂表面零电位点〔8〕。
1.4 污染物降解实验
向100 mL 20 mg/L 调节好pH 的污染物溶液中同时加入催化剂和PS 溶液,常温磁力搅拌,间隔一定时间用注射器取样3 mL, 经0.22 μm 滤头过滤后,用紫外可见分光光度计测定计算污染物浓度。AO7、MO、RhB 检测波长分别为484、464、554 nm。
催化剂重复利用研究中,每次降解反应结束后溶液用0.22 μm 滤膜抽滤,回收催化剂,经乙醇和去离子水清洗,烘干,再次用于污染物降解反应。
2 结果与讨论
2.1 Fe2O3-CeO2/BC 催化剂的表征
对Fe2O3-CeO2/BC 进行了表征,结果见图1。

图1 Fe2O3-CeO2/BC 催化剂的表征
图1 (a)为Fe2O3-CeO2/BC 的XRD 图谱。可以看出,材料中有明显的Fe2O3(JCPDS#25-1402)和CeO2(JCPDS#89-8436)特征峰,无杂质峰,由于生物炭为无定形态,图谱中也未出现尖锐强烈的碳特征峰〔9〕,上述结果表 明 成 功 制 备 了Fe2O3-CeO2/BC 催化剂。
图1(b)为放大500 倍的SEM 图,内嵌图则为放大2 000 倍的SEM 图。可见Fe2O3-CeO2/BC 呈蓬松不规则形状,表面有大量栅格状凹陷。放大2 000 倍后可见,Fe2O3-CeO2/BC 具有丰富的孔洞结构,表面分散着很多铁铈氧化物细小颗粒,这一结果表明,BC载体为金属活性组分的分散提供了丰富的场所。测定结果显示Fe2O3-CeO2/BC 的比表面积达47.2 m2/g,大大高于铁或铈氧化物,如商用Fe2O3比表面积仅为4.85 m2/g〔10〕,Fe3O4-CeO2比表面积为35.2 m2/g〔5〕,进一步证实了BC 的存在显著提高了催化剂的比表面积,利于吸附和催化反应的进行。
图1(c)是Fe2O3-CeO2/BC 的Fe 2p XPS 图谱,结合能711.4 eV 和725.1 eV 的主峰分别为Fe(Ⅲ)的2p3/2峰和2p1/2峰,同时还存在Fe(Ⅱ)的峰(Fe 2p3/2710.2 eV,Fe 2p1/2723.8 eV),表明催化剂表面铁元素以正二价和正三价的形态共存。同样,图1(d)表明Fe2O3-CeO2/BC 表面不仅存在Ce(Ⅳ),还存在Ce(Ⅲ)(Ce 3d5/2883.6 eV,Ce 3d3/2901.9 eV)。Ce(Ⅲ)对Fe2O3-CeO2/BC 的催化活性具有重要意义:一方面,Ce(Ⅲ)可通过反应将催化剂表面Fe(Ⅲ)还原为低价态的Fe(Ⅱ),从而进一步活化PS 产生;另一方面,Ce(Ⅲ)的存在表明催化剂结构中含有大量氧空位,提高了催化剂的储氧释氧能力,氧气和晶格氧可分别从催化剂表面和内部通过扩散将空位填充〔11〕,进而转化为活性氧进攻污染物〔3〕。
2.2 Fe2O3-CeO2/BC 活化PS 去除AO7
为考察Fe2O3-CeO2/BC 活化PS 的效果,在AO7初始质量浓度为20 mg/L,PS 为3 mmol/L,催化剂0.9 g/L,pH=6 条件下开展了不同体系去除AO7 的实验,结果见图2。

图2 不同体系对AO7 的去除效果
由图2 可知,单独PS 很难氧化去除AO7,单独Fe2O3-CeO2/BC 对AO7 的吸附为11.6%,相比之下Fe2O3-CeO2/BC+PS 体系则可在100 min 内去除66.5%的AO7,表明Fe2O3-CeO2/BC 是有效的PS 催化剂。
同时,从图2 还可以看出,Fe2O3-CeO2和BC 分别活化PS 对AO7 的去除率只能达到36.1%和15.8%, 两者对AO7 去除率之和大大低于Fe2O3-CeO2/BC+PS 体系,表明Fe2O3-CeO2与BC 的结合明显改善了催化性能,Fe2O3-CeO2和BC 之间存在协同作用。 一方面,PS 不断被Fe、Ce 组分活化产生,伴随生成部分·OH,共同进攻污染物〔3〕;另一方面,BC 载体增大了催化剂的比表面积,使得铁铈氧化物活性组分充分分散,不仅提高了催化剂表面活性位点数量,而且利于催化剂对污染物的吸附,加快降解反应的进行。此外,BC 表面的羧基、羟基位点也可起到活化PS 的作用〔12〕。
2.3 反应条件对Fe2O3-CeO2/BC 活化PS 去除AO7的影响
2.3.1 PS 浓度的影响

图3 PS 浓度对AO7 去除率的影响
由图3 可知,当PS 浓度从1 mmol/L 增加至5 mmol/L 时,AO7 去除率逐渐增加,达到69.4%,但增加幅度逐渐减小;进一步提升PS 浓度至7 mmol/L,AO7 去除率仅提高1.8%。提高PS 浓度,相应生成的也会增多,对污染物的氧化去除便随之升高;而当PS 浓度增大至一定程度,催化剂表面活性位点接近饱和,抑制的产生〔1〕。因此,后续研究中选取5 mmol/L 为最优PS 浓度。
2.3.2 Fe2O3-CeO2/BC 投加量的影响
催化剂投加量也是影响催化氧化降解污染物的主要因素之一。在AO7 初始质量浓度为20 mg/L,PS为5 mmol/L,pH=6 条件下,考察Fe2O3-CeO2/BC 投加量对AO7 去除率的影响,结果见图4。

图4 Fe2O3-CeO2/BC 投加量对AO7 去除率的影响
由图4 可以看出,随着Fe2O3-CeO2/BC 投加量由0.7 g/L 提高至1.5 g/L,AO7 的去除率逐步升高,这是由于催化剂的不断加入提供了更多的污染物吸附和反应位点。当Fe2O3-CeO2/BC 投加量进一步提高至2.0 g/L 时,AO7 去除率则无明显变化。实际上,过量的催化剂不仅会影响AO7 和PS 在催化剂表面和孔隙中的扩散,进而影响催化降解反应,而且过量的Fe(Ⅱ)还会消耗,降低反应体系对AO7 的氧化效果。考虑到污染物去除效果和处理成本,选取1.5 g/L 为最优Fe2O3-CeO2/BC 投加量。
2.3.3 初始pH 的影响
在AO7 初始质量浓度为20mg/L,PS 为5mmol/L,Fe2O3-CeO2/BC 为1.5 g/L 条件下,考察初始pH 对AO7 去除率的影响,结果见图5。

图5 初始pH 对AO7 去除率的影响
由图5 可知,Fe2O3-CeO2/BC+PS 体系在初始pH为4~8 时,对AO7 都具有较好去除效果,去除率均超过75%。相比已被广泛应用,但仅能在强酸性条件下发挥高效能的Fenton 反应,该体系具有更为宽广的pH 适用范围。
同时,图5 表明pH=6 是Fe2O3-CeO2/BC+PS 体系的最优pH 条件,AO7 去除率最高,达到80.1%。这是由于pH=4 时,水中较高浓度的H+不仅会使催化剂表面Fe3+、Fe2+以水合离子形态存在,降低活化PS 的能力〔14〕,而且会抑制的 产生〔15〕;而pH 大 于Fe2O3-CeO2/BC 的pHpzc=6.6接近7 时,催化剂表面呈负电性,易排斥阴离子染料AO7(pKa=1)和,且Fe2+发生沉淀,活化PS 能力也降低;当pH 进一步提高到8,部分PS 被碱活化,AO7 去除率有所回升〔16〕。
在上述最佳反应条件下,即AO7 初始质量浓度为20 mg/L,PS 为5 mmol/L,Fe2O3-CeO2/BC 为1.5 g/L,pH=6,对Fe2O3-CeO2/BC+PS 体系开展了自由基抑制和催化剂重复利用研究,结果表明,加入0.3 mmol/L乙醇(和·OH 抑制剂)后,AO7 去除率由80.1%大幅降至26.6%,而加入0.3 mmol/L 叔丁醇(·OH 抑制剂)后,AO7 去除率仅略微下降至62.5%,说明体系中存在的主要自由基为,其是进攻AO7 的主要活性物种。重复利用实验发现,Fe2O3-CeO2/BC 重复使用4 次,Fe2O3-CeO2/BC+PS 体系依旧保持可观的AO7 处理能力,去除率仍可达70.3%,表明Fe2O3-CeO2/BC 催化剂具有良好的重复利用性。
2.4 Fe2O3-CeO2/BC 活化PS 处理其他有机污染物
2.4.1 处理多种有机污染物
为考察Fe2O3-CeO2/BC 活化PS 处理多种有机污染物的效果,选取了AO7、MO 和RhB 三种典型污染物的混合溶液进行研究。AO7 为含萘酚结构的偶氮染料;MO 则含苯胺结构,相比萘酚结构更为稳定;RhB则是结构更为复杂的一种含胺化合物,其分解一般从三苯环共轭结构的中心碳原子开始〔17〕。实验条件为:AO7、MO、RhB 初 始 质 量 浓 度 为20 mg/L,PS 为5 mmol/L,Fe2O3-CeO2/BC 为1.5 g/L,pH=6,结果见图6。
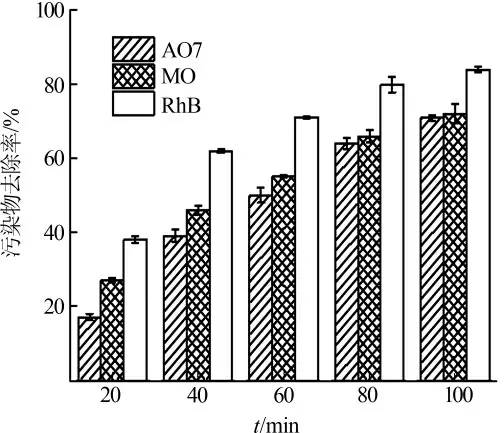
图6 Fe2O3-CeO2/BC 活化PS 处理AO7、MO、RhB 混合污染的效果
从图6 可以看出,Fe2O3-CeO2/BC+PS 对混合溶液中三种污染物都有良好去除效果,100 min 去除率均可达70%以上,表明该体系可去除多种分子结构不同的污染物,而且无明显选择性,具有较强的应用潜力。虽然较单独处理时,MO 和RhB 对的竞争使得混合溶液中AO7 的去除率有所下降,但考虑到污染物总量的提高,Fe2O3-CeO2/BC+PS 体系对多种污染物的处理是非常有效的。
2.4.2 处理实际水体中的有机污染物
为探究催化体系在实际水体中的应用,对比了去离子水和自然湖水中Fe2O3-CeO2/BC 活化PS 去除AO7 情况;考察了该氧化体系在工业废水环境下的处理效果。结果表明,在AO7 初始质量浓度为20 mg/L,PS 为5 mmol/L,Fe2O3-CeO2/BC 为1.5 g/L,pH=6 条件下,自然湖水中Fe2O3-CeO2/BC+PS 对AO7 的处理效果依旧较好,去除率仍可达60%以上。相较去离子水中的去除率,自然湖水中AO7 的去除率略有降低,这是由于自然水体中广泛存在的HCO3-可消耗产生活性相对较低的,且天然有机质也会干扰AO7 的降解〔18〕。工业废水AO7 处理实验显示,最佳反应条件处理5 h,AO7 去除率为42.6%,表明在工业废水环境下Fe2O3-CeO2/BC+PS 也具备一定应用潜力。与去离子水和自然湖水相比,工业废水中AO7 去除效果有所降低,一方面缘于较高浓度其他污染物与AO7 存在竞争氧化,另一方面废水中的各种离子等既会抑制的产生,也易吸附在催化剂表面,阻碍催化反应进行。
3 结论
(1)成功制备了Fe2O3-CeO2/BC 催化剂。BC 载体为催化剂提供了丰富的孔洞结构和较大的比表面积,利于吸附和催化反应的进行;催化剂表面存在的Fe2+/Fe3+、Ce3+/Ce4+氧化还原电对,有助于催化反应中低价过渡金属的再生和氧物种的移动,进而促进PS的活化和对污染物的去除。
(2)Fe2O3-CeO2/BC 可高效 活 化PS 处 理AO7,处理过程中Fe2O3-CeO2和BC 存在协同作用;反应最优条件为PS 浓度为5 mmol/L,Fe2O3-CeO2/BC 为1.5 g/L,pH=6,该条件下AO7 去除率达80.1%。
(3)Fe2O3-CeO2/BC+PS 体系pH 适用范围宽(4~8),对多种有机污染物(AO7、MO、RhB)有良好去除效果,可处理实际水体中的污染物,具备一定的应用潜力。

