甜叶菊绿原酸发酵液对雏鸡肠道菌群的影响
朱 原 李欣泽 郝 贺 张立伟 刘 洋 王风申 张永英,3*
(1.河北工程大学生命科学与食品工程学院,河北邯郸056038;2.河北中贝佳美生物科技有限公司,河北石家庄050000;3.河北省禽病工程技术研究中心,河北邯郸056038)
甜叶菊是菊科草本植物,含有多种功能性成分,包括糖苷类、黄酮类、绿原酸类等[1]。绿原酸是羟基肉桂酸家族中的酚类化合物[2-3],是许多中药的主要活性成分,具有抗病毒、抗氧化、调控脂肪细胞脂质代谢、增强机体免疫、促进畜禽生长发育、提高生产性能、保护动物心血管系统等作用[4-7]。
在国家对养殖业提出“无抗、减抗和替抗”要求的趋势下,开发新型“促生长、无残留、安全”的替抗饲料添加剂具有广阔的发展前景。绿原酸在动物体内只有1/3 以原型的形式被吸收,大部分需要通过肠道菌群降解成咖啡酸、奎宁酸的形式吸收进入血液[8-10],而且绿原酸作为饲料添加剂直接使用存在不溶性和适口性差等特点,制约了其在动物饲料中的广泛应用。绿原酸通过与乳酸菌协同发酵,可使饲料中含有更多的活性乳酸菌菌体、蛋白质分解产物、活性小肽、抑菌物质、各种消化酶及其代谢产物,降低抗营养因子含量,促进动物生长,维持动物健康[11]。动物体内肠道菌群的多样性也影响着能量代谢、免疫反应等诸多生理功能[12]。刘亮等[13]研究表明,成分复杂且含绿原酸的杜仲茶粉能够促进乳酸菌的发酵产酸,而纯品绿原酸则对其有抑制作用;吕武兴等[14]研究发现,含有绿原酸的杜仲提取物能显著提高三黄鸡的平均日增重,显著降低盲肠中大肠杆菌的数量;赖星[15]研究发现,在断奶仔猪日粮中添加绿原酸能显著提高末重、平均日增重、平均采食量,显著降低料肉比,促进免疫器官的发育,提高机体免疫力。Chen 等[16]研究发现,断奶仔猪日粮中添加绿原酸能增加盲肠中厚壁菌门和拟杆菌门细菌的相对丰度,表明绿原酸有助于调节肠道健康。以上研究表明,人们对杜仲绿原酸的抑菌和促生长作用关注较多,而在甜叶菊绿原酸发酵液的研制及其对雏鸡肠道菌群的调控作用鲜有报道。
本研究以甜叶菊绿原酸为研究对象,以杜仲绿原酸为对照品,实验室筛选出的鸡源布氏乳杆菌为发酵菌种,选择不同浓度的绿原酸和布氏乳杆菌共同培养,筛选最佳浓度,探讨甜叶菊绿原酸发酵液对雏鸡肠道菌群和临床保护作用的影响。以期为甜叶菊绿原酸发酵液的后续开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
布氏乳杆菌(RG-6)来自河北省禽病工程技术研究中心;甜叶菊绿原酸(79%)、杜仲绿原酸(78%)由河北某公司提供;MRS固体培养基、MRS肉汤培养基、伊红美蓝培养基、BBL 培养基、LBS 培养基、碳酸钙、丙酮(分析纯)、吐温80、冰乙酸(分析纯)均购自海博生物科技有限公司。
1.2 仪器与设备
台式高速离心机(H-1650,江东仪器装备有限公司);恒温摇床(QIQIAN-2102C,上海启前电子科技有限公司);酶标仪(Multiskan Spectrum,赛默飞世尔科技公司);pH计(PB-10,赛多利斯贸易有限公司)。
1.3 试验方法
1.3.1 绿原酸对布氏乳杆菌体外生长的影响
1.3.1.1 标准曲线的制作
取对数生长期的布氏乳杆菌,调整菌液浓度为1×106cfu/ml,160 r/min、37 ℃摇床培养,分别于0、2、4、6、8、10、12、14 h测定活菌数和OD600[17]。
活菌数的测定:用pH值6.5的PBS缓冲液将布氏乳杆菌菌液倍比稀释,37 ℃恒温培养48 h 后进行平板计数。
OD600的测定:取无菌1.5 ml 离心管,加入菌液,8 000 r/min离心5 min,去掉上层培养基,pH值6.5 PBS缓冲液洗涤菌体2 次,1 ml PBS 缓冲液重悬,酶标仪测定OD600。以OD600值为横坐标,以活菌数对数值为纵坐标,绘制标准曲线。
1.3.1.2 绿原酸发酵液生长曲线的测定
将1 ml 布氏乳杆菌菌液接种至50 ml MRS 肉汤,摇床培养8 h 至对数生长期,调整菌液浓度为1×106cfu/ml,按表1分别加入不同浓度的绿原酸,并设置布氏乳杆菌菌液和丙酮溶剂2个对照组。160 r/min、37 ℃摇床培养,分别于0、2、4、6、8、10、12、14 h 测定各组相应的OD600。将各时间节点测的OD600值代入标准曲线的线性方程,得到相应的活菌数,以时间为横坐标,以活菌数对数值为纵坐标,绘制生长曲线。使用pH 计测定菌液在培养0、2、4、6、8、10、12、14 h的pH 值,以培养时间为横坐标,pH 值为纵坐标,绘制菌液的pH-t曲线。
1.3.2 绿原酸发酵液对雏鸡的保护作用
1.3.2.1 大肠杆菌感染剂量确定
参照郭海涛[18]进行大肠杆菌感染的方法,将1 日龄海兰灰雏鸡60 只随机分为4 组,适应性饲养6 d,7 日龄时,用O78致病性大肠杆菌皮下注射感染。分组及感染情况见表2。感染后,记录48 h 内死亡率,剖检死亡雏鸡,观察病理变化。
1.3.2.2 临床保护试验
将240 只7 日龄海兰灰雏鸡随机分为8 组,每组3 个重复,每个重复10 只鸡。大肠杆菌感染剂量为半数致死量,感染方式同1.3.2.1 节,感染2 h 后,开始灌服相应制剂,试验期3 d,具体分组见表3。试验结束后,统计雏鸡死亡率。收集血清,采用牛津杯法测定含药血清对大肠杆菌的抑菌效果。无菌取盲肠内容物,利用平板计数法,检测雏鸡盲肠肠道菌群,培养条件见表4。

表1 布氏乳杆菌体外培养试验分组

表2 大肠杆菌感染剂量

表3 临床保护试验分组

表4 盲肠细菌培养条件
1.4 数据处理
试验数据经Excel 2016 初步统计整理,采用SPSS20.0 软件进行单因素方差分析,均值比较采用Duncan's 法,测定结果以“平均值±标准误”表示,P<0.05表示差异显著。
2 结果
2.1 绿原酸对布氏乳杆菌体外生长的影响
2.1.1 标准曲线的绘制(见图1)
由图1 可知,活菌数对数值与吸光度呈线性关系,线性方程为:y=5.524 0x+7.693 4,R2=0.996 7,可信度较高。
2.1.2 不同浓度绿原酸对布氏乳杆菌生长的影响(见图2)
由图2a 可知,2.0 mg/ml 杜仲绿原酸使布氏乳杆菌生长曲线达到对数生长期最高活菌数的时间为12 h;1.0、0.5 mg/ml 杜仲绿原酸使布氏乳杆菌生长曲线达到对数生长期最高活菌数的时间为10 h,且活菌数均高于2.0 mg/ml 杜仲绿原酸组。2.0、1.0、0.5 mg/ml 杜仲绿原酸使布氏乳杆菌生长曲线达到平台期的活菌数均高于布氏乳杆菌菌液组。表明这3 个浓度的杜仲绿原酸均能促进布氏乳杆菌的增殖。
由图2b 可知,1.0、0.5 mg/ml 甜叶菊绿原酸使布氏乳杆菌生长曲线达到对数生长期最高活菌数的时间为12 h。4.0 mg/ml 甜叶菊绿原酸中活菌数明显低于其他各组,说明4.0 mg/ml 甜叶菊绿原酸对布氏乳杆菌的生长有明显抑制作用。1.0、0.5 mg/ml 甜叶菊绿原酸使布氏乳杆菌生长曲线达到平台期的活菌数均高于布氏乳杆菌菌液组,表明这2个浓度的甜叶菊绿原酸皆能在体外促进布氏乳杆菌的增殖。
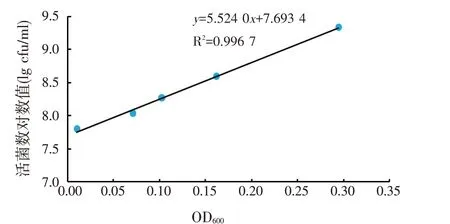
图1 标准曲线

图2 不同浓度绿原酸对布氏乳杆菌生长的影响
经比较甜叶菊绿原酸和杜仲绿原酸对布氏乳杆菌生长的影响,发现1.0、0.5 mg/ml 甜叶菊绿原酸比1.0、0.5 mg/ml 杜仲绿原酸与布氏乳杆菌共同发酵的对数生长期延长了2 h,为布氏乳杆菌在平台期的生长积聚了能量。
2.1.3 不同浓度绿原酸对布氏乳杆菌菌液pH值的影响(见图3)
由图3 可知,绿原酸与布氏乳杆菌共同发酵,各组初始pH 值差异不明显。同一时间段,与布氏乳杆菌菌液组和丙酮溶剂组相比,加入绿原酸的菌液pH值大部分降低。由于发酵过程中绿原酸会促进布氏乳杆菌的生长,活菌数增多,导致乳酸增多,同时绿原酸在乳酸菌的发酵过程中,会有一部分转变成溶于水的咖啡酸和奎宁酸[19],因此除4 mg/ml 甜叶菊绿原酸组pH 值较高,其他各组pH 值均下降较快,且大部分低于布氏乳杆菌菌液组和丙酮溶剂组。
通过评价布氏乳杆菌对数期的保持时间、平台期布氏乳杆菌的活菌数,我们选择终浓度为1.0、0.5 mg/ml甜叶菊绿原酸与布氏乳杆菌共同作用8 h的发酵液进行下一步临床试验。
2.2 甜叶菊绿原酸发酵液对雏鸡的保护作用
2.2.1 大肠杆菌感染剂量确定(见表5)
根据改良寇氏法[20]:
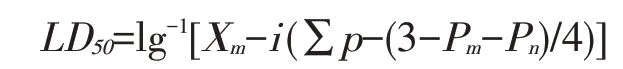
式中:Xm——最大剂量的对数;
i——相邻两组对数剂量的差值;
p——各组动物死亡率(%);
Pm——最大死亡率(%);
Pn——最小死亡率(%)。
由表5 可知,大肠杆菌O78对雏鸡的半数致死量LD50=1×108cfu/ml,即1×108cfu/ml 为最佳的感染剂量。
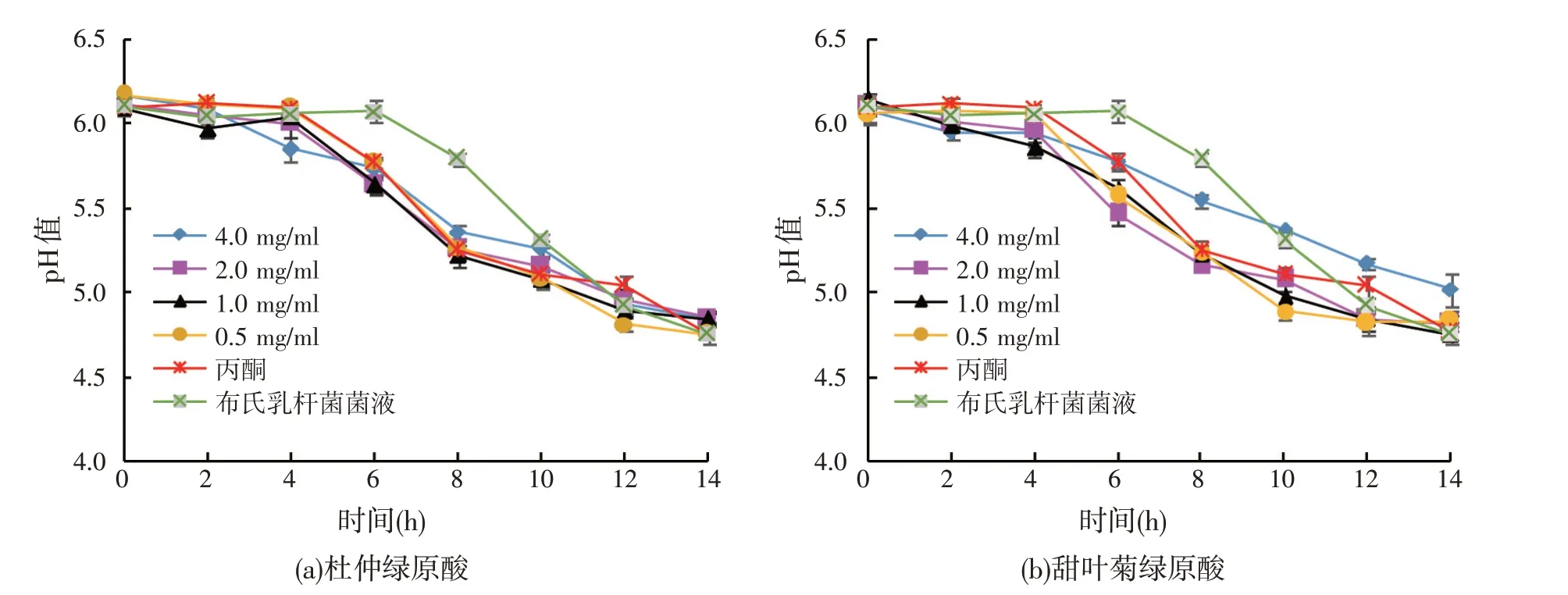
图3 不同浓度绿原酸对布氏乳杆菌菌液pH值的影响

表5 大肠杆菌感染剂量确定
2.2.2 临床保护试验(见图4)

图4 临床保护试验雏鸡死亡率对比分析
由图4可知,Ⅰ组为对照组,雏鸡死亡率最低;Ⅱ组雏鸡死亡率最高,表明大肠杆菌感染成功;Ⅲ组为溶剂组,与Ⅱ组相比无显著差异(P>0.05);Ⅴ组与Ⅳ组相比,雏鸡死亡率较低;Ⅴ组与Ⅵ、Ⅶ、Ⅷ组相比较,雏鸡死亡率显著降低(P<0.05)。说明甜叶菊绿原酸和布氏乳杆菌协同发酵液对雏鸡保护作用优于单独使用甜叶菊绿原酸的效果,其中Ⅴ组的保护效果最好。
2.2.3 含药血清抑菌结果(见图5)
由图5可知,Ⅰ、Ⅱ、Ⅲ组的含药血清对大肠杆菌的抑菌效果均不明显,Ⅴ组的抑菌圈最明显,但抑菌圈直径很小,判定为阴性。
2.2.4 盲肠肠道菌群检测(见表6)
由表6 可知,与Ⅰ组相比,Ⅱ组雏鸡盲肠中乳酸菌、双歧杆菌、乳杆菌的数量均显著减少,大肠杆菌的数量显著增加(P<0.05),表明大肠杆菌侵入雏鸡体内造成肠道菌群紊乱;与Ⅰ组相比,Ⅳ、Ⅴ、Ⅵ、Ⅶ、Ⅷ组雏鸡盲肠中乳酸菌的数量显著增加(P<0.05),Ⅴ、Ⅷ组雏鸡盲肠中双歧杆菌的数量显著增加(P<0.05),Ⅳ、Ⅴ、Ⅵ组雏鸡盲肠中乳杆菌的数量显著增加(P<0.05),Ⅳ、Ⅴ、Ⅵ、Ⅶ、Ⅷ组雏鸡盲肠中大肠杆菌的数量显著减少(P<0.05)。其中Ⅴ组雏鸡盲肠中乳酸菌、双歧杆菌、乳杆菌的数量最多,大肠杆菌的数量最少。说明甜叶菊绿原酸和布氏乳杆菌协同发酵液对肠道菌群的调节作用优于单纯绿原酸的调节效果,且Ⅴ组对雏鸡盲肠肠道菌群的调节效果最好。
综上所述,浓度为1.0 mg/ml的甜叶菊绿原酸与布氏乳杆菌共同作用8 h的发酵液临床应用效果最佳。
3 讨论
3.1 甜叶菊绿原酸对布氏乳杆菌的促生长作用

图5 含药血清对大肠杆菌的抑菌作用

表6 雏鸡盲肠菌群检测结果(×109 cfu/g)
布氏乳杆菌具有益生作用,改善肠道菌群等多种功能[21];绿原酸与布氏乳杆菌相互作用具有补益扶助作用[22]。因此我们推测甜叶菊绿原酸可以作为布氏乳杆菌的益生元,为了证实这一假设,通过分析生长曲线,实时监测甜叶菊绿原酸在不同时间点对布氏乳杆菌生长的影响。结果表明,甜叶菊绿原酸可以在体外促进布氏乳酸杆菌的生长,通过分析生长曲线可以发现,加入甜叶菊绿原酸后,布氏乳杆菌的延滞期有所延长。细菌的延滞期是细菌刚接入到新鲜培养液后,生长速度接近于0 的一段时间,被认为是代谢系统正在适应新环境[23]。因此当在培养基中加入不同浓度的甜叶菊绿原酸时,造成了新的环境,需要时间适应,因而延长了各组的延滞期。其中浓度越高的甜叶菊绿原酸,对布氏乳杆菌的促进作用不如低浓度的效果好,可能是由于高浓度甜叶菊绿原酸对肠道中乳酸菌的增殖有抑制作用。适宜浓度的甜叶菊绿原酸可以促进布氏乳杆菌的增殖,延长对数生长期。此外由于绿原酸不易溶解,试验中选择了丙酮作为溶剂,对布氏乳杆菌的生长和动物发育暂未发现异常,但丙酮为有毒物质存在危害,因此还需要进一步试验确定适合的溶剂。
3.2 甜叶菊绿原酸与布氏乳杆菌的协同作用
甜叶菊绿原酸与布氏乳杆菌共同发酵具有很多方面的互补作用,①布氏乳杆菌代谢产生的多种酶,可以将不能被畜禽吸收利用的物质转化为药理活性较高的小分子物质,可以使甜叶菊绿原酸有效成分最大限度地释放,这些酶类,如纤维素酶、脂肪酶等,可以使其毒副作用降低[24]。②甜叶菊绿原酸作为中药,其中的一些成分还可以作为益生元,促进布氏乳杆菌的增殖,抑制有害菌生长,起到调节肠道菌群的作用。总之,甜叶菊绿原酸和布氏乳杆菌的协同使用会起增效作用,提高动物机体的免疫力。③绿原酸在动物体内的吸收与机体肠道菌群多样性具有依赖性[9],二者共同发酵可以促进绿原酸在肠道内的吸收。本研究结果表明,甜叶菊绿原酸可以促进布氏乳杆菌的生长,布氏乳杆菌可以促进甜叶菊绿原酸的吸收,二者协同发酵可以显著增强对雏鸡感染大肠杆菌的保护作用,死亡率明显降低,但是含药血清对大肠杆菌没有明显的抑菌作用,这和尹良军等[25]的研究结果不一致,也许和采血时间、甜叶菊绿原酸的来源、提取方法以及溶剂不同有关,这需要进一步证实。但是甜叶菊绿原酸与布氏乳杆菌共同发酵产物对雏鸡盲肠肠道菌群具有显著的调节作用,因此,甜叶菊绿原酸发酵液具有一定的开发和应用价值。绿原酸与其他菌种是否也具有协同作用且效果优于布氏乳杆菌,还需我们进一步研究。
4 结论
①甜叶菊绿原酸与布氏乳杆菌共同发酵效果优于与杜仲绿原酸共同发酵。
②浓度为1.0 mg/ml的甜叶菊绿原酸与布氏乳杆菌共同作用8 h的发酵液临床应用效果最佳。可延长对数生长期,增加活菌数量,促进肠道中乳酸菌、乳杆菌、双歧杆菌生长,抑制大肠杆菌增殖,有效地对肠道菌群进行调节。
③甜叶菊绿原酸发酵液可降低雏鸡大肠杆菌感染的死亡率,但含药血清没有明显的抑菌效果。表明甜叶菊绿原酸发酵液可以促进雏鸡肠道有益菌群的增殖,提高动物机体的免疫力。

