丹参多酚酸配伍三七总皂苷通过调节M1/M2型小胶质细胞极化对大鼠脑缺血再灌注损伤的影响*
贾壮壮,陈红阳,赵 磊,袁 庆,殷孟兰,王少峡,胡利民
(天津中医药大学中医药研究院,天津市中药药理学重点实验室,方剂学教育部重点实验室,天津 301617)
缺血性脑卒中是神经系统常见的疾病,具有高发病率、高致残率和高致死率的特点[1],其病理机制包括缺血后炎症反应、氧化和硝化应激、兴奋性氨基酸毒性、细胞凋亡等[2],其中炎症反应在脑缺血损伤中发挥重要作用,小胶质细胞作为神经系统中重要的免疫细胞,参与炎症级联反应,其在缺血性脑损伤中的作用尚有争议,早期认为小胶质细胞可释放炎症介质并募集炎症细胞,加剧脑缺血再灌注损伤[3];近年来研究发现小胶质细胞具有高度可塑性,受特定的微环境刺激可呈现不同表型,进而发挥损伤和修复的双重功能[4-6]。脑缺血损伤后,小胶质细胞被激活并极化为M1型和M2型两种表型,其中M1型小胶质细胞可释放促炎因子白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、白细胞介素-12(IL-12)、肿瘤坏死因子-α(TNF-α)、诱导型一氧化氮合酶(iNOS)等加剧脑损伤,而M2型小胶质细胞释放抗炎因子白细胞介素-10(IL-10)、转化生长因子-β(TGF-β)、精氨酸酶-1(Arg-1)、胰岛素样生长因子-1(IGF-1)进而促进脑损伤修复。因此,调节脑缺血再灌注损伤后小胶质细胞M1/M2表型的平衡,可能是有效的治疗策略。
丹参、三七为临床常用活血药对,广泛应用于治疗心脑血管疾病。丹参主要成分为水溶性的酚酸类及脂溶性的二萜类[7];三七的主要成分为三七总皂苷[8]。注射用丹参多酚酸及注射用血栓通(主要成分为三七总皂苷)在临床中治疗缺血性脑卒中应用广泛。课题组前期研究发现,丹参多酚酸及三七总皂苷配伍可通过减小脑梗死体积、减轻氧化应激损伤、改善微循环障碍等减轻脑缺血再灌注损伤[9-11]。本研究目的在于探讨丹参多酚酸及三七总皂苷对脑缺血再灌注损伤后M1/M2型小胶质细胞极化的影响,从而发挥神经保护作用及其相关机制。
1 材料与方法
1.1 药品与试剂 注射用丹参多酚酸(SPA),天津天士力之骄药业有限公司,批号:20180901;注射用血栓通(冻干)(PNS),广西梧州制药股份有限公司,批号:18080416;依达拉奉注射液(Eda),南京先声东元制药有限公司,规格5 mL/10 mg,批号:80-170510。Iba-1(ab178847)、NeuN(ab177487)、TNF-α(ab66579)、IL-6 (ab9324)、IL-10(ab33471)、iNOS(ab15323)、TGF-β(ab92486)、β-actin(ab179467)抗体,英国 Abcam 公司;IL-1β(BS6067)兔多克隆抗体,美国 Bioword 公司;CD206(sc-58986)小鼠单克隆抗体,美国 Santa Cruz公司;CD16(MA1-7633)小鼠多克隆抗体,美国Thermo公司。
1.2 动物 SPF级健康雄性Wistar大鼠60只,体质量(270±10)g,由北京维通利华实验动物技术有限公司提供,动物许可证号:SCXK(京)2016-0006。
1.3 主要仪器 激光散斑血流仪(英国moor公司);蛋白免疫印迹(Western Blot)电泳仪(美国Bio-Rad公司);Amersham imager 600超灵敏多功能成像仪(美国General Electric公司);Eclipse Ti倒置荧光显微镜(日本Nikon公司)。
1.4 分组与给药 采用随机数字法将Wistar大鼠分为6组,假手术组(Sham)、脑缺血再灌注组(I/R)、依达拉奉组 (Eda,6 mg/kg)、丹参多酚酸组(SPA,21 mg/kg)、三七总皂苷组(PNS,100 mg/kg)、丹参多酚酸配伍三七总皂苷组(SPA+PNS,21 mg/kg+100 mg/kg),尾静脉注射给药,每日1次,连续给药5 d,Sham组与I/R组给予相同容积生理盐水。
1.5 模型制备 采用线栓法[12]建立大脑中动脉闭塞/再灌注模型(MCAO/R)。大鼠吸入异氟烷麻醉后,脑部固定激光多普勒血流仪,监测脑血流;将颈部正中切开,钝性分离颈总动脉、颈外动脉、颈内动脉,将线栓从颈外动脉经颈总动脉分叉处插至颈内动脉,阻断大脑中动脉供血,缺血1.5 h后拔出线栓再灌。假手术组仅暴露颈部血管,不做插线栓处理。
1.6 观察指标及检测方法
1.6.1 神经行为学评分 给药5 d后进行mNSS神经功能评分[13],观察各组大鼠神经功能缺损情况,包括运动测试、感觉测试、平衡测试、反射测试和异常运动5个方面,总分18分,得分越高者神经功能缺损越严重。
1.6.2 脑部血流检测 将大鼠吸入异氟烷麻醉后通过激光散斑血流仪New single image扫描脑血流情况,moor LDI Laser Doppler Imager Review V60进行血流分析。
1.6.3 苏木精-伊红(HE)染色及Nissl染色 给药5 d后,异氟烷麻醉后处死,心脏灌注生理盐水及4%多聚甲醛溶液,大鼠断头取脑,用4%多聚甲醛溶液固定过夜,乙醇梯度脱水、二甲苯透明,石蜡包埋后做冠状切片,脱蜡、水化后分别进行常规HE染色及Nissl染色,Nikon显微镜下观察细胞组织形态。
1.6.4 免疫荧光染色检测缺血半暗带小胶质细胞M1 型(CD16/Iba-1)、M2 型(CD206/Iba-1)和 NeuN表达 大鼠断头取脑,心脏灌注生理盐水及4%多聚甲醛溶液,用4%多聚甲醛溶液固定过夜,蔗糖梯度脱水,OCT包埋后做连续冠状冰冻切片,厚度20 μm,柠檬酸钠溶液抗原修复,封闭,分别孵育NeuN、CD16/Iba-1、CD206/Iba-1 一抗过夜,次日滴加相应的荧光二抗,37℃避光孵育40 min,DAPI染核,抗荧光淬灭剂封片;Nikon倒置荧光显微镜下观察,随机选取5个高倍视野拍照,统计阳性细胞表达数。
1.6.5 Western Blot法检测小胶质细胞M1型标记物 iNOS、TNF-α、IL-1β、IL-6 与 M2 型标记物 IL-10、CD206、TGF-β蛋白表达 提取大鼠脑缺血半暗带总蛋白,采用SDS-PAGE凝胶电泳,将蛋白转移至PVDF转膜,5%的脱脂奶粉封闭2 h,分别孵育iNOS、TNF-α、IL-1β、IL-6、IL-10、CD206、TGF-β、β-actin I抗,4℃过夜,次日孵育HRP标记Ⅱ抗,TBST清洗后显影,Image J软件分析目的蛋白/βactin的相对表达情况。
1.7 统计学方法 采用SPSS 21.0统计软件进行统计分析,实验数据以均数±标准差(±s),正态分布计量资料组间比较采用单因素方差分析(one-way ANOVA),组间两两比较若满足方差齐性采用LSD法,不满足方差齐性采用Tamhane’s法;若不符合正态分布,组间比较采用非参数检验,P<0.05为差异具有统计学意义。
2 结果
2.1 对大鼠局部脑血流的影响 见图1。给药5 d以后,激光散斑血流仪检测大鼠脑血流情况,与Sham组比较,I/R组大鼠缺血侧局部脑血流显著下降(P<0.01);与 I/R 组比较,Eda组、SPA 组、PNS 组、SPA+PNS组脑血流显著增加,差异具有统计学意义(P<0.01,P<0.05),SPA+PNS 组脑血流改善情况优于SPA 组、PNS 组(P<0.05)。
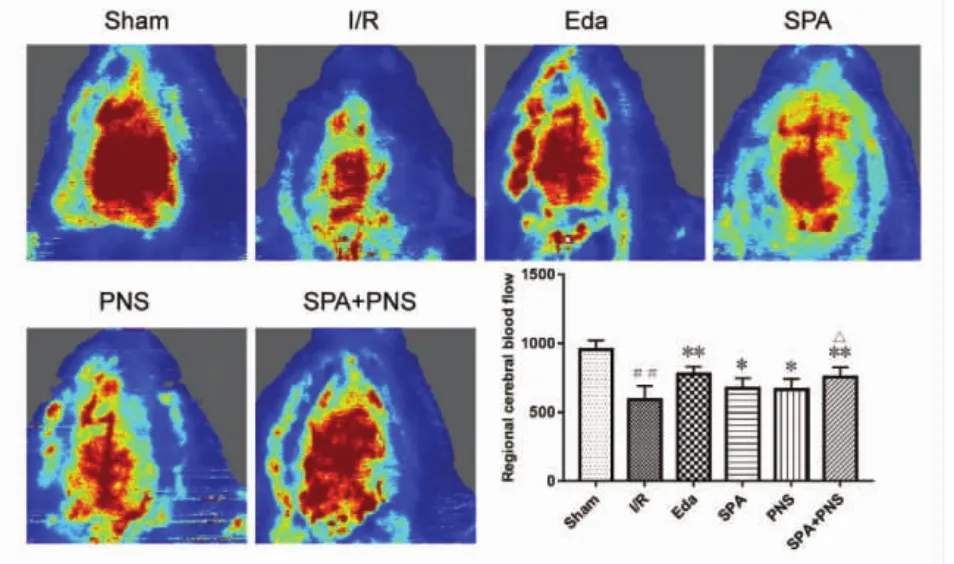
图1 各组大鼠局部脑血流变化((±s),n=10)Fig.1 Changes of cerebral blood flow of rats in each group((±s),n=10)
2.2 对大鼠神经功能缺损的影响 见图2。与Sham组比较,I/R 组 mNSS评分明显升高(P<0.01);与 I/R组比较,各用药组mNSS评分显著下降(P<0.05或P<0.01),神经功能缺损状况得到改善,且SPA+PNS组神经功能缺损改善情况优于SPA组、PNS组(P<0.05)。
2.3 对大鼠脑缺血半暗带组织形态学的影响 见图3。HE染色结果显示,I/R组细胞结构破坏,细胞排列不整齐,细胞间隙疏松;与I/R组比较,各用药组形态学明显改善,正常细胞数量较多,组织结构较为完整,细胞排列整齐,细胞核较为清晰。
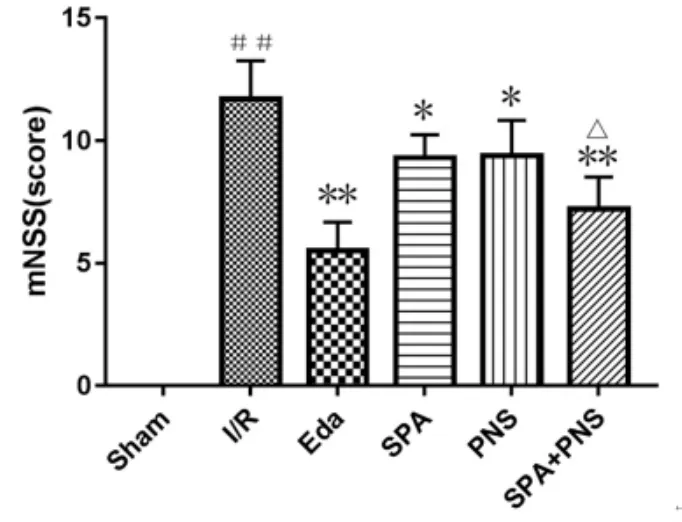
图2 各组大鼠神经功能评分((±s),n=10)Fig.2 MNSS of rats in each group((±s),n=10)
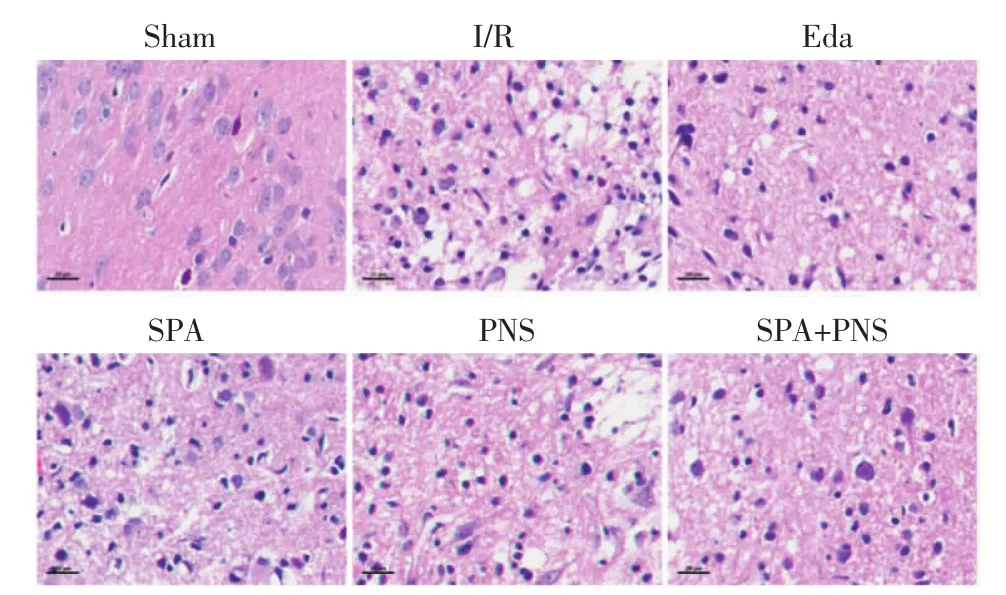
图3 各组大鼠脑缺血半暗带HE染色观察(×400)Fig.3 HE staining image of cerebral ischemic penumbra of rats in each group(×400)
2.4 对大鼠脑缺血半暗带神经元损伤的影响 见图4、图5。Nissl染色显示,I/R组神经元排列紊乱,结构异常,呈空泡样,Nissl体数目显著减少(P<0.01);NeuN 阳性细胞表达数明显减少(P<0.01);与I/R组相比,各治疗组神经元形态明显好转,染色较均匀,Nissl体数目增多(P<0.01 或 P<0.05),NeuN阳性细胞表达数目增多(P<0.01);SPA+PNS 组神经元数目多于 SPA 组、PNS 组(P<0.01)。
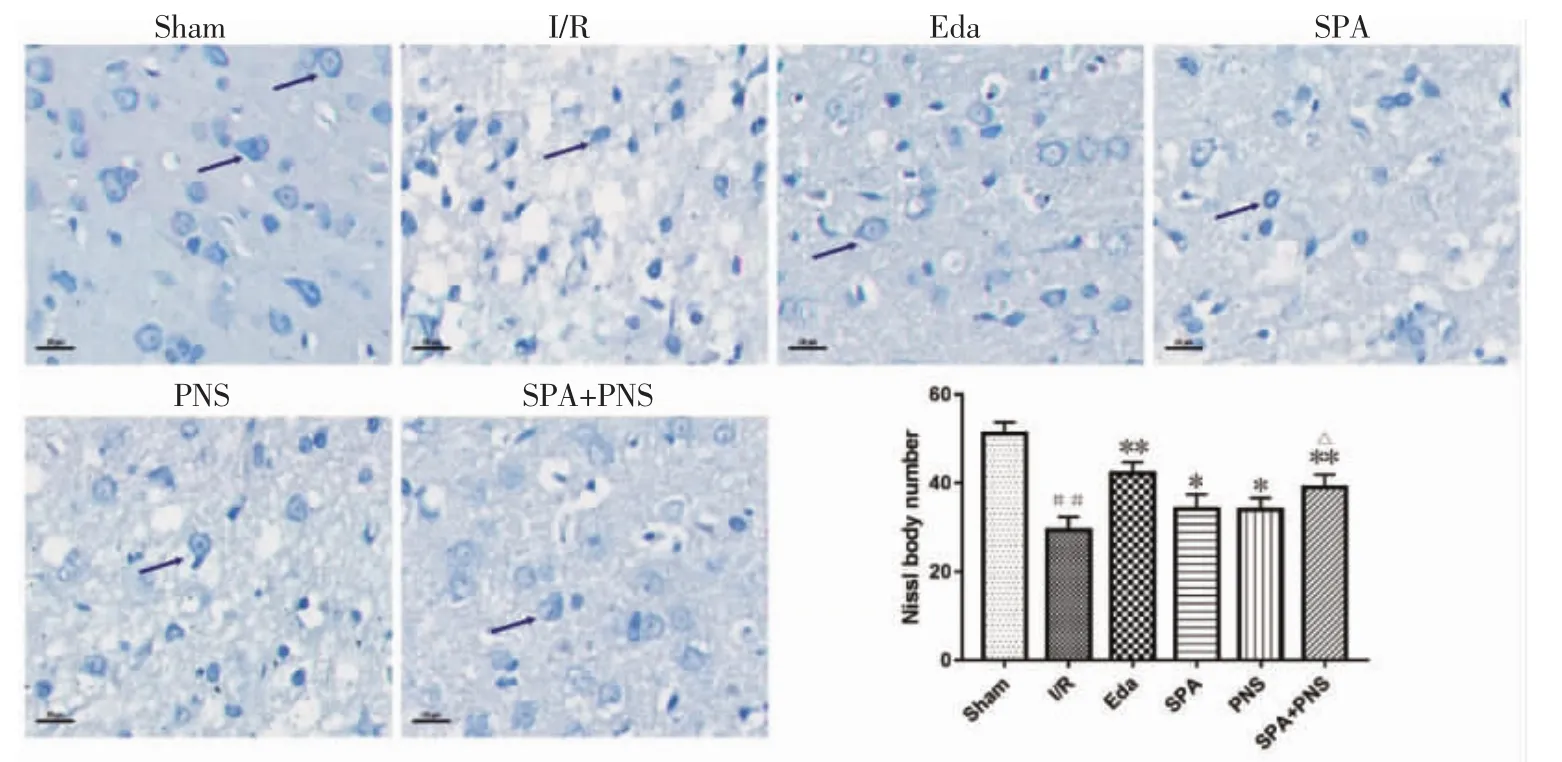
图4 各组大鼠脑缺血半暗带Nissl染色观察(×400,(±s))Fig.4 Nissl staining image of cerebral ischemic penumbra of rats in each group(×400,(±s))
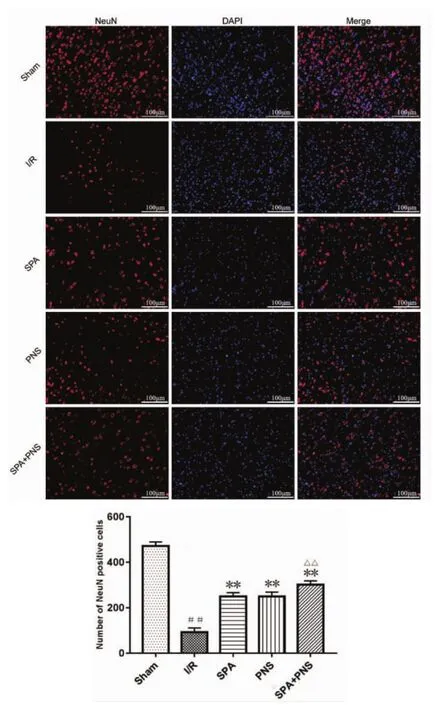
图5 各组大鼠脑缺血半暗带NeuN表达情况(×400,(±s))Fig.5 Expression of NeuN of cerebral ischemic penumbra of rats in each group(×400,(±s))
2.5 对大鼠M1型小胶质细胞极化的影响 见图6。荧光双染结果显示,与Sham组比较,I/R组大鼠脑缺血半暗带M1型小胶质细胞标记物CD16/Iba-1阳性细胞显著增加(P<0.01);与 I/R 组比较,各用药组 CD16/Iba-1 阳性细胞数显著下降(P<0.01),且SPA+PNS组下降程度优于SPA 组、PNS组(P<0.01)。
2.6 对大鼠M2型小胶质细胞极化的影响 见图7。与Sham组比较,I/R组大鼠脑缺血半暗带M2型小胶质细胞标记物CD206/Iba-1阳性细胞显著增加(P<0.01);与 I/R 组比较,各用药组 CD206/Iba-1 阳性细胞数显著增加(P<0.01),且 SPA+PNS 组增加程度优于 SPA 组、PNS 组(P<0.01)。
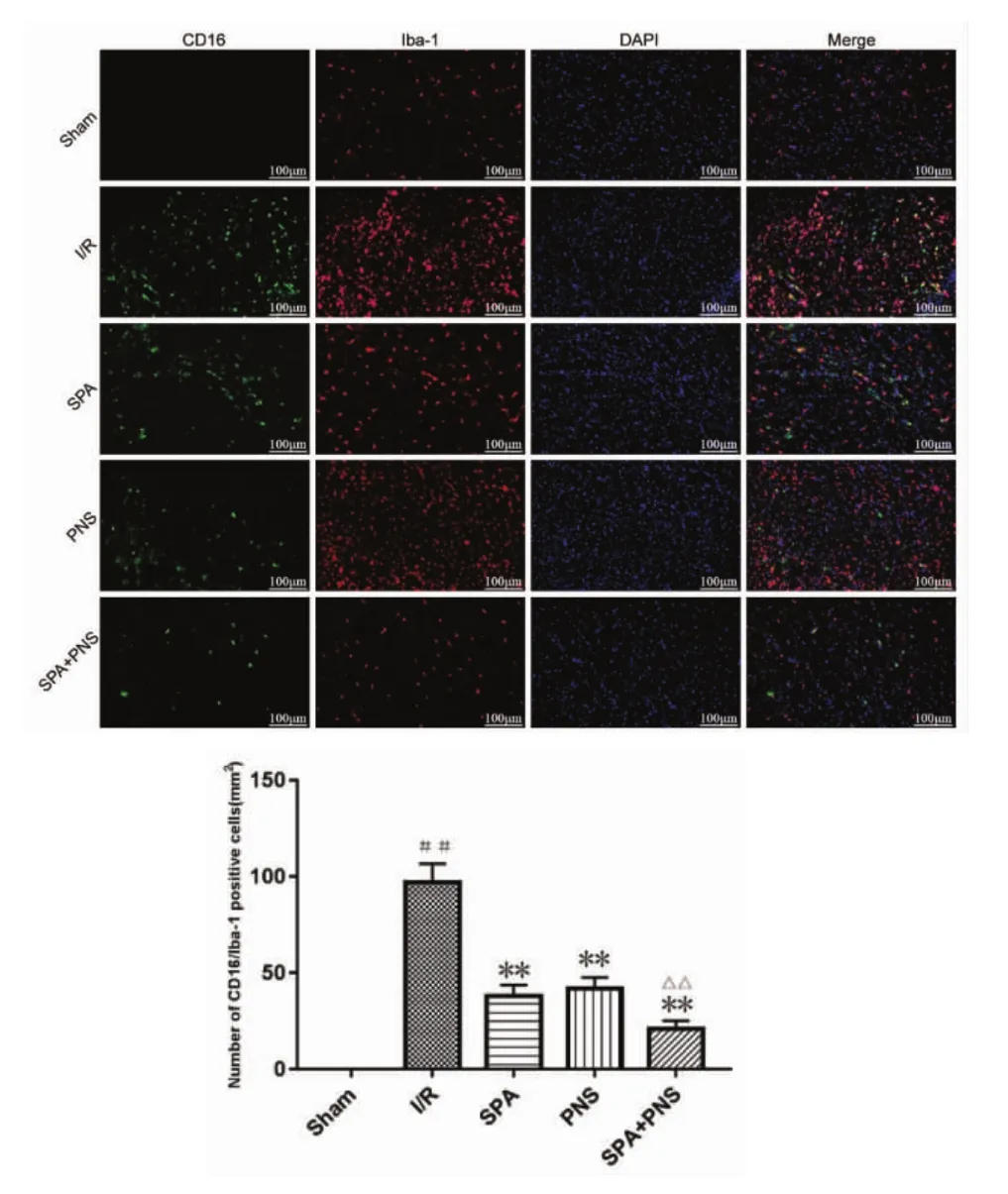
图6 各组大鼠脑缺血半暗带CD16/Iba-1表达情况(×100,(±s))Fig.6 Expression of CD16/Iba-1 of cerebral ischemic penumbra of rats in each group(×100,(±s))
2.7 对大鼠M1型小胶质细胞标记物表达的影响 见图8。Western Blot检测结果显示,与Sham组比较,I/R组大鼠脑缺血半暗带M1型小胶质细胞标记物 iNOS、TNFα、IL-1β、IL-6 蛋白表达显著增加(P<0.01);与 I/R 组比较,SPA 组 IL-6表达无差异,其他各用药组 IL-1β、IL-6、TNFα、iNOS 蛋白表达显著下降(P<0.01,P<0.05),且 SPA+PNS 组下降程度优于 SPA 组、PNS 组(P<0.05)。
2.8 对大鼠M2型小胶质细胞标记物表达变化见图9。与I/R组比较,SPA组、PNS组TGF-β表达无差异,其他各用药组CD206、TGF-β、IL-10蛋白表达显著升高(P<0.01,P<0.05),且 SPA+PNS 组升高程度优于 SPA 组、PNS 组(P<0.05)。
3 讨论
脑卒中是世界范围内致残和致死的重要疾病之一,重组型纤溶酶原激活剂(rtPA)仍然是食品药监督管理局(FDA)唯一批准的治疗急性缺血性卒中的有效药物。随着诸多神经保护剂在临床试验中失败,更多的研究聚焦在改善缺血再灌注损伤后脑部的微环境而非仅注重保护受损的神经元[13],因此创造脑部细胞存活和再生的适宜微环境成为治疗缺血性脑卒中的关键之一。

图7 各组大鼠脑缺血半暗带CD206/Iba-1表达情况(×100,(±s))Fig.7 Expression of CD206/Iba-1 of cerebral ischemic penumbra of rats in each group(×100,(±s))

图8 各组大鼠M1型小胶质细胞标记物表达情况(±s)Fig.8 Expression of M1 microglia markers of rats in each group(±s)
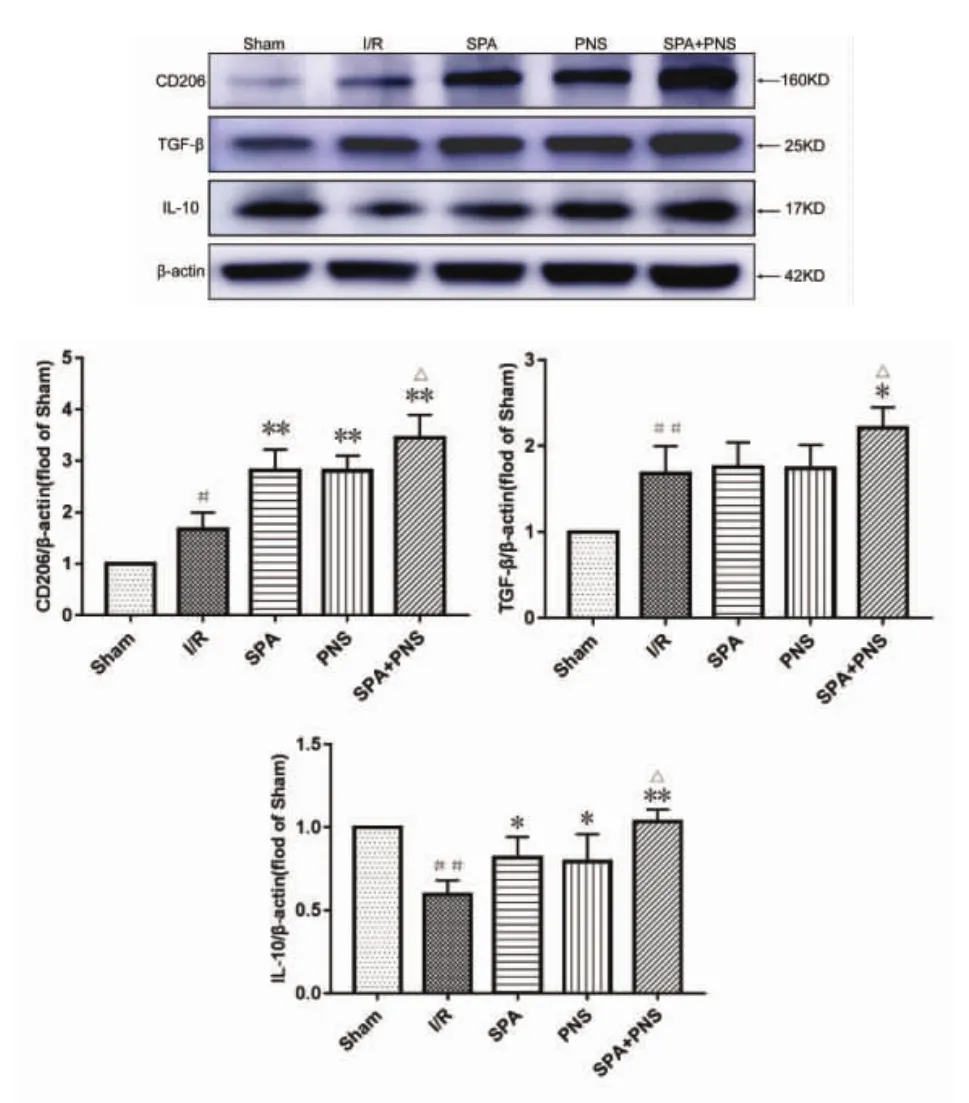
图9 各组大鼠M2型小胶质细胞标记物表达情况(±s)Fig.9 Expression of M2 microglia markers of rats in each group(±s)
小胶质细胞参与维持中枢神经系统内微环境稳态,在缺血性脑损伤后免疫和炎症反应中起着重要的调节作用[14]。在缺血性脑损伤后,小胶质细胞被极化为不同表型而呈现不同生理功能[15],极化的M2型小胶质细胞可用CD206标记,其表达在脑缺血后1 d开始升高,第5天达到峰值后开始下降,其可通过清除细胞碎片,表达抗炎因子IL-10、TGF-β、Arg1、Ym1、抵抗素样分子-α(RELM-α)、IGF-1、脑源性神经营养因子(BDNF)等促进炎症消退和神经修复[16],缺乏必要的内源性M2型诱导因子会加重脑缺血损伤程度[17];经典活化的M1型小胶质细胞在脑缺血后第3天开始明显升高,直至第14天仍然呈上升趋势,其高度表达CD16、CD86、主要组织相容性复合体Ⅱ(MHCⅡ)、iNOS,释放促炎因子TNF-α、IL-1β、IL-6及活性氧(ROS)等加剧神经损伤[18]。促进小胶质细胞从M1型向M2型转化,而非单纯的抑制小胶质细胞,可作为治疗脑卒中的新思路,如红景天苷可通过抑制C57/BL6小鼠局灶性短暂性脑缺血后M1型小胶质细胞标记物的表达,促进M2型标记物的表达,增强小胶质细胞的吞噬功能,抑制小胶质细胞源性炎症因子的释放[19];姜黄素可抑制脂多糖(LPS)与干扰素-γ(IFN-γ)诱导的BV2小胶质细胞系的M1型极化,并促进小胶质细胞由M1型向M2型转化[20]。
中医理论认为,脑卒中的主要病理因素为风、火、痰、气、瘀,而气虚血瘀是重要病机之一。中药具有多组分、多靶点等优势,在抗脑缺血治疗中越来越受到人们的重视。丹参最早见于《神农本草经》,具有活血祛瘀之功,《本草便读》记载其为“调理血分之首药”。三七可活血化瘀,补虚强壮,黄元御言其“和营止血,通脉行瘀”,《本草求真》记载其“能于血分化其血瘀”。研究表明,丹参及其有效组分可调节超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GPX)活性,提高机体的抗氧化能力[21],调节脑缺血再灌注损伤后细胞凋亡、能量代谢异常等[22]。小胶质细胞可通过调节NF-κB信号通路,进而调节NLRP3信号释放大量炎性介质,从而造成神经细胞毒性[23],丹酚酸B可抑制NF-κB转录活性和调节炎症因子,促进脑缺血损伤恢复[24];三七总皂苷抑制脑缺血再灌注后不同时期的炎症反应,拮抗自由基损伤,抑制兴奋性氨基酸毒性和Ca2+内流,下调Bax、Caspase-3,上调Bcl-2的表达抑制神经元凋亡,并可通过调节BDNF、VEGF发挥内源性神经保护作用[25-27]。
本研究通过线栓法诱导大鼠脑缺血再灌注损伤,配伍应用丹参多酚酸及三七总皂苷,研究发现丹参多酚酸及三七总皂苷干预后,可显著改善大鼠脑血流情况,改善神经元损伤及神经行为学缺损,并有效促进M2型小胶质细胞极化,抑制M1型极化,且配伍应用效果优于单独应用。本研究采用两种中药注射剂配伍应用,其临床有效配伍剂量及安全性等问题尚需进一步深入研究。丹参多酚酸及三七总皂苷配伍应用可显著减轻大鼠脑缺血再灌注损伤,其机制可能与促进小胶质细胞M1型极化向M2型转化有关,为进一步探讨丹参及三七有效组分治疗缺血性脑卒中奠定了实验基础。

