JSRV-env慢病毒过表达载体构建及其对NIH3T3细胞增殖的影响
杨 惠 刘淑英
(内蒙古农业大学 兽医学院/基础兽医学重点实验室/农业农村部动物临床诊疗技术重点实验室,呼和浩特 010018)
绵羊肺腺瘤(Ovine pulmonary adenocarcinoma,OPA)是由绵羊肺腺瘤病毒(Jaagsiekte sheep retrovirus,JSRV)引起的绵羊可传播性肺脏肿瘤[1],目前在全球范围内广泛流行并严重制约了绵羊产业的发展[2]。OPA 作为一种混合型腺癌,与人肺腺癌之间的组织学相似性使 OPA 成为进一步了解人肺腺癌的有效模型[3]。JSRV 的致瘤作用主要取决于活跃的癌基因——囊膜基因(env)[4]。
为了解JSRV致病机理,大量试验通过构建动物模型,如羔羊JSRV-env感染模型、小鼠JSRV-env肿瘤模型等,探讨JSRV-env引起病理组织结构改变、信号通路激活等问题[2]。但从分子病理学角度出发,为进一步研究JSRV-env致病分子机制,大量试验构建JSRV-env体外转染细胞系,通过JSRV-env过表达质粒转染体外细胞,探讨JSRV-env引起细胞转化的分子致病基础[3]。由于在自然感染状态下JSRV仅引起绵羊细支气管上皮细胞及Ⅱ型肺泡上皮细胞发生转化,因此需要在体外细胞试验中构建大量JSRV-env体外转染细胞系,寻找不同细胞类型中JSRV-env诱导的分子变化共性,区分JSRV-env在不同类型细胞中介导的分子变化差异,最终确定JSRV-env致病的关键靶向因子[4-6]。体外细胞试验证实,JSRV-env能够诱导多种类型的细胞发生增殖[5-8]。Alla等[5]研究绵羊支气管上皮细胞时发现JSRV-env作用于受体Hayl2,进一步激活RON信号通路引发细胞增殖能力上调。Varela等[6]研究JSRV-env作用于人支气管上皮细胞(BEAS-2B),同样发现JSRV-env依赖Hayl2受体介导细胞增殖。也有与之不同的研究报道,Johnson等[7]研究发现,JSRVenv在犬肾细胞(Madin-darby canine kidney)中不依赖 Hayl2 受体激活 PI3K-Akt-mTOR 以及 H/N-Ras-MEK-MAPK 信号通路介导细胞转化及细胞增殖;Thomas 等[8]研究鸡胚成纤维细胞 (DF-1) 也发现 JSRV-env不依赖 Hayl2 受体诱导细胞增殖。由此得出结论 JSRV-env诱导细胞增殖,不同细胞类型所依赖的的受体及信号通路不同[2,5-8]。以上 JSRV-env研究结果为探讨致癌基因在细胞转化及癌症中的相关作用提供了研究基础。
由于NIH3T3细胞不具备Hayl2受体,JSRVenv无法依赖Hayl2受体诱导细胞增殖[2]。然而Maeda等[9]研究表明,NIH3T3细胞中转染JSRV-env真核表达质粒能够激活Akt/mTOR和MAPK信号通路调控细胞周期。本课题组孙晓林等[10]的研究表明,真核表达质粒pcDNA/myc-His/JSRV-env转染NIH3T3细胞,JSRV-env过表达能够激活Akt/mTOR和MAPK信号通路介导细胞自噬。综上可知,JSRV-env能够激活Akt/mTOR和MAPK信号通路调控细胞周期及细胞自噬,然而目前尚没有通过构建JSRV-env慢病毒大量过表达JSRV-env,直接探讨JSRV-env对NIH3T3细胞增殖影响的相关研究。因此,本试验拟以NIH3T3细胞作为研究对象,感染JSRV-env慢病毒过表达JSRV-env,通过噻唑蓝(MTT)评价细胞增殖能力,以期为进一步研究JSRV致癌基因env的生物学作用及探讨JSRV-env致癌机制提供基础研究资料。
1 材料与方法
1.1 重组慢病毒载体构建
根据JSRV-env序列(JQ837489.1),使用Primer 6.0设计引物(表1),采用高保真DNA聚合酶(生工生物工程,上海),以pEGFP-C1-JSRV-env标准质粒(农业部动物临床诊疗技术重点实验室保存)为扩增模板,对JSRV-env全长基因序列进行PCR扩增。基因片段纯化试剂盒(Takara,大连)回收,ClaI(NEB,美国)酶切红色荧光报告载体pCMV-dR8.91(生工生物工程有限公司,上海),通过无缝克隆试剂盒(生工生物工程,上海)将JSRV-env全长基因序列与ClaI酶切后的pCMV-dR8.91载体进行连接。连接体系为:目的片段1 μL;载体3 μL;T4 DNA Ligase 1 μL;Buffer 2 μL;ddH2O 14 μL。22 ℃连接5 h,转化DH5α感受态细胞。JSRV-envPCR鉴定阳性的转化子,通过BamHI(NEB,美国)单酶切验证重组质粒基因片段大小。基因片段大小与预期结果一致的阳性转化子进一步送至上海生工进行测序。对于测序正确的转化子,使用质粒小抽试剂盒(Promega,美国)提取质粒并利用分光光度仪(Bio-Rad,美国)测定质粒浓度。

表1 RT-PCR目的基因引物信息Table 1 Primers of target gene for RT-PCR
1.2 JSRV-env重组慢病毒包装
选择本实验室保存的 293T 细胞复苏,37 ℃,5% CO2条件下培养,待细胞在培养瓶内长至70%~80%进行传代,待细胞状态佳,存活率 90% 以上,细胞边缘清晰时,利用 500 μL 的OPTI-MEM 混匀10 μg重组载体(pCMV-dR8.91-JSRV-env,试验组)或空载体(pCMV-dR8.91,对照组),混合 10 μg 包装辅助质粒pCMV-VSV-G(生工生物工程,上海)对293T进行转染,6 h后移去培养基上清,更换为DMEM完全培养基。72 h后利用荧光电子显微镜观察293T细胞内是否有红色荧光蛋白表达,确定重组质粒载入细胞,收集培养基上清,4 ℃,500 g离心10 min,收集上层病毒悬液,利用0.22 μmol/L PVDF过滤器过滤并收集至10 mL离心管。
1.3 JSRV-env重组慢病毒浓缩及滴度测定
将20%的蔗糖溶液加至病毒悬液底部,4 ℃,25 000 g 离心2 h,弃掉上清,室温晾干至离心管底可见沉淀。用无血清的OPTI-MEM 4 ℃溶解2 h,碎干冰速冻后储存于-80 ℃。取24孔板接种293T细胞。待细胞融合率为40%~60%,确定感染前实际细胞数目,记为N。病毒10倍稀释3个梯度(1×10-7g/mL、1×10-6g/mL、1×10-5g/mL)感染293T细胞72 h,利用Image pro plus 6.0统计每视野下荧光表达面积及对应视野下平铺细胞面积,二者之比为293T细胞内荧光蛋白表达比率。利用DNA抽提试剂盒(Invitrogen,美国)提取 293T 细胞基因组 DNA,利用 Real-time PCR 试剂盒(Takara,大连)扩增 JSRVenv,扩增引物见表2,ABI PRISM 7000 定量系统(Applied biology,美国)定量。循环条件: 50 ℃ 2 min, 95 ℃ 10 min, 95 ℃ 15 s, 60 ℃ 1 min,40个循环,每组处理重复3次。Real-time PCR 检测结果采用2-ΔΔCT方法进行计算,测得 293T 细胞每基因组载入的慢病毒拷贝数,进一步计算病毒滴度。病毒滴度(Integration units per mL,IU/mL)的计算公式如下:IU/mL=(C×N×D×1 000)/V(C=平均每基因组整合的病毒拷贝数;N=感染时细胞的数目;D=病毒载体的稀释倍数;V=加入的稀释病毒的体积数)。
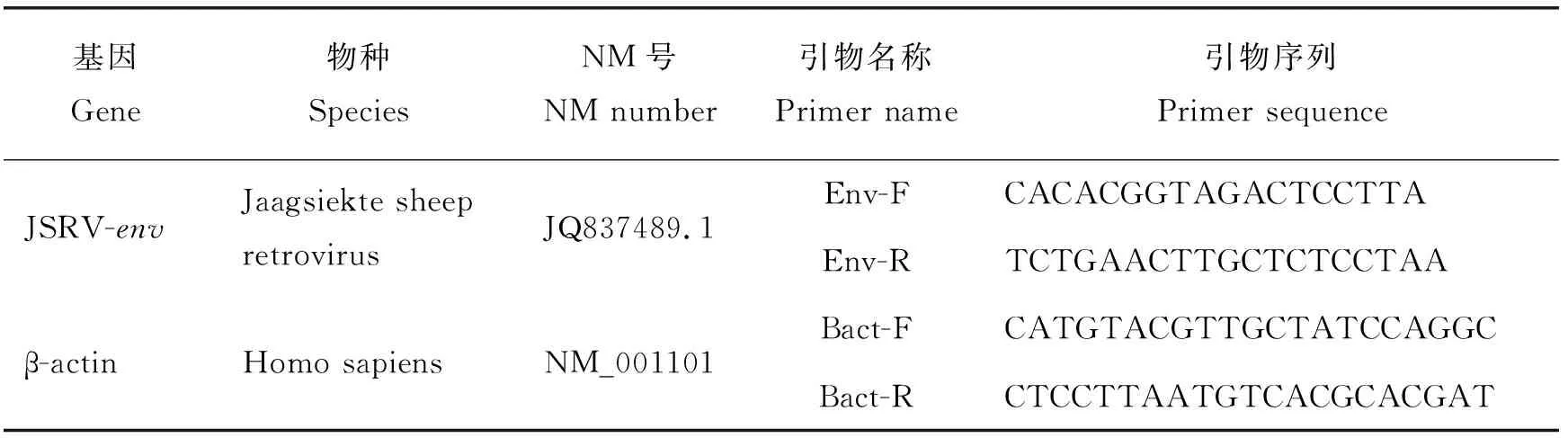
表2 RT-qPCR目的基因引物信息Table 2 Primer information of the target gene for RT-qPCR
1.4 JSRV-env重组慢病毒感染 NIH3T3
将本实验室保存的NIH3T3从液氮罐中取出,37 ℃水浴复苏,待细胞传至三代稳定后,细胞状态较佳,细胞边缘清晰,设置4个细胞试验组分别加入JSRV-env重组慢病毒(5、10、15和20 μg)感染72 h,每组处理重复3次,确定NIH3T3的最佳病毒感染复数(MOI)。MOI计算公式如下:P=1-P(0),m=-InP(0)(P=被感染细胞的百分率;P(0)=未被感染细胞的百分率;m=MOI值)。
1.5 噻唑蓝(MTT)检测细胞增殖能力
培养状态良好的NIH3T3细胞,设置3个细胞试验组分别加入完全培养基(空白组)、完全培养基吹打混匀的空病毒载体(对照组)、完全培养基吹打混匀的JSRV-env重组慢病毒(JSRVenv组),最佳MOI条件下感染72 h。每组取200 μL吹打混匀的细胞悬液进行细胞计数,每组设3个复孔,以3 000个细胞/孔接种于96孔板内,每100 μL加入10 μL MTT检测液,连续绘制3天细胞生长曲线,酶标仪以570 nm波长检测OD值。
1.6 统计分析
每组试验重复3次,试验数据以均数±标准差(X±S) 表示。所有数据均采用 Graphpad Prism 8.0 软件处理;两组均数间比较用t检验(t-test);两组以上均数的比较采用方差分析(ANVOA)。P<0.05 时认为具有统计学意义,P<0.05为差异显著,在统计图中表示为*;P<0.01为差异极显著,在统计图中表示为 **。
2 结果与分析
2.1 重组慢病毒载体构建
由图1(a)可知,扩增出的env目的片段大小与预期序列1 848 bp一致。酶切鉴定完全正确,其酶切产物大小预期7 861 bp(图1(b))一致。基因片段纯化试剂盒分别纯化env全长基因序列及ClaI 酶切载体,env同源重组入表达载体,BamHI对重组质粒单酶切,酶切鉴定完全正确,其酶切产物大小预期9 709 bp(图1(c))一致。最终命名重组质粒为pCMV-dR8.91-JSRV-env,基因结构如图1(d)。将pCMV-dR8.91-JSRV-env转入感受态细胞扩增,随机挑取4个转化子进行JSRV-env菌落PCR鉴定,扩增产物琼脂糖凝胶电泳鉴定结果完全正确,其鉴定产物大小预期1 848 bp(图1(e))。阳性克隆送至上海生工测序,测序结果与预期pCMV-dR8.91-JSRV-env基因序列一致,提示慢病毒载体构建成功。

(a) 1,从PEGFP-C1-JSRV-env 标准质粒中扩增出目的片段 env; M, DL2 000 marker; (b) 1, pCMV-dR8.91 载体 ClaI 酶切产物; M, DL10,000 marker; (c) 1, pCMV-dR8.91-JSRV-env载体 BamHI 酶切产物; M,DL10 000 marker; (d) pCMV-dR8.91-JSRV-env结构示意图; (e) 1-4, 随机挑取的 4 个转化子; M, DL10 000 marker.(a) 1, The target fragment env was amplified from the PEGFP-C1-JSRV-env standard plasmid; M, DL2 000 marker; (b) 1, ClaI digestion product of pCMV-dR8.91 vector; M, DL10 000 marker; (c) 1, BamHI digestion product of pCMV-dR8.91-JSRV-env vector; M, DL10 000 marker; (d) pCMV-dR8.91-JSRV-env structure diagram; (e) 1-4, randomly selected 4 transformants; M, DL10 000 marker.图1 pCMV-dR8.91-JSRV-env重组载体构建Fig.1 pCMV -dR8.91-JSRV-env recombinant vector linkage
2.2 JSRV-env重组慢病毒包装
将上述测序结果正确的转化子进行质粒抽提并测定浓度。5 μg 的pCMV-dR8.91-JSRV-env和10 μg 包装辅助质粒pCMV-VSV-G转染HEK 293T细胞转染72 h后,在荧光显微镜下可观察到在293T细胞中大量红色荧光蛋白表达,提示JSRV-env重组慢病毒包装成功(图2)。

图2 pCMV-dR8.91-JSRV env质粒在293T细胞中表达Fig.2 pCMV-dR8.91-JSRV env plasmid expressed in 293T cells
2.3 纯化的重组慢病毒滴度测定
利用超速离心沉淀法对重组慢病毒浓缩纯化,纯化后的病毒进行梯度稀释并感染 293T 细胞 72 h 后,观察荧光表达情况。由图3(a)可见,荧光细胞数随稀释倍数增加而相应减少,1及10 μg 的pCMV-dR8.91-JSRV-env感染 293T 细胞72 h,其荧光蛋白的表达占比均>80%(图3(b)); Real-time PCR 验证1 μg的pCMV-dR8.91-JSRV-env重组病毒感染293T细胞72 h后,JSRV-env过表达极显著(P<0.01)(图3(c));将 293T 细胞每基因组整合的 JSRV-env病毒拷贝数、感染时的细胞总数、病毒载体稀释倍数以及稀释病毒的体积数分别代入病毒滴度计算公式,最终计算得到JSRV-env慢病毒平均滴度为2.99×108IU/mL(表3)。以上结果表明,JSRV-env慢病毒构建成功,并且纯化后得到的JSRV-env慢病毒平均滴度为2.99×108IU/mL。
2.4 JSRV-env重组慢病毒感染 NIH3T3 细胞
针对细胞状态良好的NIH3T3细胞分别加入JSRV-env重组慢病毒(5、10、15和20 μg)感染72 h,每组处理重复3次,荧光场下观察10 μg JSRV-env重组慢病毒的转染效率最高(图4),根据MOI计算公式,计算得出NIH3T3的最佳病毒感染复数为30 MOI。以上结果表明,JSRV-env慢病毒感染NIH3T3细胞,感染效率最高的病毒感染复数为30 MOI。
2.5 噻唑蓝(MTT)检测细胞增殖能力
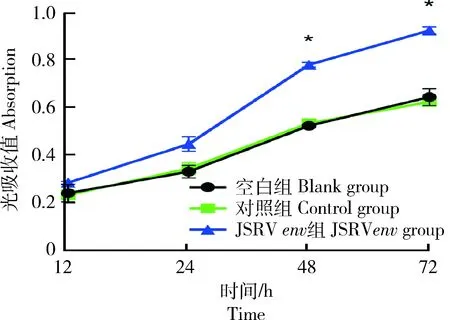
为研究JSRV-env重组慢病毒能否引起NIH3T3细胞增殖发生变化,采用MTT法检测空白(未感染细胞)组,以及30 MOI感染条件下JSRV-env过表达(感染JSRV-env重组慢病毒)组和对照(感染慢病毒空载体)组的细胞增殖能力。比较各组细胞第12、24、48和72 h的光吸收值,结果表明感染重组慢病毒的NIH3T3细胞中各时间点光吸收值均高于空白组和对照组,其中在48和 72 h 光吸收值差异显著(P<0.05)(图5)。以上结果表明,过表达JSRV-env可以上调NIH3T3细胞的增殖能力。
3 讨论与结论
3.1 JSRV-env过表达载体
本研究针对JSRV致癌基因env构建过表达慢病毒并进行体外NIH3T3细胞感染,为进一步了解env致瘤机制提供新的研究方法。在前人的研究中,由于JSRV-env真核质粒载体构建流程简单、试验周期短,而成为过表达JSRV-env的主要工具[5-8]。但质粒转染存在许多缺陷:首先,JSRV-env质粒在细胞内转染效率不稳定,不同细胞在不同转染方法和不用转染介质中,转染效率差别大,且大部分细胞转染效率不高;其次,JSRV-env质粒转染进入细胞核效率低,特别是阳离子脂质体对细胞损伤较大[11]。与质粒相比,病毒载体转染效率高,可实现体外细胞的高效且稳定转导[12]。目前常用的两种JSRV-env真核质粒共2种:一种为带HA标签的pcDNA3.1真核质粒[13];另一种为带HIS标签的pcDNA4.0质粒[9]。其中,pcDNA3.1质粒需要插入SPA提高JSRV-env表达效率[13],与JSRV-env质粒转染细胞相比,JSRV-env慢病毒载体感染细胞一方面可以过表达env;另一方面慢病毒的长末端重复序列(Long terminal repeats,LTRs)含有病毒启动子和增强子元件能够增强病毒的表达,极大地还原了病毒对细胞的作用条件,是目前 JSRV-env过表达较为理想的载体[14]。
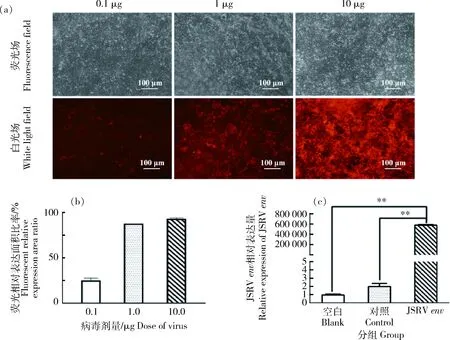
(a)倒置显微镜白光场和荧光场下,不同病毒量的 pCMV-dR8.91-JSRV-env重组慢病毒感染 293T 细胞 72 h 后的荧光蛋白表达情况;(b)不同病毒感染量的 JSRV-env 慢病毒感染 293T 细胞 72 h 相对荧光蛋白表达率分析结果;(c) pCMV-dR8.91-JSRV-env 感染 293T 细胞 72 h,Real-time PCR 检测 293T 细胞中 JSRV-env 相对表达量分析.(a) Fluorescent protein expression of 293T cells infected with pCMV-dR8.91-JSRV-env with different viral amounts under white light field and fluorescent field of an inverted microscope for 72 h. (b) Relative fluorescence analysis results of protein expression rate; (c) pCMV-dR8.91-JSRV-env infected 293T cells for 72 h, Real-time PCR analysis of the relative expression of JSRV-env in 293T cells.**表示极显著性差异(P<0.01)** indicate extremly significant differences (P<0.01)图3 JSRV-env重组慢病毒滴度测定Fig.3 Titer determination of JSRV-env recombinant lentivirus
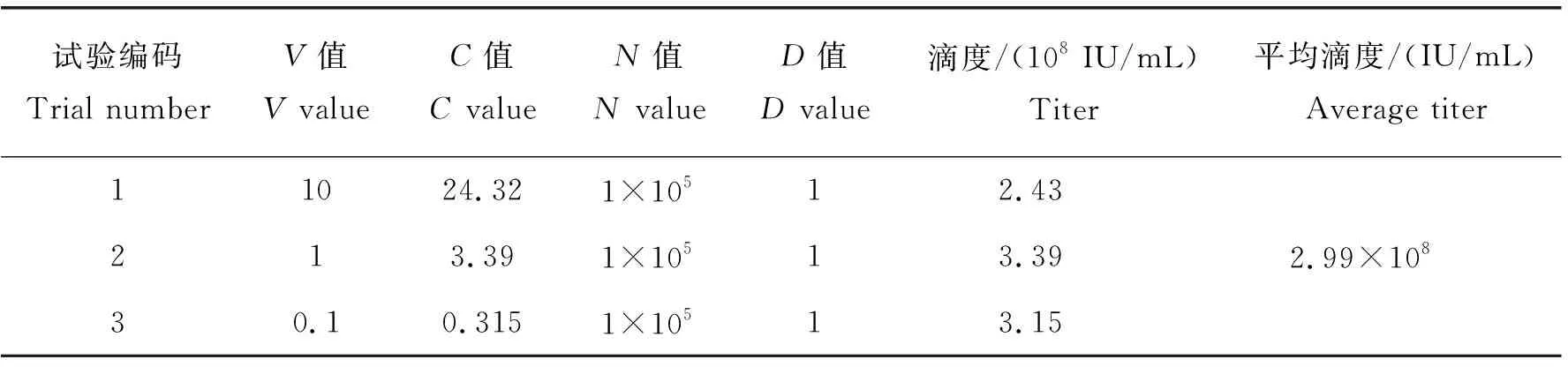
表3 JSRV-env重组慢病毒滴度Table 3 Virus titers of JSRV-env
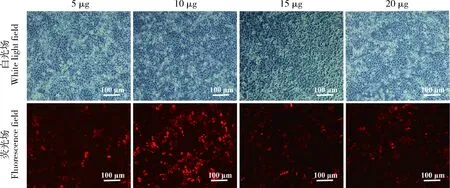
图4 不同载量 JSRV-env 重组慢病毒感染 NIH3T3 细胞Fig.4 NIH3T3 cells infected with JSRV-env at different loads
*表示显著性差异(P<0.05)* indicates significant difference (P<0.05)图5 MTT法检测JSRV-env慢病毒感染 NIH3T3 细胞增殖Fig.5 Detection of proliferation of NIH3T3 cells infected with JSRV-env lentivirus by MTT assay
3.2 JSRV-env 体外诱导细胞增殖机理
在本研究中JSRV-env重组慢病毒以最佳感染条件转染NIH3T3细胞72 h,噻唑蓝(MTT)检测显示,JSRVenv过表达可显著促进NIH3T3细胞增殖。Maeda等[9]利用pcDNA 3.1-JSRV-env真核质粒转染大鼠肾上皮细胞RK3E的研究与本研究结查基本一致。在JSRV-env过表达的大鼠肾上皮细胞RK3E细胞中,JSRV-env激活MEK-1(PD98059)和H/N-Ras(FTI-277)位点,Ras-Raf-MEK-MAPK途径被激活,从而介导细胞增殖[2]。此外也有报道指出添加MEK-1抑制剂PD98059于JSRV-env过表达的大鼠肾上皮细胞RK3E细胞中,可以抑制细胞转化但不影响细胞增殖,添加 H/N-Ras 抑制剂FTI-277可以影响细胞增殖但差异并不显著[15]。相反Ras-Raf-MEK-MAPK途径在犬肾MDCK细胞转化中不表现介导细胞增殖的生物学功能[2,7]。因此,阐明物种差异、细胞类型和试验条件对了解JSRV-env影响细胞增殖的机制具有重要意义[2,7,10]。基于以上研究结论,推测本试验中过表达JSRV-env的NIH3T3细中,JSRV-env不依赖Hayl2受体激活Ras-Raf-MEK-MAPK信号通路,通过介导细胞周期缩短最终造成NIH3T3细胞大量增殖[2,9-10],深入机理尚需进一步研究。本研究可为今后深入探讨JSRV-env诱导NIH3T3细胞信号通路激活、下游致病分子基础等,提供高效、稳定的JSRV-env体外转染模型。
3.3 结论与展望
本研究通过构建pCMV-dR8.91-JSRV-env慢病毒过表达载体,转染HEK 293T细胞成功获得JSRVenv重组慢病毒,并将JSRV-env重组慢病毒感染NIH3T3细胞,表明JSRV-env重组病毒显著促进对NIH3T3细胞增殖,为进一步揭示JSRV-env生物学作用及探讨JSRV致癌机制提供基础。未来可以将JSRV-env慢病毒载入不同类型细胞,通过构建多种JSRV-env体外过表达细胞模型,进一步探讨JSRV-env作用靶点及相关信号通路,更加完善JSRV-env致癌机制。