迷迭香酸协同ε-聚赖氨酸对金黄色葡萄球菌的抑菌机理初探
,*
(1.宁波大学食品与药学学院,浙江宁波 315800;2.浙江省动物蛋白食品精深加工技术重点实验室,浙江宁波 315800)
迷迭香酸(Rosmarinicacid,简称RA)是天然的水溶性酚酸类化合物,首先由两位意大利化学家从迷迭香(Rosmarinusofficialis)中分离出来[1-2],是咖啡酸和3,4-二羟基苯基乳酸由酯键相连形成的二聚体,其广泛分布于各类药用植物中,尤其是紫草科和唇形科植物[3]。ε-聚赖氨酸(ε-Polylysine,简称ε-PL)是天然的食品防腐剂,由25~30个L-赖氨酸残基组成,于1977年被Shima和Sakai从土壤中分离出来[4]。ε-聚赖氨酸具有广谱抗菌作用(AMP),能抑制酵母菌、真菌、革兰氏阳性菌、革兰氏阴性菌、噬菌体,可以作为新型抗生素抑制微生物,在日本已经被列入食品添加剂的清单[5]。而金黄色葡萄球菌作为一种常见的食源性肠道致病菌广泛地存在于自然界中,适宜环境下可产生肠毒素,人误食感染金黄色葡萄球菌食物会导致呕吐、腹痛等症状[6]。合理利用抑菌剂可以降低金黄色葡萄球菌带菌率,减少此类食源性疾病的发生。
近年来,迷迭香酸由于抗病毒、抗氧化、抗炎症等诸多生物学活性,使其在功能食品、香料、调味品、日用化工等领域均有广泛的应用,还可作为食品中潜在的植物化学补充剂和降糖剂[7-8]。ε-聚赖氨酸于2014年被列入我国食品添加剂的行列,可作为焙烤食品、熟肉制品、果蔬汁类的防腐剂[9]。目前研究表明迷迭香酸和ε-聚赖氨酸均有广谱抗菌作用,能抑制革兰氏阳性菌和阴性菌,两者均对大肠杆菌和金黄色葡萄球菌有抑制作用,前者对革兰氏阳性菌抑制效果更明显[8]。而抗生素滥用会导致耐药性细菌频繁出现[10],国内外学者对迷迭香酸和ε-聚赖氨酸的研究多集中于其各自生物学活性和应用上,对两者联合使用抑菌效果尚未报道。
本研究旨在评估迷迭香酸和ε-聚赖氨酸联合使用及单独使用迷迭香酸或ε-聚赖氨酸的抑菌效果,并根据这两种抑菌成分对金黄色葡萄球菌的协同作用,得到最低抑菌浓度指数,降低其使用剂量,从而最大程度地减少这些抗菌成分可能存在的潜在毒副作用,进而将这两种抑菌成分的复合物广泛地应用于食品领域。
1 材料与方法
1.1 材料与仪器
大肠杆菌(Escherichiacoli)、金黄色葡萄球菌(Staphylococcusaureus)、荧光假单胞菌(Pseudomonasfluorescens) 宁波大学实验室保藏菌种;迷迭香酸(≥97%)、ε-聚赖氨酸(MW<5000) 麦克林试剂公司(中国);LB肉汤培养基(配方:胰蛋白胨10.0 g,酵母提取物5.0 g,氯化钠10.0 g,pH7.0±0.2,加水定容至1 L)、LA琼脂培养基(配方:牛肉膏1.0 g,酵母膏2.0 g,蛋白胨5.0 g,NaCl 5.0 g,琼脂15.0 g,pH7.4,加水定容至1 L) 青岛高科园海博生物技术有限公司;SDS-PAGE变性丙烯酰胺凝胶快速制备试剂盒、还原糖含量检测试剂盒 北京索莱宝科技有限公司;Brandford法蛋白质定量检测试剂盒 上海生工生物工程股份有限公司。
AL204电子天平 梅特勒-托利多仪器(上海)有限公司;LDZF-50L-П型立式高压蒸汽灭菌器 上海申安医疗机械厂;SW-CJ-2D超净工作台 苏州华科净化设备有限公司;QHZ-12A组合式恒温震荡培养箱 宁波江南仪器制造厂;Eppendorf centrifuge 5418R 德国Eppendorf公司;Infinnite200pro酶标仪 瑞士TECAN公司;梯度PCR仪 宁波欧普仪器有限公司。
1.2 实验方法
1.2.1 抑菌剂的配制和菌种的活化纯化 参照Liu等[10]和Balakrishnan等[11]实验方法,用纯水将迷迭香酸(RA)和ε-聚赖氨酸(ε-PL)配成质量浓度分别为16和3 mg/mL的母液,用0.22 μm的无菌滤膜过滤除菌,4 ℃冰箱冷藏备用。
将实验室保藏的菌种接种至100 mL的LB肉汤培养基中,37 ℃ 150 r/min震荡培养10 h,再于固体琼脂培养基平板上划线,划线后的平板在37 ℃培养箱中倒置培养48 h。用接种环挑取单个菌落接种至无菌肉汤培养基中,37 ℃ 150 r/min震荡培养箱中再培养6~8 h,菌液离心并用生理盐水冲洗2~3次,保存于30%甘油中,-40 ℃冰箱冻存。每次使用时取200 μL接种至100 mL的灭菌LB肉汤培养基中,37 ℃、150 r/min震荡培养6~8 h后,通过稀释调节浓度至105~106CFU/mL。
1.2.2 最小抑菌浓度(MIC)的测定 采用肉汤稀释法[11],将迷迭香酸和ε-聚赖氨酸用无菌LB肉汤分别二倍稀释成一定浓度梯度(8、4、2、1、0.5、0.25、0.125、0.0625 mg/mL和1.5、0.75、0.375、0.1875、0.09375 mg/mL)。每个浓度抑菌液中接种2%(V/V)活化后的菌液105CFU/mL,置于37 ℃ 150 r/min的恒温培养箱震荡培养24 h,以不加抑菌液为空白对照。用肉眼观察是否有沉淀物,600 nm吸光度检测,得到两种抑菌成分的MIC值,重复测定三次[12]。
1.2.3 棋盘法检测RA和ε-pL的联合抑菌效果 棋盘法:参照周亚滨[13]的方法,依赖于各抑菌成分单独使用时的最小抑菌浓度(MIC)为基础,在96孔细胞板上将抑菌剂按不同方向二倍稀释,进行交叉配合。1~10列每孔依次加入二倍梯度稀释的迷迭香酸溶液50 μL,A~F行每孔加入二倍梯度稀释的ε-聚赖氨酸溶液50 μL,第11列每孔中ε-聚赖氨酸梯度浓度溶液作为对照,第G行每孔中加入迷迭香酸梯度浓度溶液作为对照,每孔中加入菌液(105CFU/mL)100 μL,混合均匀,于37 ℃ 150 r/min培养18 h,观察是否有肉眼可见菌,实验重复测定三次。FICI(Fractional inhibitory concentration index),即抑菌浓度指数[14]。
结果评价[15]:FICI≤0.5,协同作用(synergy);FICI≥4,拮抗作用(antagonism);其他情况均为无相互作用(no interaction)。
1.2.4 抑菌动力学曲线 参照Liu等[10]的实验方法,采用液体培养法来测定。于96孔板上每孔加入100 μL菌悬液(105CFU/mL)和100 μL的抑菌剂,混合均匀后置于37 ℃、150 r/min的恒温培养箱震荡培养,每隔2 h测定620 nm处吸光度,连续测定24 h。以不加抑菌剂的菌液作为对照,实验做三组平行。抑菌动力学的公式为:
式中:A0为对照组的吸光度,A为实验组的吸光度。
1.2.5 迷迭香酸和ε-聚赖氨酸的抑菌圈直径 通过牛津杯法来测定抑菌圈,参照Wang等[16]研究方法加以修改。培养至对数生长期的菌液经过稀释,使其菌落数约为105CFU/mL,吸取100 μL该稀释的菌液涂布于琼脂平板上,并将牛津杯放置于琼脂平板表面,分别加入200 μL的MICRA、2MICRA、MICε-PL、2MICε-PL、1/4MICRA+1/4MICε-PL、1/2MICRA+1/2MICε-PL,对照组加入等量的无菌蒸馏水。在4 ℃条件下静置扩散6 h后,37 ℃恒温培养箱中培养24 h,再测定抑菌圈直径,每组实验平行做三次。
1.2.6 迷迭香酸和ε-聚赖氨酸对细菌还原性糖和可溶性蛋白的影响 还原糖含量的测定参照崔凯宇[17]方法:取活化后的菌液1 mL接种到100 mL灭菌LB肉汤培养基中,37 ℃ 150 r/min震荡培养4 h后菌液离心,重悬于无菌肉汤培养基中,调节菌液浓度约为108CFU/mL,用此菌悬液稀释RA的浓度为MICRA,ε-PL的浓度为MICε-PL,以及RA和ε-PL协同抑菌浓度,以不加抑菌剂的菌悬液做空白对照。实验参照还原糖含量检测试剂盒说明书,分别提取2、4、6 h的上述培养液1 mL,3000 r/min离心10 min后去上清,菌沉淀参照还原糖试剂盒测定540 nm处的吸光度。根据标准还原糖溶液绘制标准曲线,并根据标准曲线计算还原糖含量,实验重复三次。
可溶性蛋白含量的测定[18]:取上述实验培养2、4、6 h的菌液各1 mL,5000 r/min离心10 min后取上清液[19],按照Brandford法[20]于595 nm处测吸光度,用标准蛋白溶液绘制标准曲线,可溶性蛋白含量根据标准曲线测定蛋白含量,实验重复测三次。
1.2.7 迷迭香酸和ε-聚赖氨酸对菌表层蛋白的影响 参照Hamza等[14]实验方法,表层蛋白:将1.2.6中添加了抑菌剂的菌悬液于37 ℃ 150 r/min混合培养6 h后,离心(5000 r/min,10 min)后弃上清。菌沉淀重悬于1 mol/L LiCl中,重悬液体积占1/10,在42 ℃ 180 r/min摇床中震荡处理2 h,取部分上清液进行SDS-PAGE电泳分析[21]。
电泳:将上述样品与等体积蛋白上样缓冲液[22]混合后,沸水浴5 min,趁热上样,每孔10 μL。凝胶制备:15%分离胶(distilled water 2.4 mL,30% Acr-Bis(29∶1)5.0 mL,Gel buffer A 2.5 mL,10% APS 0.1 mL,TEMED 0.006 mL),5%浓缩胶(distilled water 1.0 mL,30% Acr-Bis(29∶1)0.5 mL,Gel buffer B 1.5 mL,10% APS 0.03 mL,TEMED 0.003 mL)。电泳跑胶电压先80 V,后120 V,2 h。电泳完毕,将凝胶与考马斯亮蓝R250染色液微波炉加热染色6~8 min后脱色1 h,观察结果并拍胶。
1.3 数据处理
每个处理重复三次,实验数据采用IBM SPSS Statistics 21软件进行数据ANOVA分析,通过OriginLab OriginPro 8.5软件(美国Origin Lab公司)进行绘图。
2 结果与分析
2.1 迷迭香酸与ε-聚赖氨酸对金黄色葡萄球菌的协同抑制作用
根据孙峋等[23]研究发现,迷迭香酸对金黄色葡萄球菌的抑菌作用明显大于大肠杆菌,而本试验如表1所示,迷迭香酸对金黄色葡萄球菌的抑菌效果也明显高于其他试验菌。又因ε-聚赖氨酸对金黄色葡萄球菌和大肠杆菌都表现出较强的抑制作用,所以采用棋盘法将两种抑菌剂进行联合作用实验,实验结果证明迷迭香酸和ε-聚赖氨酸在对金黄色葡萄球菌的相互作用的试验中表现出协同作用,协同指数为0.5。为迷迭香酸和ε-聚赖氨酸联合抑菌实验确定了抑制浓度,即1 mg/mL RA+0.0469 mg/mL ε-PL。李永波等[24]研究发现,迷迭香酸超过一定浓度时对金黄色葡萄球菌、肠杆菌属、沙门氏菌均有显著的抑菌效力,且对常见革兰氏阳性菌和革兰氏阴性菌有广谱抑菌作用。这与本试验迷迭香酸对金黄色葡萄球菌和大肠杆菌均有抑制作用相符,且验证了迷迭香酸对金黄色葡萄球菌较大肠杆菌抑制作用更强这一特性。

表1 迷迭香酸与ε-聚赖氨酸对金黄色葡萄球菌的协同抑制作用Table 1 Synergistic inhibitory effect of rosmarinic acid and ε-polylysine on Staphylococcus aureus
2.2 迷迭香酸和ε-聚赖氨酸对金黄色葡萄球菌抑菌直径的影响
如表2所示,迷迭香酸和ε-聚赖氨酸无论是单独还是联合使用,随着浓度的增大对金黄色葡萄球菌的抑菌圈直径都会增大,但是1/4MICRA+1/4MICε-PL对金黄色葡萄球菌的抑菌效果相当于2MICε-PL,可见迷迭香酸和ε-聚赖氨酸的协同效果明显。
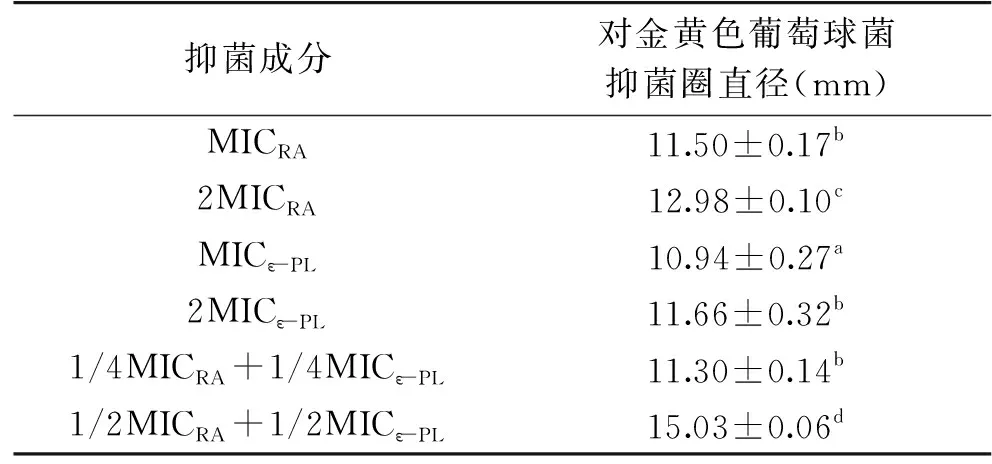
表2 迷迭香酸与ε-聚赖氨酸对金黄色葡萄球菌抑菌直径的影响Table 2 Effects of rosmarinic acid and ε-polylysine on inhibition zone of Staphylococcus aureus
2.3 抑菌动力学曲线
由图1可知,迷迭香酸和ε-聚赖氨酸在20 h内随着时间延长对金黄色葡萄球菌的抑制作用逐渐增强,两者最小抑菌浓度的抑菌强度相当,而1/4最小抑菌浓度的迷迭香酸和ε-聚赖氨酸的联合使用同1/4最小抑菌浓度的迷迭香酸和1/4最小抑菌浓度的ε-聚赖氨酸各自使用抑菌效果相当,表明联合使用抑菌剂可以降低各抑菌剂的浓度和使用量。Liu等[10]研究得出ε-聚赖氨酸和Nisin协同作用,可以大大降低这两种抑菌剂的抑菌浓度。
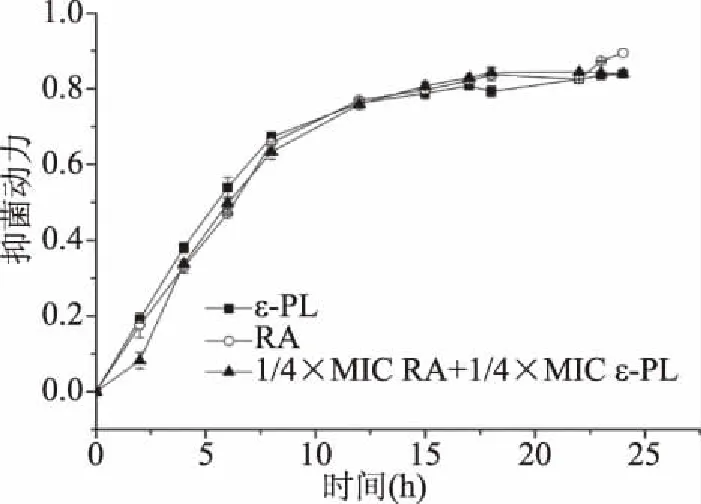
图1 抑菌动力学曲线Fig.1 Antibacterial dynamics of the antimicrobials注:抑菌剂浓度分别为:4 mg/mL RA、0.1875 mg/mLε-PL、1 mg/mL RA+0.0469 mg/mL ε-PL。
2.4 金黄色葡萄球菌胞内还原性糖含量的变化
如图2所示,随着处理时间的延长,在抑菌剂的作用下,金黄色葡萄球菌胞内还原糖泄漏量明显大于对照组。在6 h的处理时间内,对照组中的还原糖基本没有泄漏量,而处理组中的还原糖泄漏量随着时间的增加呈现上升趋势,且ε-聚赖氨酸的作用效果强于迷迭香酸,两种抑菌成分协同作用可以增强迷迭香酸的抑菌效果。结果表明,ε-聚赖氨酸可以显著(P<0.05)破坏金黄色葡萄球菌的细胞膜,其与迷迭香酸联合使用也可显著(P<0.05)促进菌体内还原糖的泄漏,随着处理时间的增加而增加。
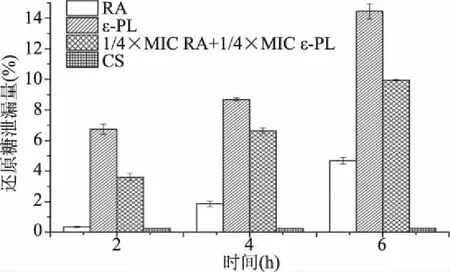
图2 抑菌剂对金黄色葡萄球菌中还原性糖含量的影响Fig.2 Effects of antibiotics on the reducing sugar from Staphylococcus aureus cells注:抑菌剂浓度分别为:4 mg/mL RA、0.1875 mg/mLε-PL、1 mg/mL RA+0.0469 mg/mL ε-PL、未加抑菌剂CS。
2.5 金黄色葡萄球菌胞内可溶性蛋白泄漏的情况
如图3所示,未添加任何抑菌剂的对照组,金黄色葡萄球菌上清液的可溶性蛋白含量随着时间的增长基本没有变化,而实验组与对照组相比均导致上清液可溶性蛋白含量增加,实验组中添加MIC迷迭香酸的导致菌可溶性蛋白泄漏量最多,其次是添加1/4MIC RA+1/4MIC ε-PL,最后是加入MIC ε-聚赖氨酸。在2~6 h随着时间的增长,添加RA和1/4MIC RA+1/4MIC ε-PL的这两组,可溶性蛋白逐渐增多,第8 h蛋白有少部分降解。加入ε-PL的这组在2~4 h间隔,可溶性蛋白有部分降解,而4~8 h又逐渐增多,说明这两种抑菌成分以及两种抑菌成分的结合能增加细菌细胞膜的通透性,导致胞内蛋白物质泄漏。蔡晓军等[19]实验发现,迷迭香中的1,8-桉叶素可以破坏沙门氏菌的细胞膜,导致菌的蛋白质发生泄漏。
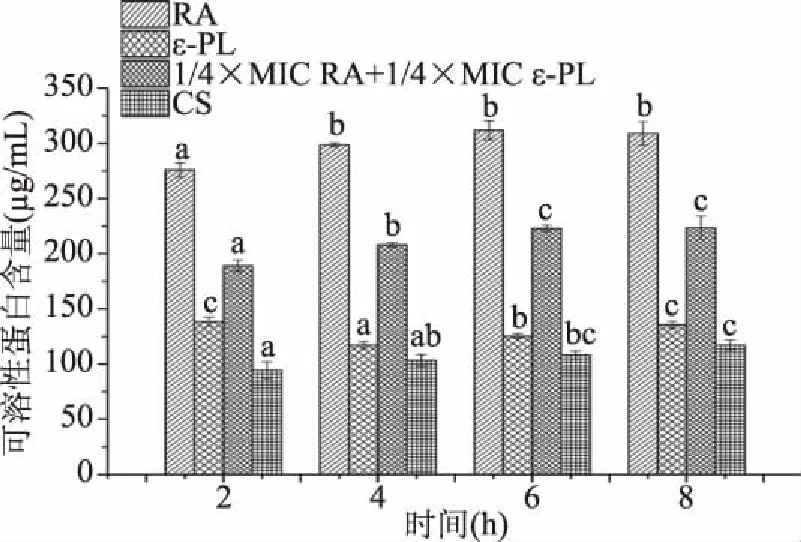
图3 抑菌剂对金黄色葡萄球菌菌液中可溶性蛋白含量的影响Fig.3 Effects of antibiotics on soluble proteins from Staphylococcus aureus注:抑菌剂浓度分别为:4 mg/mL RA、0.1875 mg/mLε-PL、1 mg/mL RA+0.0469 mg/mL ε-PL、未加抑菌剂 CS;不同小写字母表示同一处理方式不同时间数据差异显著,P<0.05。
2.6 金黄色葡萄球菌表层蛋白的SDS-PAGE电泳分析
由图4可知,与对照组相比在抑菌剂的作用下,金黄色葡萄球菌的表层蛋白分子表达发生了不同的变化。细菌表面膜蛋白中含有多种毒力因子,MSCRAMMs是最主要的毒力因子,其包括金黄色葡萄球菌(Staphylococcusaureus)中的聚集因子A(ClfA)、表皮葡萄球菌(Staphylococcusepidermidis)中的SdrG,以及其他金黄色葡萄球菌中类似胶原结合蛋白成分[25]。文华等[26]研究金黄色葡萄球菌在抑菌剂作用下,菌蛋白凝胶电泳图谱中出现了几条变化的蛋白条带,表明抑菌剂抑制了金黄色葡萄球菌可溶性蛋白的表达。添加迷迭香酸实验组中的金黄色葡萄球菌与对照组相比,相应的蛋白分子消失;添加ε-聚赖氨酸实验组中的金黄色葡萄球菌与对照相比出现其他小分子的蛋白,这也表明了迷迭香酸和ε-聚赖氨酸能抑制金黄色葡萄球菌可溶性蛋白的表达,从而抑制了菌表面毒力因子的毒性,表明RA和ε-PL对金黄色葡萄球菌的MSCRAMMs有抑制作用。
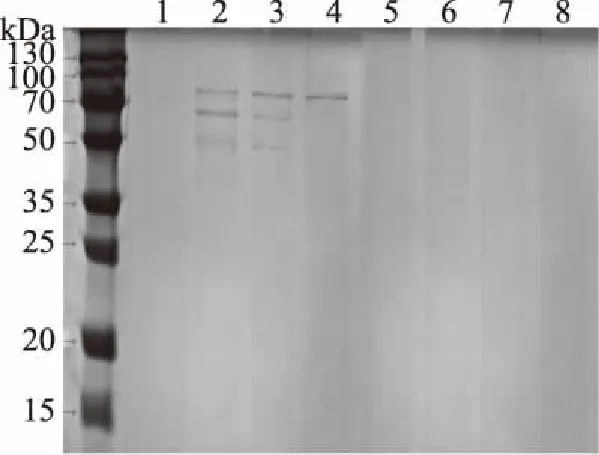
图4 抑菌剂对金黄色葡萄球菌表层蛋白的影响Fig.4 Effects of antibiotics on the surface layer proteins from Staphylococcus aureus注:泳道1:4 mg/mL RA、泳道2:0.1875 mg/mL ε-PL、泳道3:1 mg/mL RA+0.0469 mg/mL ε-PL、泳道4:不加抑菌剂、泳道5,6,7,8分别为前四者的上清液。
3 结论
实验表明迷迭香酸和ε-聚赖氨酸对金黄色葡萄球菌均有抑制作用,但是迷迭香酸的最小抑菌浓度值(MIC)较高,两种抑菌剂协同作用可以降低迷迭香酸的用量,即1 mg/mL 迷迭香酸+0.0469 mg/mL ε-聚赖氨酸的复合抑菌剂。迷迭香酸和ε-聚赖氨酸的复合对金黄色葡萄球菌的抑菌效果随着时间的增长而增强,蛋白泄漏量和还原糖的泄漏也随着作用时间的增长而增加,这表明两种抑菌成分可以破坏金黄色葡萄球菌的细胞膜,促使菌胞内蛋白和还原糖的泄漏。同时其可能抑制或降低了金黄色葡萄球菌MSCRAMMs的蛋白毒性,从而对金黄色葡萄球菌有抑制作用,为以后研究这两种抑菌成分协同抗菌作用机制提供了一定的参考依据。

