大连刺参多糖的提取纯化及体外抗氧化活性研究
,*
(1.大连海洋大学食品科学与工程学院,辽宁大连 116023;2.辽宁省海洋水产科学研究院,辽宁大连 116023)
我国海域分布有140多种海参,其中可被食用的有约40种[1],刺参属温带种,在我国主要分布于黄渤海区域。刺参富含多种生物活性物质,如刺参多糖、胶原蛋白、皂苷等[2],刺参多糖主要存在于体壁中,主要分为两类:一类为海参糖胺聚糖,即海参硫酸软骨素,另一类为海参岩藻聚糖硫酸酯[3]。研究表明,刺参多糖具有提高免疫力、抗肿瘤、抗疲劳、降三高等多种生理活性[4],但其在加工过程中很容易流失[5]。
目前海参多糖的提取方法主要有酶解醇沉法、碱提法、热提法等,提取分离得到的多糖蛋白含量较高。去除多糖中蛋白的方法有Sevage法[6]、三氯乙酸法(TCA)[7]及三氟三氯乙烷法等[8]。Sevage法虽然条件温和,但效率不高,需反复多次;TCA法脱蛋白效果较好,但其酸性环境易导致多糖水解,且易于残留;三氟三氯乙烷易挥发,较少使用。D-(+)-葡萄糖酸δ-内酯(GDL)是一种用来制作豆腐的蛋白凝固剂,水解后可使蛋白质凝结[9-10],达到脱蛋白的效果。目前有关GDL脱除多糖蛋白的报道较少。
本文以大连刺参为原料,通过酶解水提醇沉法提取多糖,采用响应面法对提取工艺进行优化,再用GDL对刺参粗多糖进行脱蛋白处理,通过正交试验,对脱蛋白条件进行优化,采用化学法评价其体外抗氧化活性,以期为刺参多糖的提取纯化工艺及生理活性的研究提供一定的参考。
1 材料与方法
1.1 材料与仪器
底播鲜活刺参 大连市长海县;95%无水乙醇、浓硫酸、酒石酸钾钠、苯酚、3,5-二硝基水杨酸 天津科密欧化学试剂有限公司;木瓜蛋白酶、考马斯亮蓝G-250、D-葡萄糖、牛血清蛋白、GDL、溴化钾 上海阿拉丁生化科技股份有限公司;所用试剂 均为分析纯。
WD-2102A全自动酶标仪 北京六一生物科技有限公司;JA1003电子分析天平、LC-10N-50C冷冻干燥机 上海力辰仪器有限公司;V-1300可见分光光度计 上海美析仪器有限公司;MS-TS分析天平 梅特勒-托利多国际有限公司;傅里叶转换红外光谱仪 FTIR-7600西安禾普生物科技有限公司。
1.2 实验方法
1.2.1 刺参粗多糖提取工艺流程 鲜活刺参→去内脏、洗净、匀浆→冷冻干燥→粉碎过80目筛→刺参冻干粉→酶解→醇沉→冻干。
称取适量刺参冻干粉,加入去离子水混合摇匀(固定料液比1∶30 g/mL),加入一定量的木瓜蛋白酶,在一酶解温度一定pH条件下提取3 h,98 ℃灭酶20 min,冷却至室温,9000 r/min离心15 min取上清液,加入3倍体积75%的乙醇,静置过夜,9000 r/min离心15 min取沉淀,冷冻干燥后得刺参粗多糖。
1.2.2 刺参粗多糖提取单因素实验 以刺参冻干粉为原料酶解提取刺参多糖,以刺参多糖提取率为指标,按1.2.1的方法分别进行单因素实验。固定料液比1∶30 (g/mL)、55 ℃、pH7.0条件下,考察加酶量0.5%、1.0%、1.5%、2.0%、2.5%对多糖提取率的影响;固定料液比1∶30 (g/mL)、加酶量1.5%、55 ℃,考察pH6.0、6.5、7.0、7.5、8.0对多糖提取率的影响;固定料液比1∶30 (g/mL)、加酶量1.5%、pH7.0,考察酶解温度45、50、55、60、65 ℃对多糖提取率的影响。
1.2.3 刺参粗多糖提取工艺的响应面法优化 依据单因素实验结果,以多糖提取率为响应值,加酶量、pH、酶解温度为自变量,根据Box-Behnken中心组合试验设计,进行三因素三水平的响应面分析试验,得出最佳酶解条件。实验因素水平见表1。

表1 响应面因素与水平设计Table 1 Factors and level designs of the response surface experiment
1.2.4 刺参多糖GDL脱蛋白工艺 将上述步骤获得的刺参粗多糖配成50 mg/mL的多糖溶液,加入一定量20%的D-葡萄糖酸-δ-内酯(GDL)溶液,在一定温度下恒温水浴反应一定时间,8000 r/min离心10 min取上清,加入3倍体积75%的乙醇,静置过夜,醇沉后得脱蛋白的多糖沉淀,冷冻干燥得脱蛋白的刺参多糖。
1.2.5 刺参多糖GDL脱蛋白单因素实验设计 以刺参多糖为原料,刺参多糖蛋白脱除率为指标,按1.2.4的方法,固定时间2.0 h、GDL加入量1.5%条件下,考察温度30、40、50、60、70 ℃对刺参多糖蛋白脱除率影响;固定温度50 ℃、GDL加入量1.5%条件下,考察时间1.0、1.5、2.0、2.5、3.0 h对刺参多糖蛋白脱除率影响;固定温度50 ℃、时间2.0 h条件下,考察GDL加入量0.5%、1.0%、1.5%、2.0%、2.5%对刺参多糖蛋白脱除率影响。
1.2.6 刺参多糖GDL脱蛋白正交试验设计 在单因素实验的基础上,以刺参多糖蛋白脱除率为指标,温度、时间、GDL加入量为因素,进行L9(34)正交试验,优化获得最优条件。正交实验设计如表2。
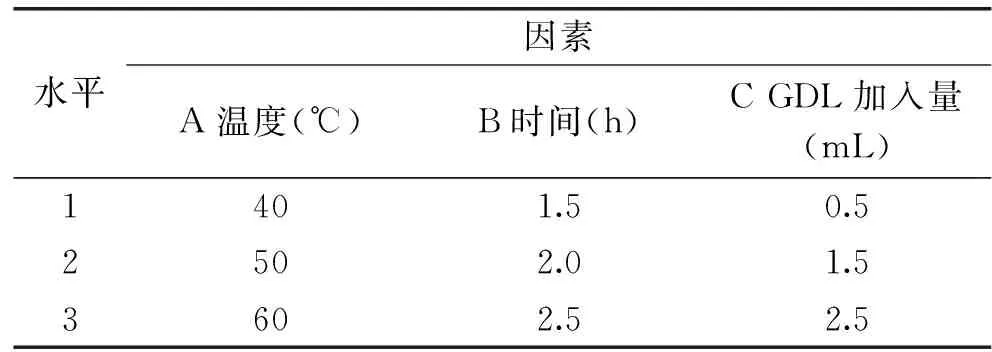
表2 正交试验水平及因素Table 2 Factors and levels of orthogonal array
1.2.7 刺参多糖含量的测定及提取率计算 采用苯酚硫酸法[11]测定总糖含量,采用3,5-二硝基水杨酸法[11]测定还原糖含量,刺参多糖含量(%)=总糖含量(%)-还原糖含量(%)。刺参多糖提取率(R)的计算公式为:
其中,M1为刺参多糖冻干粉质量(g);C1为刺参多糖冻干粉多糖含量(%);M2为刺参冻干粉质量(g);C2为刺参冻干粉多糖含量(%)。
1.2.8 蛋白质含量的测定 采用考马斯亮蓝法测蛋白质含量[12]。蛋白脱除率(R)的计算公式为:
其中:C′1为刺参多糖溶液中蛋白质含量(mg/mL),V1和V2分别为脱蛋白前后溶液体积(mL),C′2为脱除蛋白后刺参多糖溶液中蛋白质含量(mg/mL)。
1.2.9 刺参多糖结构分析 采用红外光谱法[2],取干燥后的刺参多糖1 mg,与干燥后的溴化钾粉末混合压成透明薄片,在傅里叶转换红外光谱仪上扫描红外光谱吸收值(500~4000 cm-1),分析得到刺参多糖结构。
1.2.10 刺参多糖的体外抗氧化性测定
1.2.10.1 DPPH自由基清除能力测定参考文献[13]的方法 分别向1 mL 0.5、1.0、1.5、2.0、2.5、3.0 mg/mL的多糖溶液中加入1 mL 0.1 mmoL/L DPPH乙醇溶液摇匀,避光反应30 min,于517 nm处测定吸光度值A1;以无水乙醇代替DPPH乙醇溶液于517 nm测定吸光度值A2,以无水乙醇代替多糖溶液测定吸光度值A0,以VC取代多糖溶液做阳性对照。DPPH自由基清除率计算公式为:
1.2.10.2 羟自由基清除能力测定 采用水杨酸法测定[14-15],分别向1 mL 1、2、3、4、5、6 mg/mL的多糖溶液中加入1.0 mL的9 mmol/L的FeSO4溶液,9 mmol/L水杨酸-乙醇溶液和8.8 mmol/L H2O2溶液,37 ℃水浴中避光反应30 min后于510 nm处测定吸光度B1,用蒸馏水代替H2O2溶液测吸光度值B2,用蒸馏水能代替多糖溶液测吸光度值B0。其清除率计算公式为:
1.2.10.3 超氧阴离子自由基清除能力测定 采用邻苯三酚自氧化测定[16-17],向1 mL 1、2、3、4、5、6 mg/mL的刺参多糖溶液中加入2 mL蒸馏水和3 mL Tris-HCl(pH=8.2)缓冲溶液,在25 ℃恒温水浴中10 min,加入50 μL邻苯三酚-HCl溶液,震荡后在325 nm测吸光度值,每10秒记录一次,以波长为横坐标,时间为纵坐标计算斜率K1;用蒸馏水代替样品溶液同样方法计算斜率K0,计算公式如下:
1.2.10.4 ABTS+自由基清除能力测定 参照文献[18-19]的方法,分别向0.2 mL 0.5、1.0、1.5、2.0、2.5、3.0 mg/mL的多糖溶液及VC对照液中加入0.8 mL ABTS工作液,摇匀后静置6 min,在734 nm下测定吸光度值C1,用无水乙醇代替样品溶液同样方法测定吸光度值C0,计算公式如下。
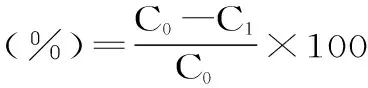
1.3 数据处理
单因素实验采用origin 8.6 和Excel 2010进行数据处理。Box-Behnken设计采用Design Expert 8.0.6 软件对响应面实验数据进行二次多项回归拟合方差分析、显著性检测和响应面分析,P<0.05 具有显著性差异,P>0.05差异不显著。正交试验采用SPSS 19.0进行设计分析。各组试验均重复3次,数据结果以平均值±标准偏差(n=3)的形式表示。
2 结果与分析
2.1 刺参多糖单因素实验结果
2.1.1 加酶量对多糖提取率的影响 由图1可知,随着木瓜蛋白酶用量增多,刺参粗多糖提取率呈现明显上升的趋势,在加酶量为1.5%时达到最高值,之后多糖提取率呈现缓慢下降的趋势。这可能由于酶浓度已达到饱和状态,之后酶解效率降低导致提取率下降[20]。因此,选择最佳加酶量为1.5%。

图1 加酶量对多糖提取率的影响Fig.1 Effect of enzyme content on polysaccharide yield
2.1.2 pH对多糖提取率的影响 不同pH对多糖提取率的影响如图2所示,在pH在6.5~7.0之间,随着pH的增加,刺参多糖提取率明显提高,在pH为7.0时达到最大值;当pH大于7.0后,多糖提取率趋于平缓后再明显下降。这是因为pH的高低直接影响蛋白酶的活性,当超过最适pH,酶活性受到抑制,因此,选择pH7.0为最佳条件。
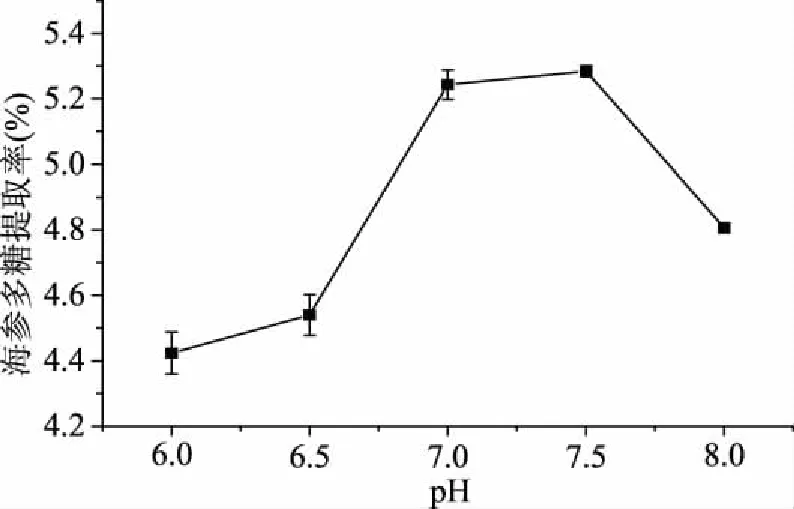
图2 pH对多糖提取率的影响Fig.2 Effect of pH on polysaccharide yield
2.1.3 酶解温度对多糖提取率的影响 由图3可知,在55 ℃之前,多糖提取率随温度的上升而增大,当温度在55 ℃时达到最大值5.28%,之后随着温度的上升呈现明显下降的趋势。与王婷等[21]的研究结果基本一致。这是因为酶的催化反应速度随着温度的升高而加快,但当达到酶的最适反应温度后,酶的稳定性会遭到破坏,导致酶解效率降低[22]。因此,选择最佳温度为55 ℃。

图3 酶解温度对多糖提取率的影响Fig.3 Effect of enzymolysis temperature on polysaccharide yield
2.2 刺参粗多糖提取响应面试验结果
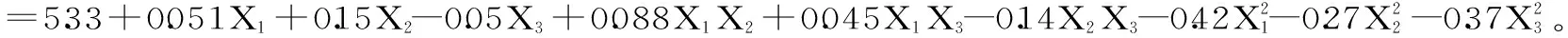
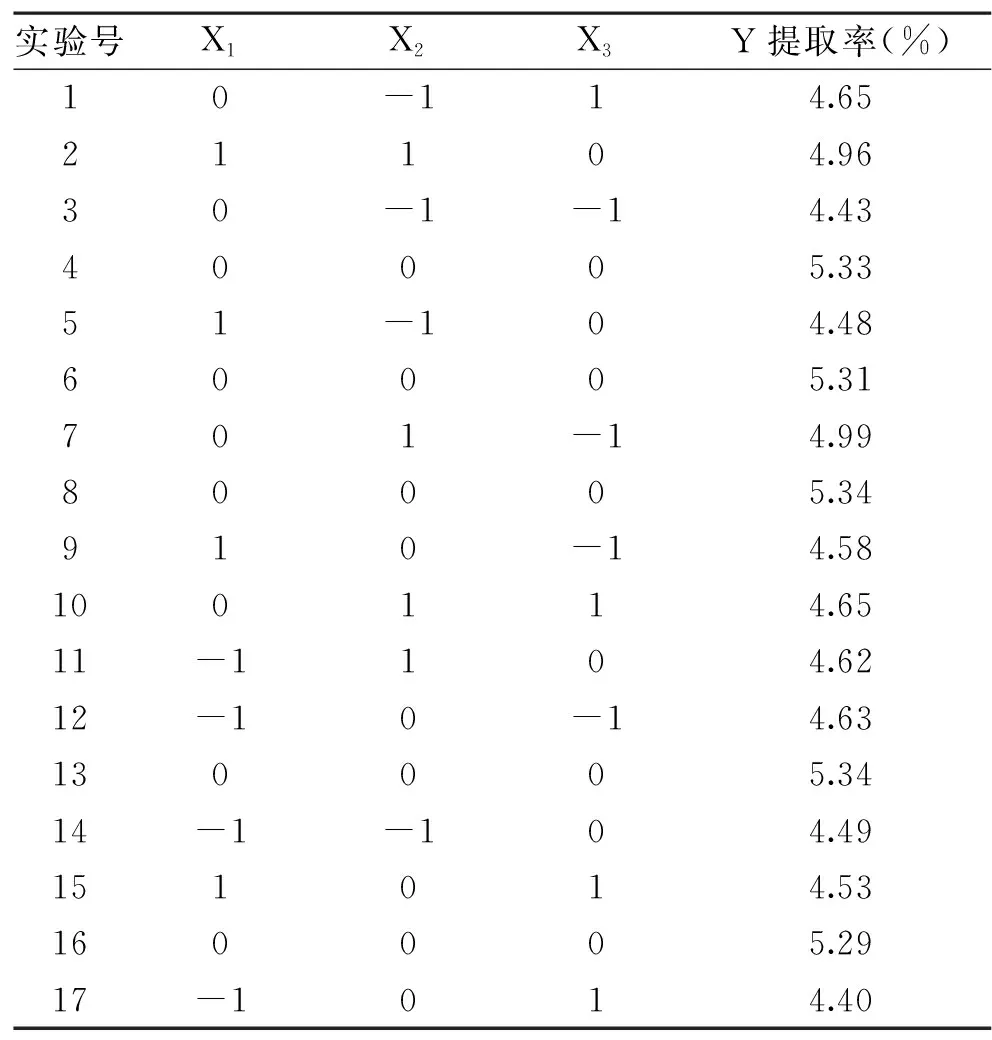
表3 响应面实验设计与结果Table 3 Experimental design and results of response surface methodology
模型方差分析如表4所示,模型的P<0.0001,说明此回归模型极显著,并且失拟项不显著(P>0.05),R2=0.9935,说明模型具有较好的拟合性[23]。一次项X2和交互项X1X2、X2X3及3个二次项达到极显著水平(P<0.01),一次项X1和X3达到显著水平(P<0.05),交互项X1X3不显著。P值越小,F值越大,则相应变量的显著程度越高,由表4可知,3个因素对多糖提取率的影响大小为:pH>加酶量>酶解温度。
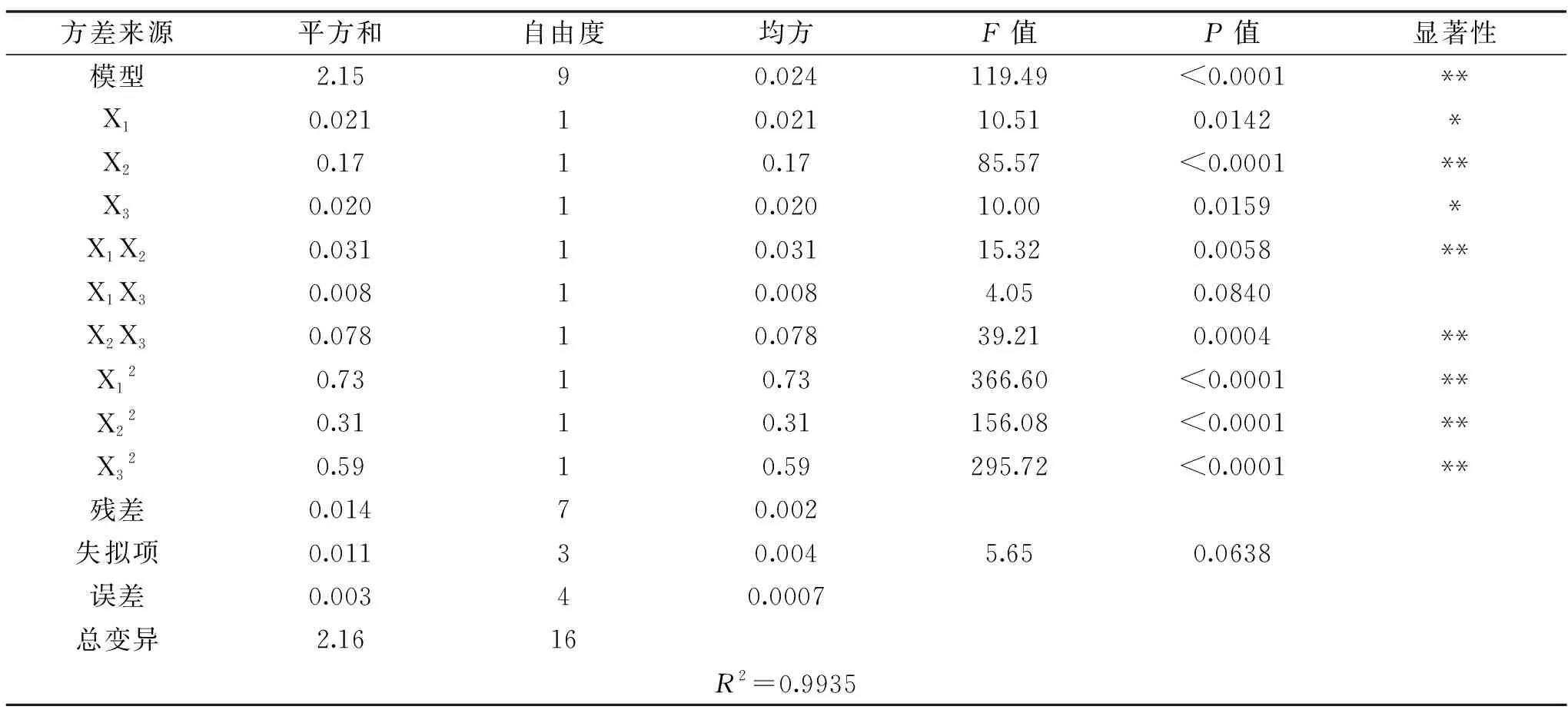
表4 回归模型方差分析Table 4 Variance analysis for the established native regression model
2.2.2 响应面分析与验证 响应面模型中3D曲面图的陡峭程度和等高线图的形状可以直接反映出自变量对因变量的影响情况及因变量间交互作用的显著程度[24]。当两因素间交互作用显著时,响应面越陡,等高线呈椭圆形;反之,响应面越缓,等高线呈圆形[25]。由图4可以看出,加酶量、酶解温度和pH彼此之间的交互作用对多糖提取率的影响显著(P<0.05),与方差分析结果一致。响应面优化得到的刺参多糖提取最佳条件为:加酶量1.59%、pH7.31、酶解温度53.80 ℃,预测值的刺参多糖提取率为5.36%。为了便于实际操作,将工艺参数调整为加酶量1.60%、pH7.30、酶解温度54.0 ℃,在此工艺条件下刺参多糖提取率为5.34%±0.04,与预测值相比,相对误差仅为0.02。
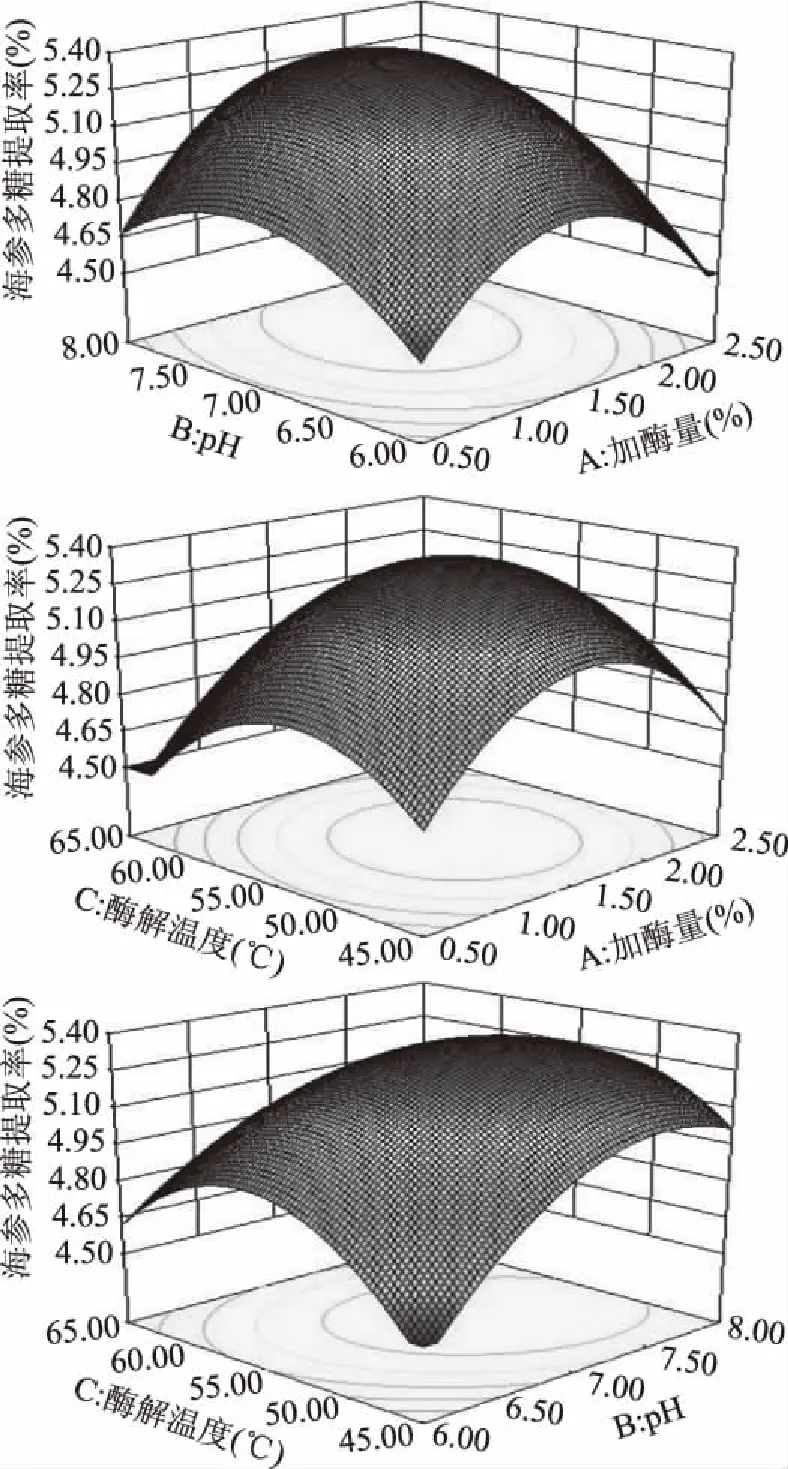
图4 各因素交互作用响应面图Fig.4 Response surface map of interaction of various factors
2.3 刺参粗多糖GDL脱蛋白提取工艺优化结果
2.3.1 刺参粗多糖GDL蛋白脱除单因素实验结果 温度、反应时间和GDL加入量对蛋白脱除率的影响如图5~图7所示。随着GDL加入量的增加,蛋白脱除率呈现上升的趋势,当GDL加入量达到2.0 mL时,蛋白脱除率趋于稳定;随着温度的升高,蛋白脱除率呈现增加的趋势,在50 ℃达到最高,之后呈现下降的趋势;在1.0~2.0 h蛋白脱除率随着时间的延长呈现上升的趋势,但上升幅度较小,仅为1.67%,2.0 h之后呈现下降的趋势,但幅度也很小仅为1.74%。
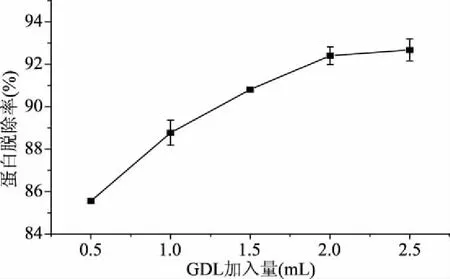
图5 GDL加入量对粗多糖蛋白脱除率的影响Fig.5 Effect of GDL addition on crude polysaccharide deproteinization yield
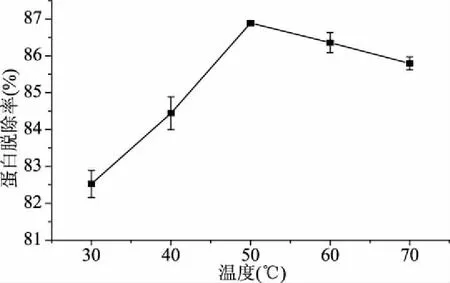
图6 温度对粗多糖蛋白脱除率的影响Fig.6 Effect of temperature on crude polysaccharide deproteinization yield
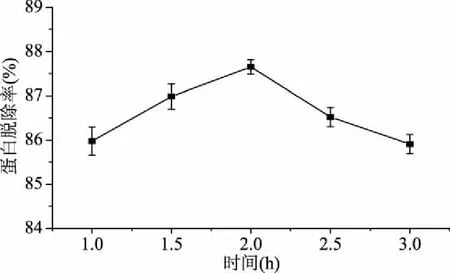
图7 反应时间对粗多糖蛋白脱除率的影响Fig.7 Effect of time on crude polysaccharide deproteinization yield
2.3.2 刺参粗多糖GDL蛋白脱除正交试验结果 从表5~表6可以看出,GDL的加入量对刺参多糖蛋白脱除率影响显著,其他两个因素无显著影响。各因素对刺参多糖蛋白脱除率影响程度大小为C>A>B,即GDL加入量>温度>时间,其最优组合为A3B2C3,即反应温度60 ℃、反应时间2 h、GDL溶液加入量2.5 mL。验证试验得GDL蛋白脱除率为95.8%。
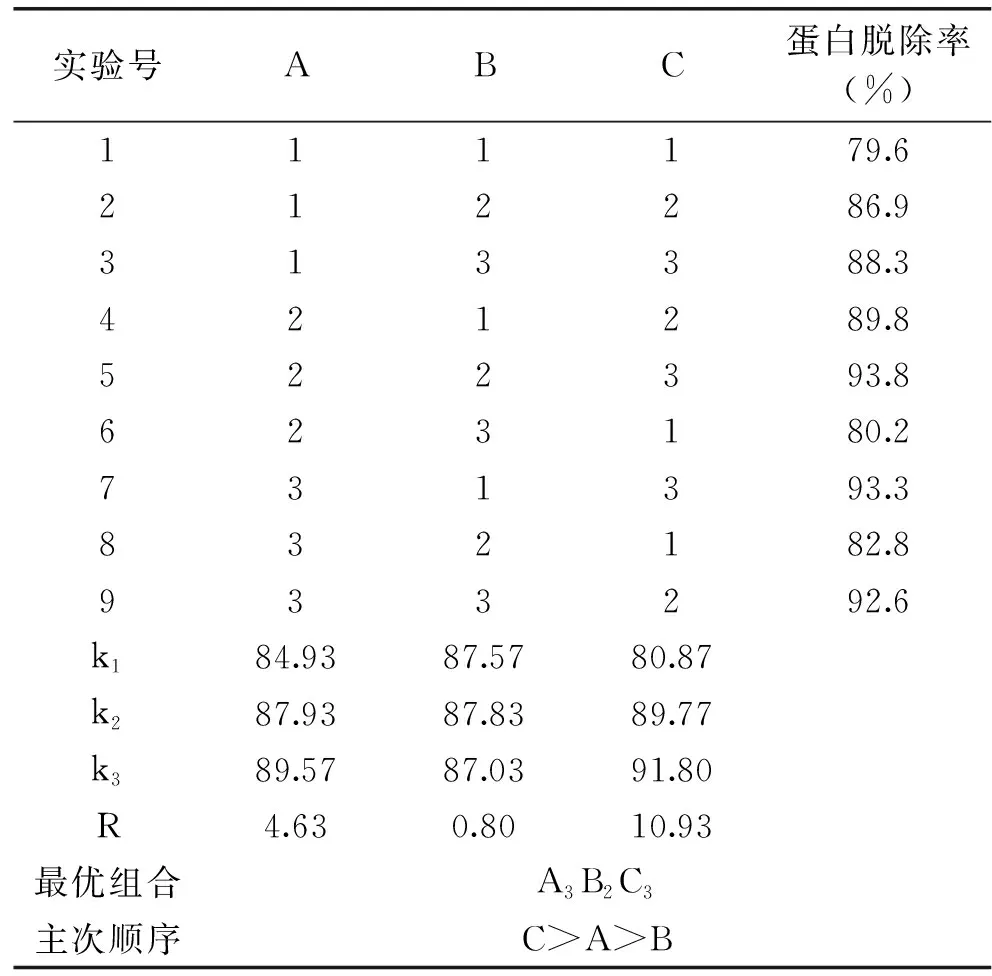
表5 蛋白脱除率正交试验结果Table 5 Orthogonal array design with experimental results of deproteinization yield
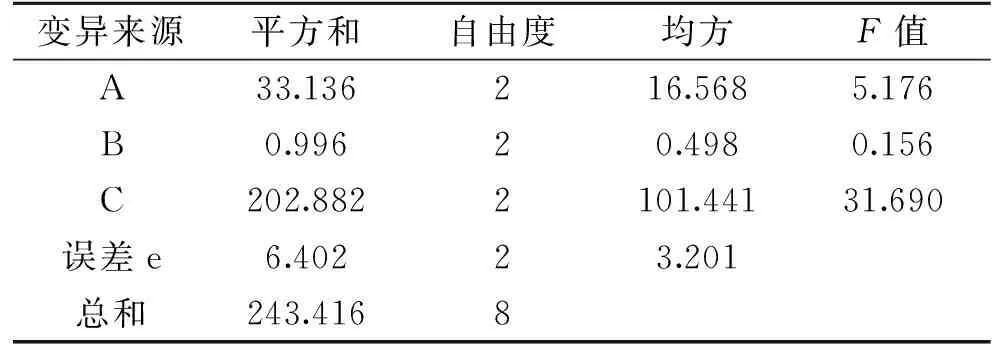
表6 GDL脱蛋白正交试验结果方差分析Table 6 Analysis of variance of the experimental results of orthogonal array design for GDL deproteinization
2.4 刺参多糖的红外光谱分析
刺参多糖的红外光谱图见图8。刺参多糖在3351 cm-1出现O-H和N-H伸缩振动峰,O-H为多糖的特征峰,N-H为糖胺聚糖的特征峰;在2949和2874 cm-1分别出现C-H伸缩振动(-CH2-)峰,由岩藻糖甲基引起[26];在1662 cm-1出现了C=O伸缩振动(-CHO)和(-CONH2)峰,为乙酰氨基的特有吸收峰[21];在1560 cm-1出现C=O非对称伸缩振动(-COOH)峰,为糖醛酸吸收峰;在1337和1411 cm-1出现O-H变角振动(-COOH)峰;在1256 cm-1出现S=O伸缩振动峰,说明刺参多糖富含硫酸基取代;在1026 cm-1出现C-O伸缩振动(C-O-H和C-O-C)峰;在851 cm-1出现C-O-S伸缩振动(轴向配位)峰,说明均存在α-端基差向异构C-H变角振动的糖环,含有α-D-葡萄吡喃糖环。当岩藻聚糖硫酸酯中C-2和C-4位存在双硫酸基取代时,会在837 cm-1处出现较强吸收峰[27],而刺参多糖在850 cm-1附近有吸收峰,说明C-4位可能在氨基半乳糖和岩藻糖的硫酸基取代。从C-O-S伸缩振动的波数,可以确定氨基半乳糖和岩藻糖上的硫酸基取代是轴向取代为横向取代[28],在1200~950 cm-1的波长范围内被称为分子的指纹识别,通过它可以鉴定多糖里的主要化学基团,吸收峰的位置和强弱是每个多糖所特有的[29]。
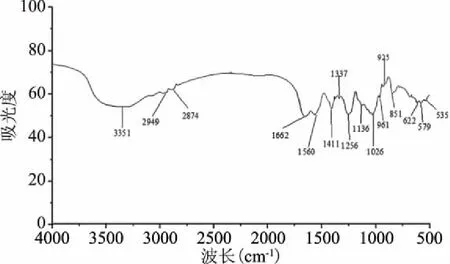
图8 刺参多糖红外光谱图Fig.8 FT-IR spectrum of sea cucumber polysaccharide
2.5 刺参多糖抗氧化活性分析
2.5.1 刺参多糖对DPPH的清除能力分析 DPPH自由基是一种稳定的有机自由基,已被广泛用于自由基清除能力的分析中[30]。刺参多糖和VC对DPPH自由基的清除能力结果如图9所示,刺参多糖对DPPH自由基的清除能力随着浓度的升高呈上升趋势,在浓度达到1.5 mg/mL时清除率达到72.6%并趋于稳定。而相同条件下,阳性对照组VC的清除率达到96.6%,由此可知,VC对DPPH自由基的清除能力更强,但刺身多糖也有一定清除DPPH自由基能力。通过计算分析得到刺参多糖的IC50为0.3 mg/mL。
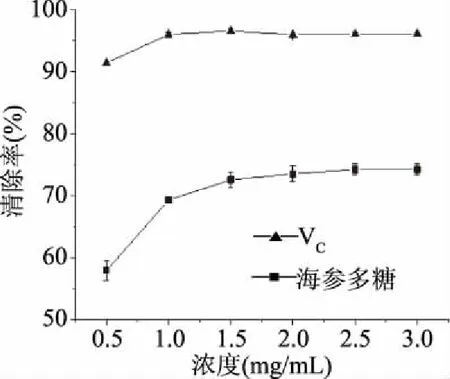
图9 DPPH自由基清除率Fig.9 Scavenging effects of DPPH free radical
2.5.2 刺参多糖对羟自由基的清除能力分析 羟自由基是目前已知活性氧中毒性最强的一种自由基,与衰老、肿瘤及细胞吞噬等有关,可导致机体的氧化性损伤,羟自由基清除率已成为活性物质抗氧化作用的重要指标[31-32]。刺参多糖和VC对羟自由基的清除能力结果如图10所示,刺参多糖对羟自由基的清除能力呈逐渐增强的趋势,在浓度达到4 mg/mL时清除率达到57.4%并趋于稳定,但低于相同浓度下VC的清除率99.2%。通过计算分析得刺参多糖清除羟自由基的IC50为4.5 mg/mL。
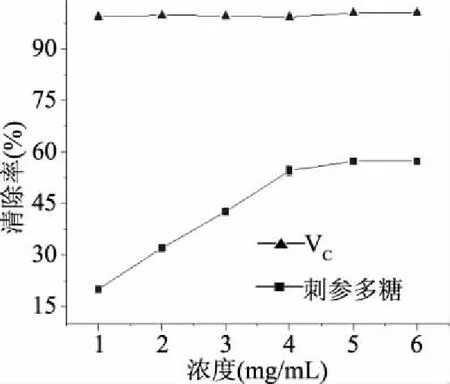
图10 羟自由基清除率Fig.10 Scavenging effects of hydroxyl free radicals
2.5.3 刺参多糖对超氧阴离子的清除能力分析 由图11可知,刺参多糖对超氧阴离子的清除能力随着多糖浓度的增大呈现上升的趋势,具有明显的量效关系,在浓度达到6.0 mg/mL时清除率达到71.7%。相同浓度下VC的清除率达到99.4%,刺参多糖的清除能力虽然不如VC,但清除率超过了50%,可以作为一种有效的超氧阴离子清除剂使用。通过计算分析得刺参多糖的超氧阴离子的清除能力IC50为3.9 mg/mL。
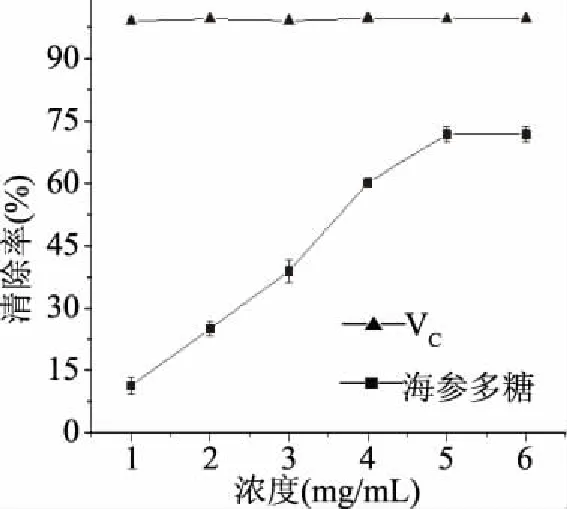
图11 超氧阴离子清除率Fig.11 Scavenging effects of superoxide anion
2.5.4 刺参多糖的ABTS+自由基清除能力分析 ABTS+自由基清除法已广泛应用于生物活性物质的抗氧化能力的评价中,是基于氧化剂可使ABTS+自由基溶液颜色发生变化,吸光度值降低[33]。从图12可知,在刺参多糖浓度小于1.5 mg/mL时,其ABTS+自由基清除能力呈现明显上升的趋势,之后趋于稳定,其清除率略小于VC的清除率95.7%,刺参多糖清除率达到90.4%。通过计算分析得刺参多糖清除ABTS+自由基的IC50为0.85 mg/mL。

图12 ABTS自由基清除率Fig.12 Scavenging effects of ABTS free radical
3 结论
木瓜蛋白酶酶解提取刺参多糖的最优酶解提取条件为:加酶量1.60%、pH7.30、温度54.0 ℃,在此条件下刺参多糖提取率为5.34%。GDL法脱除刺参多糖蛋白的最优条件为反应温度60 ℃、时间2 h、20% GDL溶液加入量2.5 mL,在此条件下蛋白脱除率为95.8%。刺参多糖对DPPH、羟自由基、超氧阴离子及ABTS自由基都有很好的清除作用,并呈现一定的量效关系,其中,刺参多糖浓度3.0 mg/mL时ABTS+自由基的清除能力最强,且与阳性对照VC的清除能力相差不明显,表明刺参多糖具有较强的抗氧化能力。这一提取方法可为刺参多糖的制备和产品开发提供理论依据。

