CT影像组学预测胃癌不同预后组织学分型的可行性
陈建, 黄海霞, 卢超, 王霄霄, 丁奕, 单秀红
(1. 江苏大学医学院, 江苏 镇江 212013; 2. 镇江市第五人民医院放射科, 江苏 镇江 212004; 3. 江苏大学附属人民医院放射科, 江苏 镇江 212002)
胃癌患者不同个体的预后有很大的差别,是由于不同的个体胃癌发生的原因不同,发展的途径也不一样,所呈现的组织类型及分子表型差异较大,即所谓的“肿瘤异质性”[1]。有文献报道[2]胃癌根治术后复发转移的危险因素包括肿瘤病理组织学类型、肿瘤大小、肿瘤分化程度、肿瘤部位等,其中组织学类型是预后的一个重要因素。Degiuli等[3]研究发现,低分化腺癌、黏液腺癌和印戒细胞癌淋巴结转移率高,预后差;高、中分化腺癌淋巴结转移率低,预后较好。Liu等[4]进行了一项针对11 073例胃癌病例的病理组织学类型与患者预后相关性的Meta分析,结果发现分化不良型胃癌术后5年死亡风险显著高于分化型胃癌(P<0.001),分化不良型胃癌包括低分化腺癌、黏液腺癌和印戒细胞癌,而分化型胃癌包括乳头状腺癌、高/中分化管状腺癌。Lai等[5]研究报道通过单因素和多因素分析显示性别、肿瘤大小、大体形态、浸润深度和WHO组织分型与淋巴结转移显著相关。有学者研究发现[6],胃黏液腺癌易出现淋巴结转移和浆膜侵犯,临床预后比非黏液腺癌差。因此,术前获取胃癌WHO组织学分型的信息对于治疗方案的合理制定以及患者的预后改善具有重要价值。
目前胃癌组织学分型的信息是靠术后病理获得的,胃镜活检虽然能提供肿瘤的组织学分型,但是只代表局部肿瘤组织,因此术前很难获得胃癌组织学分型的可靠信息。影像组学是一种深度挖掘影像信息、高通量提取影像特征的技术,可以提高肿瘤学中诊断和预后的准确性[7-10]。近几年基于CT的影像组学在胃癌方面的研究已经显示出了较好的前景,Ma等[11]采用CT影像组学模型来区分Borrmann IV型胃癌与原发性胃淋巴瘤,结果显示出对两种病变具有很高的区分能力;Ba-Ssalamah等[12]运用CT纹理特征来区分胃癌、淋巴瘤和胃肠道间质瘤;Dong等[13]建立了基于CT表型和Lauren类型的放射组学诺模图,在术前预测进展期胃癌隐匿性腹膜转移方面表现出了很大的临床应用潜力。本研究运用CT影像组学术前预测胃癌不同预后组织学分型,报道如下。
1 材料和方法
1.1 患者资料
本研究经江苏大学附属人民医院伦理委员会批准。收集2012年1月至2017年12月在江苏大学附属人民医院连续就诊的605例胃癌患者的临床资料,包括年龄、性别、CT-TNM分期、WHO组织学分型。入组标准: ①术后病理证实为胃癌并有明确的WHO组织学分型; ② 术前有规范的CT影像资料; ③ CT检查前无任何针对胃癌的治疗。排除标准: ① 少见类型癌(n=15); ② 肿瘤最小直径<5 mm,不足以包含感兴趣区域(n=12); ③ 胃癌病灶数量大于1(n=8)。最后,共有570例入组病例(男411例,女159例;年龄32~86岁,平均年龄62.6岁),包括7例乳头状腺癌、285例高/中分化管状腺癌、247例低分化腺癌、21例黏液腺癌和10例印戒细胞癌。我们将乳头状腺癌和高/中分化管状腺癌归为预后较好组,低分化腺癌、黏液腺癌和印戒细胞癌归为预后较差组。570例样本按照2 ∶ 1的比例被随机分为训练组和验证组。
1.2 CT图像采集
CT成像系统有Siemens Sensation 64层CT及飞利浦公司Briliance 256i CT。患者检查前准备:空腹4 h以上,检查前30 min饮水800~1200 mL,CT扫描前10~15 min臀部肌肉注射盐酸山莨菪碱20 mg。患者仰卧位扫描,行CT平扫后,经肘静脉注射非离子型对比剂碘海醇(270 mg/100 mL),注射总量为1.2 mL/kg,注射速率为3.0 mL/s,延迟30 s动脉期扫描,延迟70 s静脉期扫描,扫描范围自膈顶至胃下缘(或全腹),所有期相均在吸气后屏气完成。扫描参数:管电压120 kV,管电流220~250 mAs,层厚0.625 mm,螺距为1,平扫、动脉期和静脉期轴位重建层厚5 mm,静脉期冠状位重建层厚3 mm,软组织对比重建,矩阵512×512。图像重建后以无压缩DICOM数据上传PACS(加拿大思代)。
1.3 图像分割
下载CT图像的DICOM数据拷贝至个人计算机,使用软件ITK-SNAP在门静脉期轴位CT图像上找出肿瘤最大面积层面进行手动分割。图像分割首先由影像科腹部组主治医师进行病灶分割,其次是副主任医师进行肿瘤分割区的校正,再次是主任医师对肿瘤分割区进行最后校对。
1.4 特征提取及筛选
采用多因素分析筛选出与胃癌组织分型不同预后潜在关联较大的临床特征。使用基于Python的Pyradiomics包从所有分割图中提取二维图像特征,包括一阶统计特征、形状特征、纹理特征、小波特征和其他滤波特征。为了避免模型过拟合,使用最大相关最小冗余(mRMR)、最小绝对收缩和选择算子(LASSO)回归和逐步回归方法筛选掉冗余的影像组学特征,并获得有效特征。
1.5 模型的构建
通过图像有效特征构建影像组学标签。基于影像组学标签和临床特征的多因素Logistic回归分析的基础上构建影像组学模型。同时仅包含临床特征的临床特征模型被用来对比。所有模型都是在训练组上建立,并在验证组上进行测试。ROC曲线下面积(AUC)用于测试模型的性能,并计算特异度、灵敏度和准确度。
1.6 统计分析
统计学分析均使用R软件(3.6.0版)和Python(3.6版)进行。采用t检验和χ2检验比较训练组和验证组中不同预后组各临床特征的关系,采用Wilcoxon符号秩检验进行影像组学特征的单因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 临床特征
训练组包括381例患者,验证组包括189例患者。表1总结了训练组和验证组中患者的主要临床资料,两组间临床特征变量的分布差异无统计学意义(P>0.05)。通过多因素Logistic回归分析,剔除P>0.5的临床特征,最终纳入年龄、性别、CT-M分期。
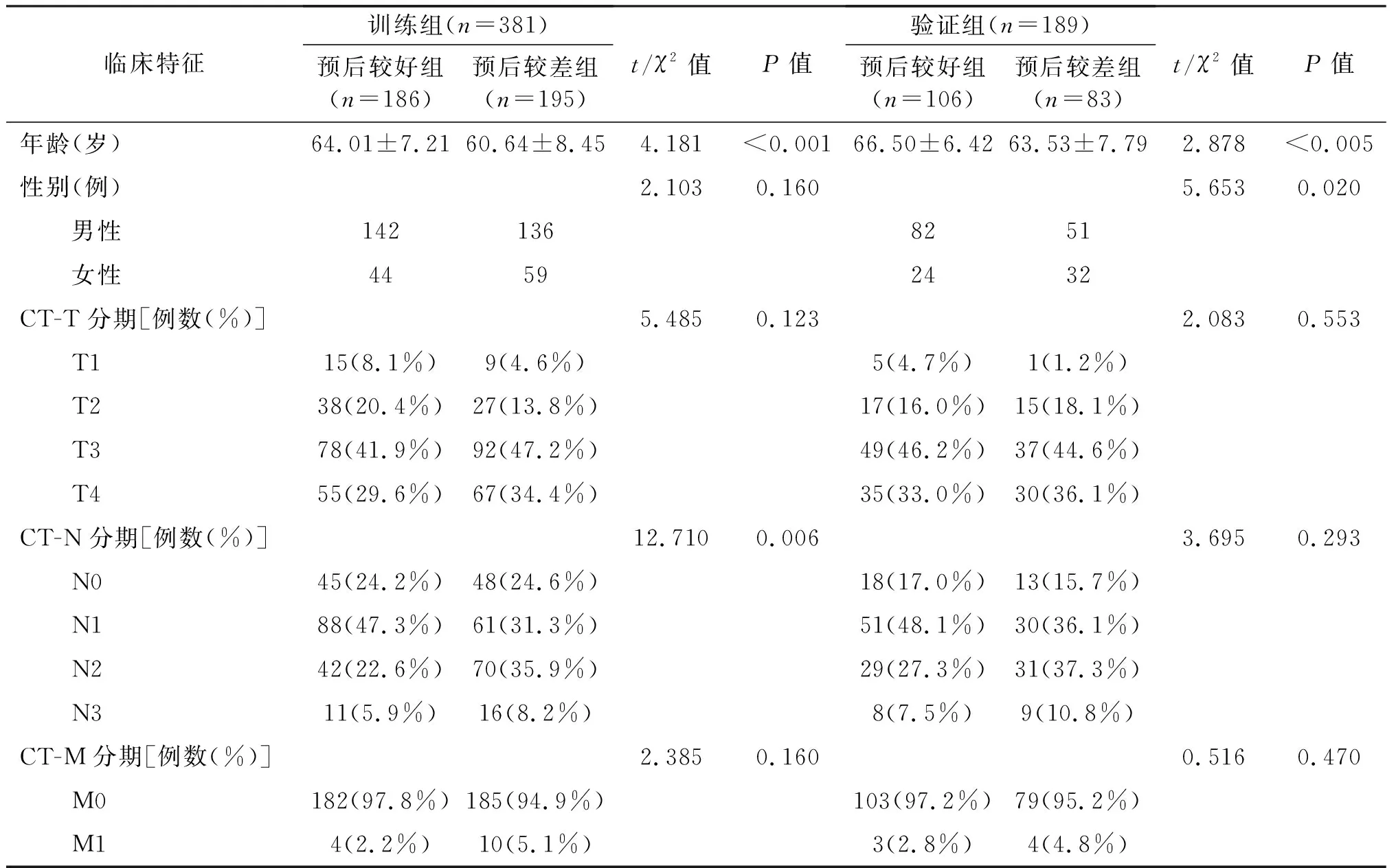
表1 训练组和验证组中患者的临床信息
2.2 影像组学特征选择
从所有分割图中提取了985个二维图像特征,包括18个一阶统计特征、12个形状特征、75个纹理特征、372个小波特征和508个其他滤波特征,通过mRMR对所有特征进行排序,然后通过LASSO筛选出了13个特征,再通过逐步回归算法进一步选择特征,最后得到了5个有效特征构建影像组学标签,见表2。
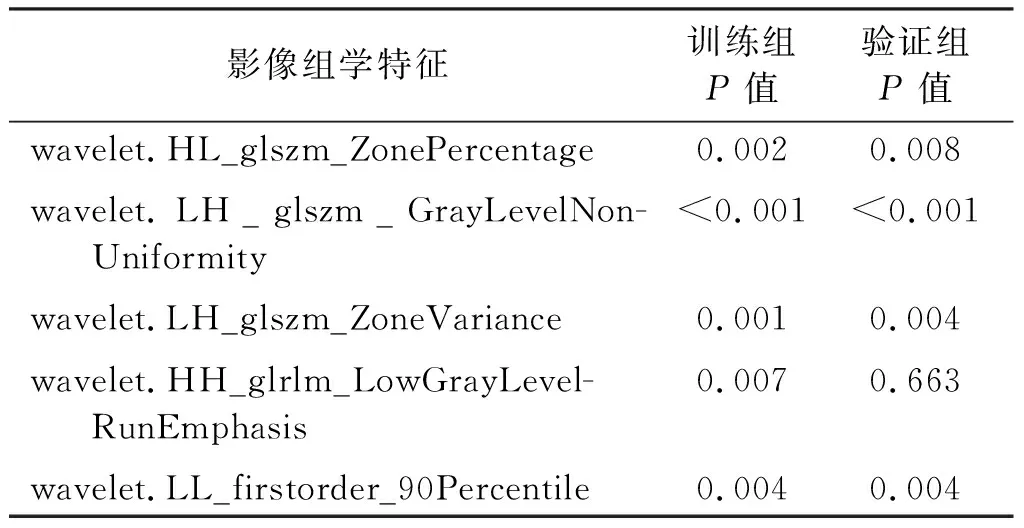
表2 影像组学特征筛选的结果
2.3 模型的评估
临床特征模型的AUC在训练组和验证组中分别为0.603 2(95%CI:0.546~0.660),0.612 6(95%CI:0.530~0.694)。影像组学标签的AUC在训练组和验证组中分别为0.676(95%CI:0.622~0.729),0.652(95%CI:0.572~0.731)。影像组学模型的AUC在训练组中为0.726 2(95%CI:0.676~0.776),在验证组中为0.707(95%CI:0.632~0.781)。各模型预测胃癌不同预后组织学分型的详细性能指标见表3。模型的决策曲线如图1所示,影像组学模型的构造如图2所示。影像组学模型的构造形式由左边的指标名称和右边对应的带有刻度的线段组成,它的构造参数包括影像组学标签、年龄、性别和CT-M分期4个部分,总分由4个参数对应的分值相加所得。由图2可见,随着总分的增加,模型预测为胃癌预后较差组织学分型的概率增大。
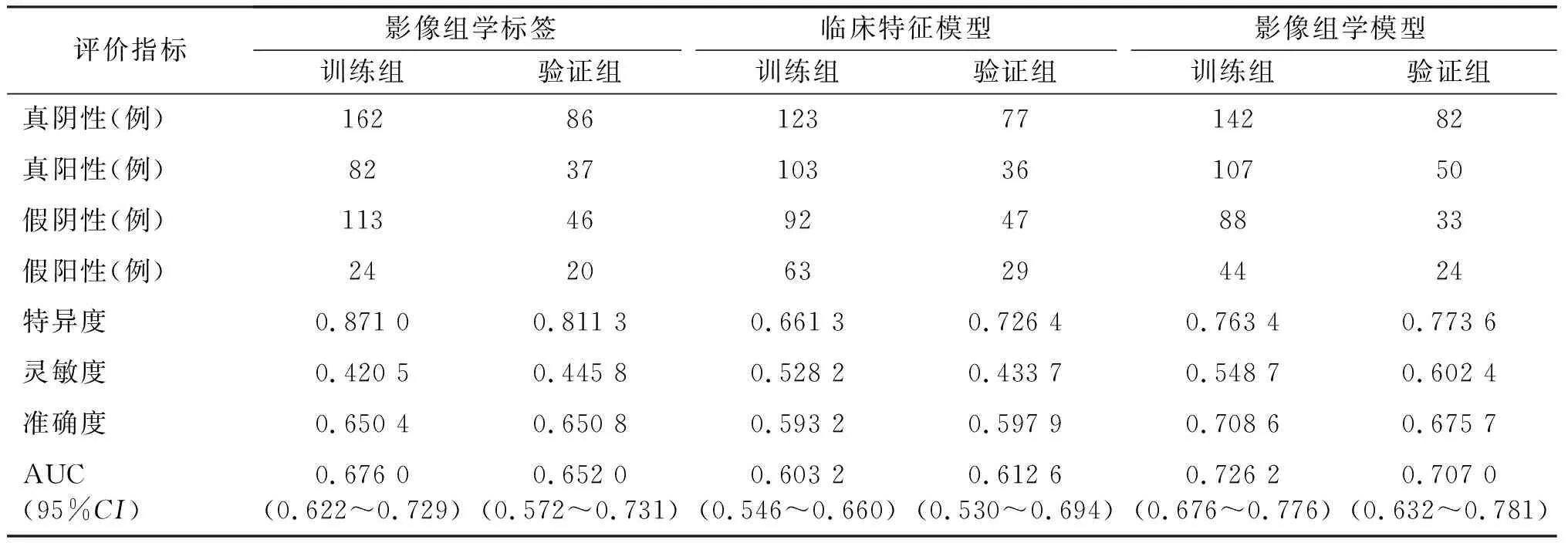
表3 模型性能的评价结果
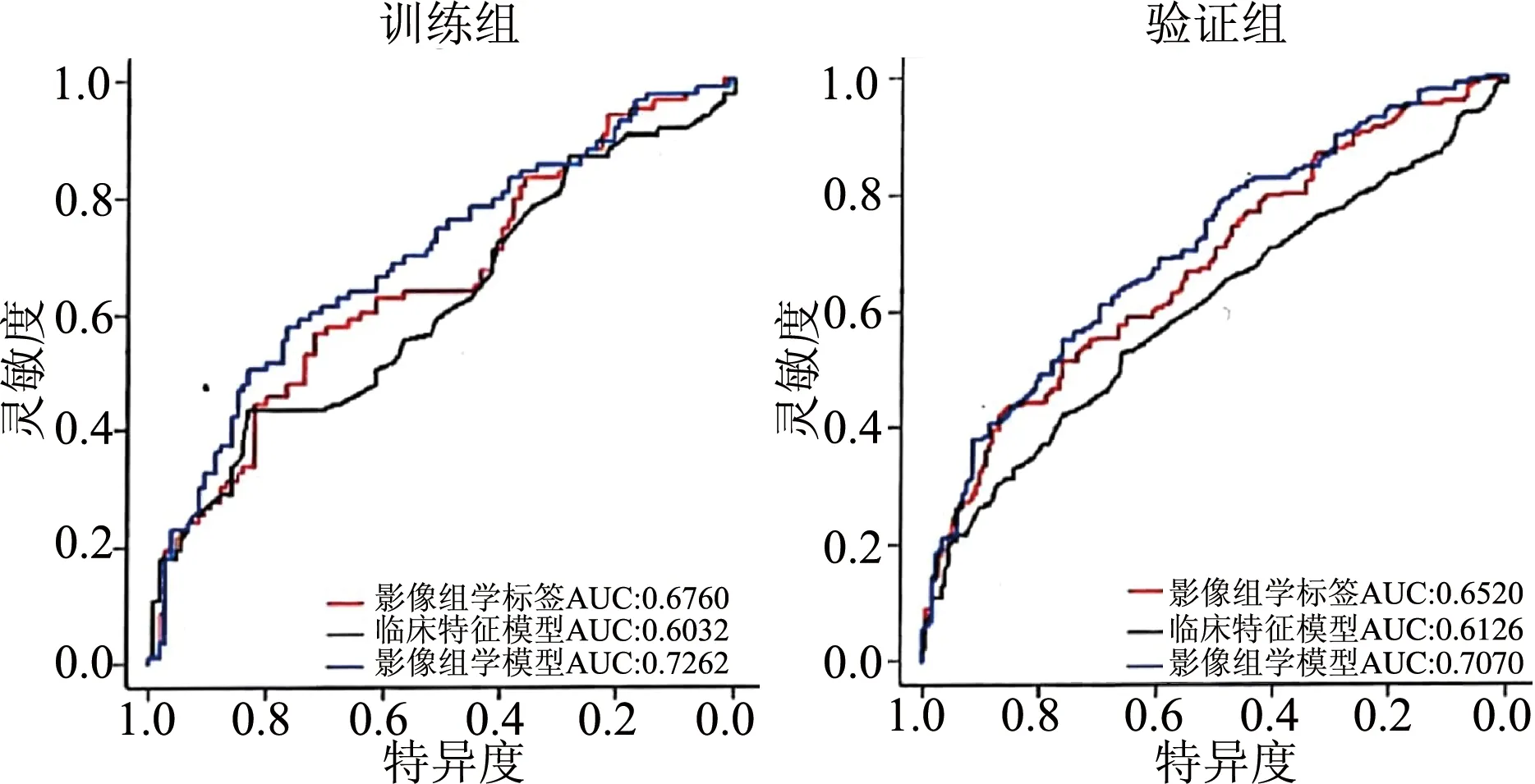
图1 三种模型的ROC曲线
3 讨论
胃癌的组织学分型临床上最常用的是WHO组织分型(1990版),分为腺癌及鳞状细胞癌、腺鳞癌、未分化癌等少见类型癌,腺癌又分为乳头状腺癌、管状腺癌、黏液腺癌、印戒细胞癌和低分化腺癌。依据文献研究结果[2-6],本研究将乳头状腺癌和高/中分化管状腺癌归为预后较好组,低分化腺癌、黏液腺癌和印戒细胞癌归为预后较差组。有研究者称这种划分为分化型胃癌和未分化型胃癌[14]。以上为胃癌常见类型,其他少见类型癌只占到胃癌的5%[15-16],不具有代表性,因此本研究将其排除在外。
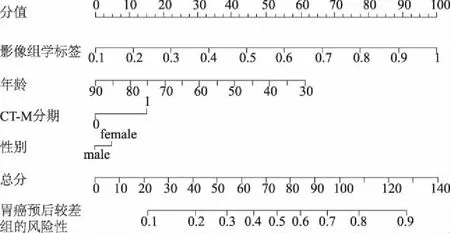
图2 影像组学模型的构造
肿瘤异质性是胃癌的重要特征之一,也是导致不同个体胃癌预后有较大差别的原因。胃癌的异质性与不同的组织学类型、发展的途径不同有关。不同的分化水平导致组织学形态的不同,分化较好的呈乳头状、腺管状,分化较差的呈巢状、弥漫片状及条索状,癌细胞内黏液分泌呈印戒状。肿瘤分化程度越差,肿瘤细胞的异质性越明显,其生物学行为侵袭性越高[17]。肿瘤组织这些微观层面的异质性在CT图像上表现为肿瘤病灶密度的不均匀性,这是影像组学方法研究肿瘤内部异质性的基础。
影像组学出现之前对于胃癌组织学分型的研究主要从病灶的CT强化方式和程度着手。例如邹茹欣等[18]研究认为,64排螺旋CT增强扫描病灶的强化程度和强化方式与胃癌WHO组织学分型密切相关。有学者研究发现,肿瘤的强化特点与组织学类型有一定的关系,腺癌和鳞癌在动脉期、门静脉期多呈明显的不均匀强化,在平衡期均匀强化;而黏液腺癌强化程度较低,并呈分层样改变[19]。
以上的方法对于图像信息的利用还远远不够,近几年研究人员借助影像组学的方法来分析胃癌组织的图像特征。Liu等[20]报道了CT纹理分析在预测胃癌组织病理特征方面的应用价值,发现肿瘤的纹理特征与Lauren分型相关,弥漫型胃癌门静脉CT图像的平均衰减、最大衰减等纹理参数明显高于肠型胃癌;且门静脉CT图像的纹理参数与胃癌的分化程度呈显著负相关。其研究中使用的数据来自107例胃癌患者,通过计算机软件读取已分割好的胃癌病灶感兴趣区域,自动生成包括平均衰减、分布范围等8个特征,再通过统计分析来评价CT纹理特征与组织病理特征之间的相关性。本研究入组样本量较大,有570例患者,这样能尽量保证模型的稳定性;其次样本被随机分成训练组和验证组,尽可能地保证了样本的随机性和代表性,减少了统计上的偏倚;再者从分割图中提取的特征数量大、类型多,很好地体现了影像组学高通量提取特征的这一特性。构成影像组学标签的5个有效特征代表着图像中不同的纹理和强度,反映了肿瘤组织内部的不均质性。“wavelet.HL_glszm_ZonePercentage”测量CT图像中感兴趣区域的数量与体素数量的比率,特征值越高,纹理越精细,在预后较差组的胃癌中,特征值较小。“wavelet.LH_glszm_GrayLevelNonUniformity”反映灰度强度值的变化,较低的值表示强度值更均匀。“wavelet.LH_glszm_ZoneVariance”是通过计算区域大小的方差来确定灰色区域的质量。“wavelet.HH_glrlm_LowGrayLevelRunEmphasis”表示低灰度值分布,特征值越高,说明图像中低灰度值的浓度越高。“wavelet.LL_firstorder_90Percentile”描述感兴趣区域中的体素分布强度。我们构建的三种预测模型建立在训练组上,并在验证组中检验,从而实现稳健的分类性能[21]。由结果数据不难看出,影像组学模型对胃癌不同预后组织学分型的预测性能在三者中表现最好。从预测模型中可以看出,年龄越小,组织学类型越倾向于预后较差的胃癌分型,肿瘤恶性程度越高。这与郭震等[22]报道一致,即年龄越小,肿瘤细胞代谢越活跃,进展越快,早期胃癌的恶性程度就越高。因此,对于中青年人的胃镜体检是有必要的。另外,由预测模型发现伴有转移的胃癌其组织学分型更倾向于预后较差,这与临床实际情况一致。但转移没有细分局部转移还是远处转移,还有待进一步研究。
本研究存在以下不足: ① 仅选取了CT门脉期图像进行特征提取,平扫及动脉期图像是否有更多有价值的特征; ② 仅选取了CT轴位上病灶最大层面,可能会导致部分采样误差; ③ 缺少外部验证;这些问题都有待进一步研究。
综上所述,相比传统的影像诊断方法,CT影像组学可以客观且无创地评估肿瘤异质性,发现肉眼主观评估以外的信息。利用CT影像组学模型可在术前无创预测胃癌不同预后的组织学分型,可以为临床医生制定完善的个体化治疗方案提供有价值的信息。

