清道夫B类Ⅰ型受体在胆固醇逆转运中作用及调节的研究进展
刘艾婷,吴 洁
冠心病是目前危害人类健康的主要原因之一,据《中国心血管病报告2017》概要指出,我国心血管病患病率及死亡率处于上升阶段,其死亡率居于首位,高于肿瘤及其他疾病。估算心血管疾病现患人数2.9亿人,其中冠心病1 100万人,且城市及农村冠心病死亡率逐年上升。冠心病发病基础是动脉粥样硬化,动脉粥样硬化指体内脂质代谢障碍,导致脂质在动脉内膜沉积,最终引起动脉管壁增厚变硬、管腔狭窄。如何调节体内脂质代谢是防治动脉粥样硬化的关键,清道夫B类Ⅰ型受体(scavengerreceptorBtypeⅠ,SR-BⅠ)及其介导的胆固醇逆转运(reverse cholesterol transport,RCT)可调节体内脂质代谢,发挥抗动脉粥样硬化作用。现综述SR-BⅠ在RCT过程中的作用、SR-BⅠ表达所受调节、SR-BⅠ胞外结构对RCT影响的研究进展。
1 RCT及其作用
RCT是由Glomset等[1]首先提出,指外周组织中多余的胆固醇经不同途径流出后,转运至肝脏,通过SR-BⅠ或低密度脂蛋白受体进入肝脏,经肝脏代谢后随胆汁排泄至粪便。RCT是调节体内脂质稳态的重要环节,具有抗动脉粥样硬化、保护心血管的作用。
2 SR-BⅠ在RCT中的作用
RCT包括3个步骤:胆固醇流出、胆固醇酯化及胆固醇酯的选择性摄取;而SR-BⅠ参与RCT的第一步及最后一步。
2.1 胆固醇流出 动脉粥样硬化的最初及关键步骤是泡沫细胞形成,而巨噬细胞是泡沫细胞的重要来源之一。进入动脉内膜的低密度脂蛋白经氧化、水解等过程形成氧化低密度脂蛋白,氧化低密度脂蛋白触发炎症信号激活单核细胞募集到内膜,并导致单核细胞分化为巨噬细胞。巨噬细胞通过其表面的清道夫A类受体、CD36等摄取氧化低密度脂蛋白,后经乙酰辅酶A乙酰转移酶转化为胆固醇酯,沉积在细胞内,其含量占总胆固醇的50%以上,则泡沫细胞形成[2-3]。
细胞内胆固醇流出主要有3条途径:水溶性扩散、三磷酸腺苷结合盒转运体(ATP-binding cassette transporter A1,ABCA1、ATP-binding cassette transporter G1,ABCG1)介导及SR-BⅠ介导的胆固醇流出[4]。其中ABCA1和ABCG1发挥主要作用,且ABCA1与ABCG1具有协同、互补效应[5],ABCA1将胆固醇转运至血清载脂蛋白A1形成的新生高密度脂蛋白,作为受体结合ABCG1介导流出的胆固醇。ABCG1可促进细胞内胆固醇向细胞表面转移,有利于ABCA1介导的胆固醇流出。ABCA1与SR-BⅠ存在竞争关系,过表达SR-BⅠ可竞争性抑制ABCA1介导的胆固醇流出[6]。而ABCG1和SR-BⅠ是将游离胆固醇转移至成熟高密度脂蛋白(high density lipoprotein,HDL),但两者之间是否存在竞争或协同作用,有待进一步研究。
SR-BⅠ是第一个在分子水平确定的HDL天然膜受体,也是HDL的生理相关性高亲和力受体[7]。SR-BⅠ主要在肝、肾上腺、卵巢和睾丸等组织中表达,特别是在肝脏高表达,且在血管内皮细胞、平滑肌细胞、巨噬细胞和肾上腺皮质细胞中有分布。泡沫细胞内胆固醇酯首先经中性胆固醇酯水解酶水解为游离胆固醇,游离胆固醇经巨噬细胞上表达的SR-B1介导,流出至成熟HDL,形成高密度脂蛋白胆固醇(HDL-C)[8]。
2.2 胆固醇酯的选择性摄取 SR-BⅠ在不同组织细胞中有不同的作用,既可在外周组织将细胞中游离胆固醇转运出来减少泡沫细胞形成,又通过选择性摄取将胆固醇酯摄入肝细胞促进胆固醇代谢。
HDL-C在外周经卵磷脂-胆固醇酰基转移酶酯化形成的高密度脂蛋白-胆固醇酯(high density lipoprotein-cholesterol ester,HDL-CE)运输至肝脏,与肝细胞表面的特异性受体SR-BⅠ结合,经疏水性通道选择性摄取胆固醇酯进入肝细胞,而不伴有整个HDL颗粒的摄取和降解。以上为SR-BⅠ参与介导的胆固醇逆转运经典途径,HDL-CE的选择性摄取主要通过肝细胞表面的SR-BⅠ。Ganesan等[9]研究表明,SR-BⅠ主要在肝窦内皮细胞大量表达,在肝细胞几乎不表达或仅少量表达。
若肝细胞不表达或仅表达少量SR-BⅠ,HDL-CE如何穿过肝血窦的内皮细胞进入肝细胞代谢并最终分泌到胆汁中?有学者猜测,一是肝细胞中存在少量不容易可见的SR-BⅠ,目前实验室技术暂无法检测。二是肝窦内皮细胞表面SR-BⅠ通过转胞吞作用,将HDL-CE传递到肝细胞进行代谢。转胞吞机制首先为胞吞作用,HDL-CE进入内皮细胞,之后内皮细胞通过胞吐作用将HDL-CE完整排出。已在淋巴管和主动脉的内皮细胞证实由SR-BⅠ介导的相似胞吞作用机制[10-11]。三是肝细胞表面存在其他HDL受体可能介导肝窦内皮细胞释放的HDL-CE摄取。
3 SR-BⅠ表达的调节
SR-BⅠ在RCT中的作用受其表达活性调节,SR-BⅠ表达受到核受体及细胞内信号传导途径调控。近年来研究发现以下物质或受体可促进或抑制SR-BⅠ表达。
3.1 促进SR-BⅠ表达
3.1.1 槲皮素 槲皮素是常见的黄酮类化合物之一,它广泛存在于人类饮食中,包括水果、蔬菜、茶叶、红酒和各种食物补充剂[12]。研究发现槲皮素可发挥抗动脉粥样硬化作用,但潜在机制尚未完全明确。Ren等[13]通过使用不同浓度槲皮素处理24 h或15 μmol/L槲皮素,处理不同时间后分别使用聚合酶链式反应和Western印迹分析测量SR-BⅠ mRNA和蛋白质水平,并检测肝细胞选择性胆固醇摄取量;结果显示槲皮素可有效促进肝细胞SR-BⅠmRNA和蛋白质表达,并促进肝细胞SR-BⅠ介导的胆固醇选择性摄取。
3.1.2 G蛋白偶联受体119(GPR119) GPR119属于G蛋白偶联受体A家族[14],有研究表明,GPR119可能参与调节体内脂质代谢[15]。通过构建过表达GPR119载体,转染单核巨噬细胞(THP-1),检测过表达GPR119转染THP-1巨噬细胞后脂质代谢相关基因表达,证实GPR119过表达后可上调THP-1中SR-BⅠ表达[16],促进巨噬细胞胆固醇流出。
3.1.3 13-羟基亚油酸(13-hydroxy linoleic acid,13-HODE) 过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor,PPARs)合成激活剂通过PPAR依赖性上调肝X受体α和胆固醇转运蛋白表达,促进胆固醇从巨噬细胞流出。13-HODE是亚油酸的代谢产物,是天然的PPAR激动剂。通过用或不用(对照)13-HODE处理存在和不存在PPARα或PPARγ拮抗剂的巨噬细胞,检测PPARs活性及肝X受体α、ABCA1、ABCG1和SR-BⅠ蛋白质含量,证明13-HODE通过过氧化物酶体增殖物激活受体-肝X受体α途径促进SR-BⅠ表达,促进巨噬细胞胆固醇流出[17]。
3.1.4 其他 曲古抑菌素D[18]和ω-3多不饱和脂肪酸[19]可促进肝细胞SR-BⅠ表达、曲古抑菌素A[20]可促进肝细胞和巨噬细胞SR-BⅠ表达,从而发挥抗动脉粥样化作用。
3.2 抑制SR-BⅠ表达
3.2.1 硫酸吲哚酚(indoxyl sulfate,IS) 核因子κB(NF-κB)信号是SR-BⅠ mRNA转录过程中重要的调节因子,抑制SR-BⅠ mRNA表达[21]。尿毒症病人体内积聚大量IS,为蛋白结合类毒素。有研究证实,IS与动脉粥样硬化的发生发展密切相关[22]。通过使用不同浓度IS干预巨噬泡沫细胞,检测SR-BⅠ mRNA和蛋白表达水平及NF-κB活化情况,发现IS可能通过活化NF-κB抑制SR-BⅠ mRNA和蛋白表达,促进动脉粥样硬化[23]。
3.2.2 Toll样受体2 Li等[24]研究发现Toll样受体2可下调巨噬细胞源性SR-BⅠ表达水平,并通过激活NF-κB信号促进动脉粥样硬化。
3.2.3 其他 近年来通过对SR-BⅠ的3′UTR序列分析发现,miR-185、miR-96和miR-223[25]能抑制肝脏和巨噬细胞SR-BⅠ表达。
4 SR-BⅠ结构对胆固醇逆转运的重要性
RCT不仅受到SR-BⅠ表达活性的调节,同时SR-BⅠ的胞外结构亦至关重要。SR-BⅠ位于细胞表面富含糖脂和胆固醇小窝中,呈马蹄形结构,是细胞膜上重要的高密度脂蛋白受体,其基因位于人类第12号染色体上,含有13个外显子,编码的蛋白含有509个氨基酸。SR-BⅠ包含两个短的胞内N-和C-末端的胞质结构域、两个跨膜结构域及一个大的、含有6个半胱氨酸残基和多个N-连接的糖基化位点的胞外结构域(见图1)[26-28]。SR-BⅠ上的配体结合位点具有多样性、重叠性,包括HDL、LDL、氧化性LDL、酰基化LDL、阴离子磷脂等,并高度依赖胞外域的403个氨基酸残基。除已知胞外结构域N-糖基化位点、N-甘氨酸二聚化基序、PDZ结构域、疏水通道等,近年来发现一些其他胞外结构域且与RCT相关。
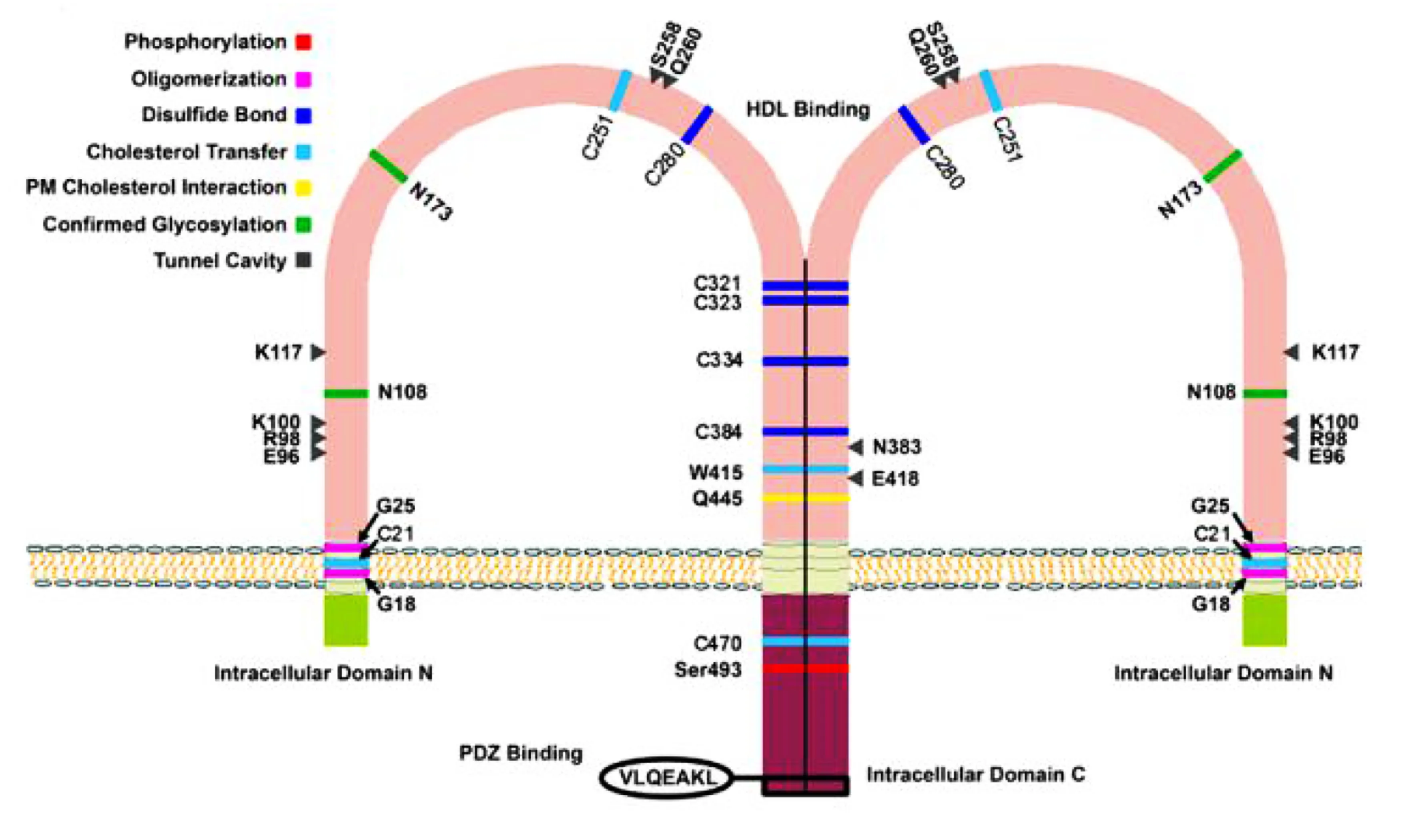
图1 SR-BⅠ结构特点
4.1 半胱氨酸残基 相关研究表明,SR-BⅠ胞外结构域中的半胱氨酸残基可独立地与SR-BⅠ二聚化的C端结构域结合[29]。SR-BⅠ共含有8个半胱氨酸残基(C21、C251、C280、C321、C323、C334、C384和C470),其中6个位于胞外结构域。诱导突变研究表明,胞外结构域中C280、C321、C323和C334残基在SR-BⅠ细胞表面表达,与HDL结合活性及胆固醇酯的选择性摄取是必需的,并发现若将这4个半胱氨酸残基中的任何一个突变为丝氨酸,可强烈诱导SR-BⅠ的二聚体形成,但与正常SR-BⅠ相反,这些SR-BⅠ突变体失去介导HDL-CE选择性摄取的能力。这些结果表明胞外结构域中半胱氨酸残基对SR-BⅠ的HDL结合和选择性胆固醇酯摄取至关重要。
4.2 丝氨酸残基 盐诱导激酶1是丝氨酸/苏氨酸蛋白激酶,属于压力和能量感应型一磷酸腺苷活化蛋白激酶家族。有研究发现,盐诱导激酶1过度表达在不影响SR-BⅠ蛋白表达情况下,上调SR-BⅠ介导的选择性胆固醇酯摄取[30]。通过诱导突变证明盐诱导激酶1和SR-BⅠ之间的相互作用,需在保持盐诱导激酶1完整催化活性和催化磷酸化基础上,与SR-BⅠ的C端结构域结合并使C-末端结构域的丝氨酸残基496磷酸化而发挥作用。
4.3 色氨酸残基 通过诱导突变的方法分析SR-BⅠ细胞外结构域中8个高度保守的色氨酸残基在胆固醇运输中作用,结果表明在SR-BⅠ中色氨酸残基突变体不能结合HDL、介导HDL-CE选择性摄取,并主要与色氨酸残基415相关[31]。
4.4 SR-BⅠ的二聚体和更高级寡聚体形式 SR-BⅠ形成二聚体和更高级寡聚体形式有利于胆固醇酯转移[8],且促肾上腺皮质激素可诱导SR-BⅠ寡聚状态从而促进胆固醇酯选择性摄取[29]。
5 小 结
综上所述,SR-BⅠ通过与成熟的HDL结合介导泡沫细胞内游离胆固醇流出,HDL-C酯化后转运至肝脏,经SR-BⅠ介导的选择性摄取进入肝脏进一步代谢,发挥调节体内脂质稳态、抗动脉粥样硬化作用,从而降低冠心病发生率及死亡率。
SR-BⅠ作为抗动脉粥样硬化的治疗靶点,促进巨噬细胞或肝细胞SR-BⅠ表达,增强SR-BⅠ的抗动脉粥样硬化作用。多补充含有槲皮素、13-HODE、ω-3多不饱和脂肪酸等,是否可预防动脉粥样硬化或抗动脉粥样硬化作用,或是否可促进GPR119表达、抑制Toll样受体2表达的新型药物,通过促进SR-BⅠ表达达到抗动脉粥样硬化目的,尿毒症病人体内IS降低可能减少动脉粥样硬化形成,这些有待进一步研究及探索。

