紫苏二酰基甘油酰基转移酶2基因克隆与功能研究
鲁 庚 唐 鑫 陆俊杏 李 丹 胡秋芸 胡 田 张 涛
研究简报
紫苏二酰基甘油酰基转移酶2基因克隆与功能研究
鲁 庚 唐 鑫 陆俊杏 李 丹 胡秋芸 胡 田 张 涛*
重庆师范大学生命科学学院, 重庆 401331
二酰基甘油酰基转移酶(diacylglycerol acyltransferase, DGAT)是植物合成三酰甘油(TAG)最后一步的关键酶, 其中DGAT2在某些植物的种子油中能选择性积累更多不饱和脂肪酸。本文成功克隆了紫苏二酰基甘油酰基转移酶2基因(), 并进行生物信息学分析。实时荧光定量结果表明, 不同器官中基因均有表达, 10 d种子的表达量最高, 在根中的表达量次之,在种子发育中后期,表达量逐渐降低。与野生型拟南芥相比, 过表达拟南芥种子含油率提高了21.68%~77.89%, 其中种子含油率增加最多的4个株系, 其亚麻酸(C18:3)增加4.57%, 花生一烯酸(C20:1)增加7.44%, 花生二烯酸(C20:2)增加5.4%, 二十二一烯酸(C22:1)增加10.37%, 而棕榈酸(C16:0)、硬脂酸(C18:0)和亚油酸(C18:2)含量分别降低了3.47%、6.64%和4.83%, 油酸(C18:1)和花生酸(C20:0)分别只降低了0.18%和1.91%。本研究结果表明, 紫苏基因不仅能提高种子含油率, 还能促进亚麻酸、花生一烯酸等不饱和脂肪酸的积累, 这为研究植物不饱和脂肪酸的合成积累提供了参考及理论依据。
二酰基甘油酰基转移酶(DGAT2); 种子含油率; 不饱和脂肪酸; 紫苏
三酰基甘油(TAG)是植物种子中的主要储存脂质, 是植物油的主要形式。植物油是重要的可再生能源, 可用于食品和饲料, 并且正日益成为生物柴油和工业化学品的原料[1-2]。植物油含较高的不饱和脂肪酸, 可以降低动脉硬化发生的概率。其中, 多不饱和脂肪酸α-亚麻酸是人体组织细胞的主要组成成分, 人体缺乏α-亚麻酸会引起健忘、疲劳、视力减退、动脉硬化等症状[3]。随着对多不饱和脂肪酸需求的增加, 需要开发具有高含油量和高不饱和脂肪酸的油料作物。唇形科一年生草本植物紫苏[(L.) Britt], 因其种子出油率达45%以及含大量多不饱和脂肪酸α-亚麻酸(60%以上)而成为人们重点关注的新型油料作物[4-5]。通过克隆紫苏基因, 研究其表达模式及功能, 对提高植物含油率、促进不饱和脂肪酸合成积累具有重要经济价值和理论意义。
TAG的生物合成涉及质体中脂肪酸的生物合成和内质网中TAG的组装2个主要阶段。脂肪酸的生物合成主要是乙酰辅酶A羧化酶(ACCase)将乙酰辅酶A活化为丙二酰辅酶A, 然后将丙二酰基从CoA转移到酰基载体蛋白(ACP)作为酰基链载体, 合成的脂肪酸则输出到内质网(ER)[6]。在肯尼迪途径中, 三磷酸甘油酰基转移酶(GPAT)、溶血磷脂酰基转移酶(LPAAT)和二酰基甘油酰基转移酶(DGAT)催化三磷酸甘油骨架链上酰化反应, 最后生成三酰甘油[7-8]。其中DGAT是用于TAG合成的最后一种酶, 它将第3个酰基链添加到DAG并产生TAG。目前, 在植物中鉴定出DGAT1、DGAT2、DGAT3[8-9]和WS/ DGAT[10]4种类型的DGAT。DGAT1和DGAT2在真核生物中普遍存在, 它们是2个结构不同的膜结合酰基转移酶, 没有序列同源性[12]。另外, DGAT1和DGAT2在底物特异性和表达模式等方面也不同[12-14]。Saha等[8]在花生子叶中克隆出了第3类可溶性DGAT酶, 命名为DGAT3, 定位于细胞质中。第4种类型的DGAT酶是从醋酸钙不动杆菌ADP1鉴定的双功能膜相关酶, 同时具有WS和DGAT活性[15-16]。在拟南芥和矮牵牛中的WS / DGAT同源物主要是催化蜡酯的合成[16-17]。有研究表明, 拟南芥的二酰基甘油酰基转移酶1 (DGAT1)是油脂中正常TAG积累所必需的[18-20]。但是, 拟南芥中的作用尚不清楚, 因为突变体与敲除突变体杂交后种子的含油量并没有明显降低[12]。与拟南芥相比, 蓖麻胚乳中的在种子中积累了大量的TAG (含90%以上蓖麻酸)[21]。此外, Shockey等[13]表明,可能参与异常脂肪酸、桐油酸和桐油的选择性积累。随后Oelkers[22]表明, 蓖麻能与蓖麻羟化酶共同表达, 在拟南芥种子中使羟基脂肪酸积累加倍(从~17%到~30%)。Li等[23]也证明了斑鸠菊、大戟和琉璃菊中的和积累了更高的环氧和羟基脂肪酸。Yuan等[24]通过在拟南芥中过表达油棕, 提高了拟南芥种子TAG中多不饱和脂肪酸亚油酸和亚麻酸的含量, 硬脂酸和花生酸的比例也相应降低。在最近的研究中, Zheng等[25]在拟南芥中过表达椰子, 导致拟南芥种子的亚油酸含量显著增加, 二十碳一烯酸和花生酸的比例降低。因此, DGAT2在某些植物种子油中选择性积累不饱和脂肪酸方面所起的作用比DGAT1更为显著[12]。
α-亚麻酸能预防心血管疾病, 也可增强智力、保护视力、抑制衰老和血小板聚集[26-27]。紫苏是目前发现含α-亚麻酸最高的植物, 但迄今为止, 对紫苏基因的研究非常少, 仅有梁倩等[28]克隆了该基因并进行了生物信息学及表达性分析, 而对的表达模式及生物学功能等迄今未见报道。本研究克隆了基因并利用生物信息学方法对其序列进行了分析, 在此基础上, 分析不同组织、种子不同发育时期的表达特性, 构建植物表达载体, 通过农杆菌介导法转化拟南芥, 研究过表达拟南芥种子的含油率及脂肪酸组分的变化, 可为植物高含量不饱和脂肪酸积累的分子机理提供参考及理论依据。
1 材料与方法
1.1 材料
1.1.1 植物材料 紫苏、拟南芥种子由重庆师范大学油用牡丹种质资源创新与利用重点实验室保存。于2018年4月将紫苏种植于重庆师范大学植物园, 9月采集花、叶、茎、根以及花后5、10、15、20、25、30 d不同发育阶段的种子, 液氮冷冻运输, 然后在-80℃冰箱保存待用。所有拟南芥种子均经2%次氯酸钠表面消毒, 播种在1/2 MS培养基上, 将22℃长日条件下的2周龄植物移栽到土壤(营养土∶细土∶珍珠岩 = 1.0∶3.0∶0.5)中。
1.1.2 菌株和试剂 大肠杆菌DH5α、Premix酶、DL2000 Marker、T/A克隆载体pMD19-T、逆转录试剂盒均购于TaKaRa公司, 植物RNA快速提取试剂盒购于天根生化有限公司, 荧光定量试剂盒购于成都百乐公司, 根瘤农杆菌GV3101、表达载体pCAMBIA1303由本实验室保存。
1.2 方法
1.2.1 紫苏总RNA提取及cDNA合成 利用植物RNA快速提取试剂盒提取紫苏根、茎、叶、花、不同时期种子(5、10、15、20、25、30 d)的总RNA, 保存于-80℃备用。采用RT Reagent Kit with gDNA Eraser (Perfect Real-Time)试剂盒方法, 以提取的RNA为模板, 反转录为cDNA。
1.2.2基因的克隆 从实验室前期紫苏转录组测序数据中挑选出功能注释为的基因[29], 以拟南芥为参照, 利用BioEdit软件比对分析, 获得紫苏全长。采用Primer Premier 5.0软件分别设计5'端及3'端全长特异性引物。反应引物为PfDGAT2 F和PfDGAT2 R (表1)。根据设计的引物以反转录的cDNA为模板进行PCR扩增, 将扩增产物纯化后与载体pMD-T 19连接, 转化大肠杆菌DH5α感受态, 筛选蓝白斑阳性克隆, PCR鉴定挑选单克隆送测序, 引物及测序均由英潍捷基有限公司完成。
1.2.3 生物信息学分析 将得到的用Vector NTI Advance 11进行序列比对和蛋白质翻译, 利用在线分析软件ProtParam (https://web.expasy.org/protparam/)预测PfDGAT2氨基酸序列的等电点、分子量以及氨基酸数目等基本理化参数; 利用SignalP 4.1 Server (http://www.cbs.dtu.dk/ services/SignalP/)、TMHMM Server v.2.0 (http://www.cbs. dtu.dk/services/TMHMM/)预测该蛋白的信号肽及分析该蛋白跨膜域, 使用CCD (http://www.ncbi.nlm.nih.gov/ Structure/cdd/wrpsb.cgi)进行蛋白序列保守结构域分析, 利用DNAMAN进行多序列比对分析, 采用MEGA 7.0软件构建同源蛋白进化树。
1.2.4基因组织特异性表达分析 根据已克隆的cDNA序列分析结果, 设计荧光定量PCR特异引物(表1), 以紫苏和作为内参基因, 参照试剂盒SYBR Premix ExII在CFX96 Real-Time PCR Detection System仪器(Bio-Rad公司)上进行荧光定量PCR检测, 反应体系为10 μL, 包含SYBR Green supermix 5.0 μL、上下游引物各0.5 μL、Template 4.0 μL; 反应条件为95℃预变性60 s; 95℃变性10 s, 60℃退火20 s, 40个循环; 反应结束后再升温至95℃, 最后进行溶解曲线分析。每组实验设置3次生物学重复和3次技术重复。
1.2.5 植物表达载体构建及转化 用限制性内切酶II酶切植物表达载体pCAMBIA1303, 设计带有II酶切位点的1对引物DGAT2-BglII F和DGAT2-BglII R (表1), 采用In-Fusion无缝克隆得到过表达重组质粒 WT: Pro35S, 将重组质粒转化到农杆菌中, 利用农杆菌介导的花序侵染法转化野生型拟南芥Col-0。农杆菌侵染的当代植株为T0代, 单株收的每代种子经1/2 MS培养基(含30 mg mL–1潮霉素)筛选后移栽至温室生长, 鉴定阳性苗使用分子鉴定, 分子鉴定引物为JD-F、JD-R (表1)。

表1 PCR引物
1.2.6 拟南芥种子含油率、脂肪酸组分的测定 使用Li等[30]的方法, 并做了部分改动, 提取拟南芥种子总油。分别采收PD2-1至PD2-9转基因拟南芥株系的T2代成熟种子, 干燥后使用1/1000天平称取每个株系的种子0.05 g, 重复5~10次。研钵研磨后加入氯仿∶甲醇(2∶1)混匀, 离心取下层氯仿相至玻璃管, 用氮吹仪浓缩干至恒重后称量, 计算含油率。利用GC-MS (岛津Trace1310-ISQ单四级杆气质联用仪)测定脂肪酸组分, 参照付松等[31]的脂肪酸甲酯化方法, 有所改动。取油脂于10 mL玻璃试管中, 加异辛烷(含0.001% BHT)溶解, 再加氢氧化钾-甲醇溶液, 旋涡震荡2 min后静置10 min, 最后加8% NaCl离心取上清液过油系滤膜待用。GC–MS进样体积1 μL; 程序升温: 起始温度180℃, 保持1 min, 以15℃ min-1升至230℃, 保持6 min; 高纯氮气载气, 流速1.0 mL min-1; 进样口温度250℃; 脉冲分流进样, 分流比35∶1, 脉冲压力120 kPa。传输线温度为230℃, 离子源温度230℃, 质量扫描范围(m/z) 40~400 amu。对每个株系总脂提取及脂肪酸甲酯化, 设置3次生物学重复和3次技术重复。
1.2.7 数据统计分析 采用Microsoft Excel统计分析基因表达量、拟南芥种子含油率及脂肪酸组分等数据并作图。使用2–ΔΔCt法计算基因相对表达量, 利用DPS 7.05软件进行基因表达差异显著性分析、种子含油率和脂肪酸组分的显著性分析。
2 结果与分析
2.1 PfDGAT2克隆及生物信息学分析
以紫苏不同时期种子混样的cDNA为模板,用特异性引物进行PCR扩增, 获得全长为1200 bp的(图1-A), 经1%琼脂糖凝胶电泳检测, 结果与预测大小一致。生物信息学分析表明,基因开放阅读框(open reading frame, ORF)长为990 bp, 编码329个氨基酸, 使用在线分析软件ProtParam分析表明,基因蛋白质分子量为37.01 kD, 等电点为9.55, 不稳定系数为43.06, 为不稳定蛋白。SignaIP server预测该蛋白无信号肽, TMHMM Server v.2.0分析该蛋白有2个跨膜域。蛋白序列保守结构域分析表明, PfDGAT2属于LPLAT蛋白超家族(图1-B)。
2.2 系统进化分析
为了研究紫苏与拟南芥、烟草、玉米等植物间的亲缘关系, 利用MEGA4.0软件对紫苏、芝麻(XP_011098009.1)、蓖麻(NP_001310616.1)、拟南芥(OAP06431.1)、大豆(NP_001299586.1)、蒺藜苜蓿(XP_003612436.1)、麻疯树(NP_001292973.1)、可可(EOX90582.1)、亚麻荠(XP_010426724)、烟草(AGL46984.1)、甘蓝型油菜(XP_013734399.2)、马铃薯(XP_006365015.1)和玉米(AQL03437.1)的DGAT2候选蛋白进行系统树分析表明(图2), 紫苏与油菜、蓖麻、可可等双子叶植物的DGAT2聚为一支, 与单子叶植物玉米亲缘关系最远, 其进化基本符合植物进化分类。其中, 紫苏与芝麻SiDGAT2亲缘关系最近, 其次与烟草、马铃薯蛋白亲缘关系较近; 与蓖麻、可可树等其他物种的DGAT2蛋白在进化上的亲缘关系较远, 推测紫苏基因的功能可能与芝麻基因相似。多序列比对分析(图3)发现,编码的蛋白与其他植物DGAT2蛋白相似, 具有YFP、EPHS、GGVQE、VPVFCFG和VVGRPI五个典型的植物DGAT2酶的保守结构域。
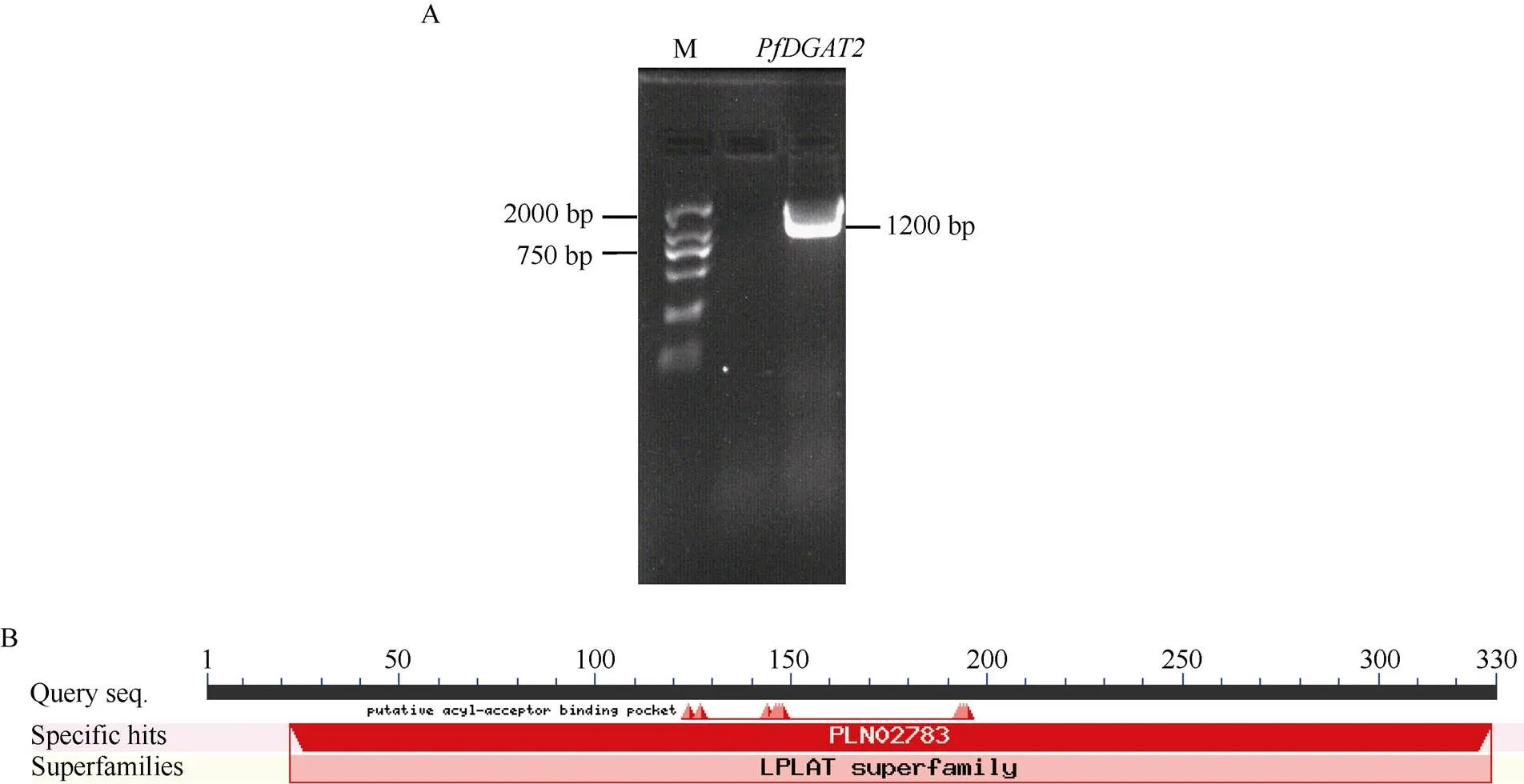
图1 PfDGAT2基因的克隆与分析
A:的PCR扩增产物, M: DL2000 DNA marker。B: PfDGAT2 保守结构域的预测结果。
A: PCR amplification product of, M: DL2000 DNA marker. B: conserved domains analysis of PfDGAT2 protein.
2.3 PfDGAT2基因组织特异性表达分析
实时荧光定量分析表明,在紫苏不同组织中均有表达, 在发育初期10 d种子中表达量最高, 根中表达量次之, 但与其他组织相比, 5 d种子表达量最低, 且在10 d种子后, 随着种子发育成熟,表达量呈降低趋势(图4)。
2.4 转基因拟南芥种子含油率、脂肪酸组分分析
经潮霉素筛选并分子鉴定后, 最终得到9个转基因株系, 命名为PD2-1至PD2-9。单株收取9个株系T2代种子测含油率, 选含油率最高的4个株系分析脂肪酸组分。由图5可知, 与野生型拟南芥相比, 转基因种子含油率提高了21.68%~77.89%, 其中PD2-1、PD2-3、PD2-5、PD2-8株系种子含油率增加最多, 分别增加了53.04%、62.10%、77.89%和47.01%。PD2-1、PD2-3、PD2-5、PD2-8四个株系的脂肪酸组分(图6), 与对照相比, 亚麻酸(C18:3)增加了4.57%, 花生一烯酸(C20:1)增加了7.44%, 花生二烯酸(C20:2)提高了5.4%, 而二十二一烯酸(C22:1)含量提高了10.37%。棕榈酸(C16:0)、硬脂酸(C18:0)和亚油酸(C18:2)显著降低, 分别降低了3.47%、6.64%和4.83%。油酸(C18:1)和花生酸(C20:0)呈降低趋势, 但变化不明显, 分别只降低了0.18%和1.91%。这说明,所编码的DGAT2酶不仅显著提高种子含油率, 还提高亚麻酸等不饱和脂肪酸的含量, 显然,在TAG组装过程中倾向于以不饱和脂肪酸亚麻酸、花生一烯酸、花生二烯酸和二十二一烯酸作为底物。
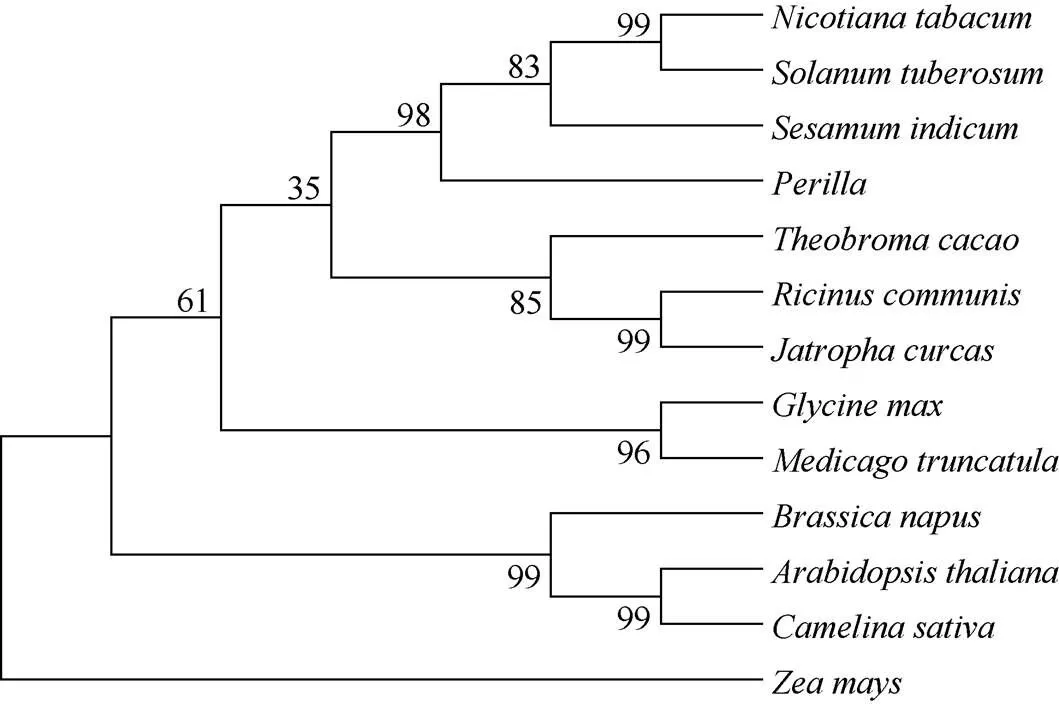
图2 不同植物DGAT2氨基酸序列的系统进化树
分支上的数字表示Bootstrap验证中基于1000次重复该节点的可信度。
The number on the branches represents the reliability percent of bootstraps values based on 1000 replications.

图3 不同植物DGAT2蛋白序列比对分析
PfDGAT2: 紫苏; SiDGAT2: 芝麻(XP_011098009.1); StDGAT2: 马铃薯(XP_006365015.1); AtDGAT2: 拟南芥(OAP06431.1); GmDGAT2: 大豆(NP_001299586.1); NtDGAT2: 烟草(AGL46984.1); CsDGAT2: 亚麻荠(XP_010426724)。黑色方框内依次为DGAT2蛋白的YFP、EPHS、GGVQE、RXGFX(K/R)XAXXXGXX(L/V)VPXXXFG(E/Q)和VVGRPI的保守结构域。
PfDGAT2:; SiDGAT2:(XP_011098009.1); StDGAT2:(XP_006365015.1); AtDGAT2:(OAP06431.1); GmDGAT2:(NP_001299586.1); NtDGAT2:(AGL46984.1); CsDGAT2:(XP_010426724). In the black box there are the YFP, EPHS, GGVQE, RXGFX(K/R)XAXXXGXX(L/V) VPXXXFG(E/Q), and VVGRPI conserved domains in turn.
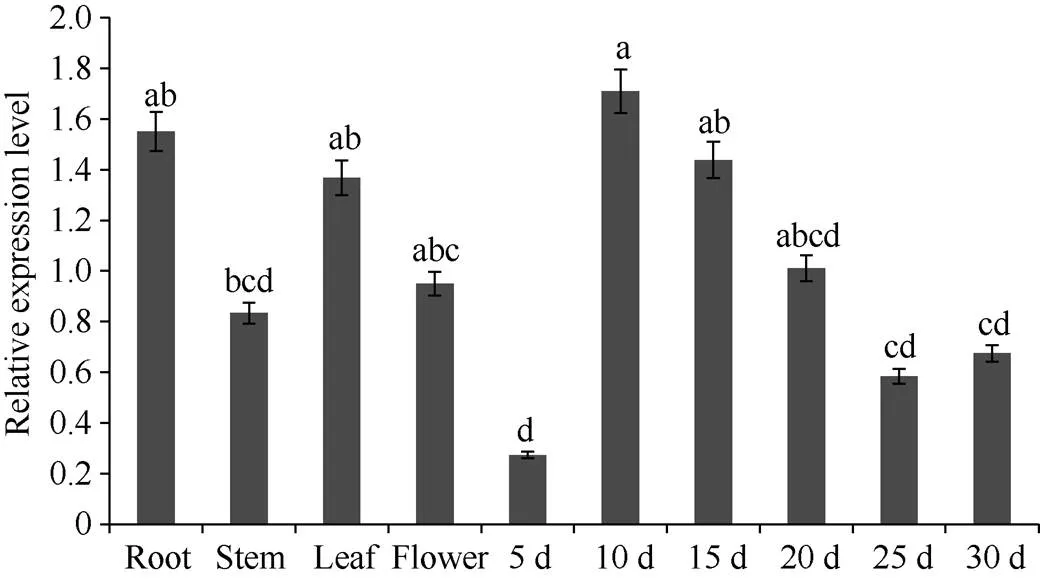
图4 PfDGAT2基因不同组织和种子不同时期的相对表达量
柱值标以不同字母表示在< 0.05水平差异显著性。数据点为平均值±标准误(= 3)。
Bars superscripted by different lowercase letters are significantly different at< 0.05. Data points are means±SE (= 3).
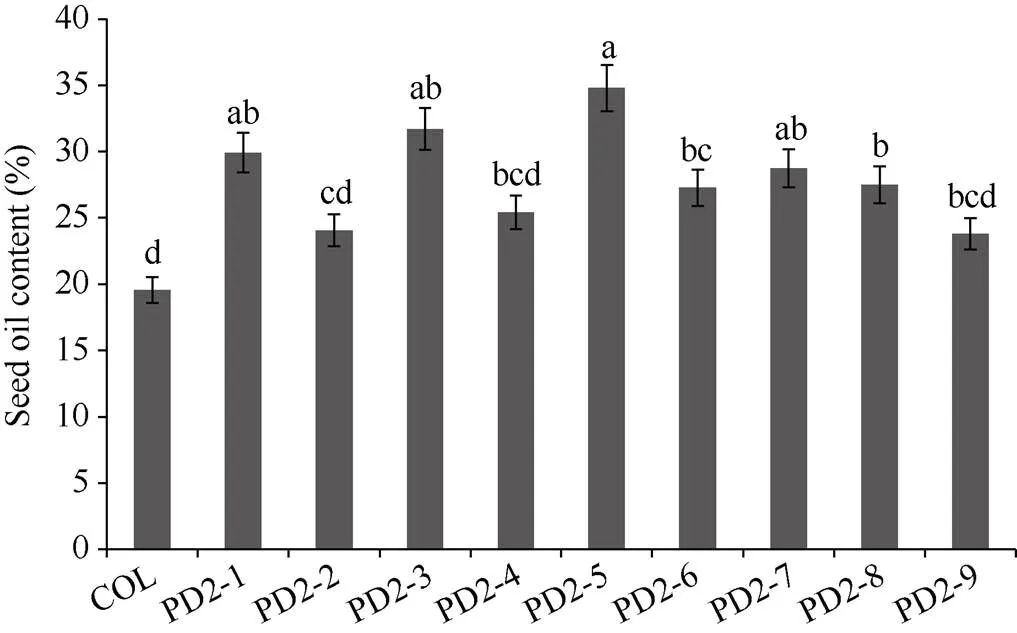
图5 转PfDGAT2拟南芥种子含油率
柱值标以不同字母表示在< 0.05水平差异显著性。数据点为平均值±标准误(= 3)。
Bars superscripted by different lowercase letters are significantly different at< 0.05. Data are means±SE (= 3).
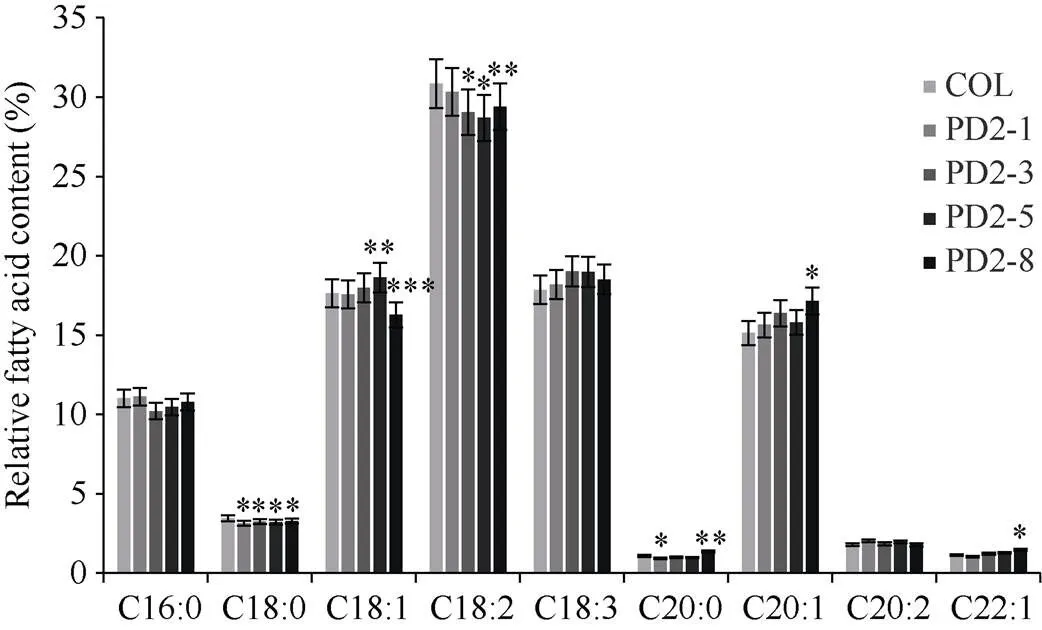
图6 转PfDGAT2拟南芥种子脂肪酸相对含量分析
图中*为PD2-1、PD2-3、PD2-5、PD2-5与野生型Col-0之间各组分显著性分析。*代表在< 0.05时显著性的差异, **代表在< 0.01时显著性的差异, ***代表在< 0.001时显著性的差异。数据点为平均值±标准误(= 3)。
In the figure, * shows significant difference of each component of PD2-1, PD2-3, PD2-5 with wild-type Col-0. * represents the significant difference at< 0.05, ** represents significant difference at< 0.01, *** represents significant difference at< 0.001. Data are means±SE (= 3).
3 讨论
TAG是植物油最重要的储存形式, 随着对TAG合成研究的不断深入, 作为催化TAG合成积累途径中的最后一步,的表达模式及功能受到了极大的关注。本研究在紫苏中克隆得到编码329个氨基酸的基因, PfDGAT2包含2个预测的跨膜结构域, 此外, 它还具有DGAT2的保守结构域(图3), 其中YFP和EPSH是DGAT2蛋白的关键酶活性位点。Stone等[32]在酿酒酵母中突变基因发现, YFP是的关键保守结构域, Liu等[33]发现, RXGFX(K/R)XAXXXGXX(L/V)VPXXXFG(E/ Q)是DGAT2同源蛋白中都保守的功能元件。与其他植物的DGAT2蛋白质序列比对表明, PfDGAT2蛋白属于DGAT2家族, 此外, 进化分析也支持这一假设, 因为PfDGAT2与其他植物物种的DGAT2蛋白聚在一起(图2)。PfDGAT2蛋白与芝麻SiDGAT2的亲缘关系最近, 其次与烟草、马铃薯DGAT2蛋白亲缘关系较近。前人研究中, 普遍认为在营养组织中的表达和活性高于种子, 郑玲等[34]发现, 烟草不同器官中都表达了花生基因, 但在柱头和花药中显示出较强表达。He等[35]对蓖麻基因表达分析表明,在种子中的表达量比在营养组织中的更高, 因此还需从不同植物中分离基因并研究其表达模式。前人对紫苏仅研究了不同品种的种子表达模式, 没有做深入的研究, 本试验从紫苏不同组织以及种子不同发育过程2个阶段做了的表达模式研究, 表明在10 d种子中表达量最高, 在15 d种子中表现出较高的表达水平(图4), 验证了紫苏中基因在种子的表达和活性高于其他组织。由于种子发育中早期是脂肪酸积累的关键时期, 中后期虽然的表达量逐渐下调, 但TAG已经储存到了油体蛋白中, 所以转基因拟南芥成熟种子含油率显著升高, 以上结果说明在种子脂肪酸积累中发挥主导作用。
有研究表明, 过表达基因可以增加油的积累和不饱和脂肪酸的合成。Bourgis等[36]和Tranbarger等[37]发现, 过表达油棕基因使大量的油沉积在中果皮中, 提高了油棕的含油量。本研究在拟南芥中过表达后发现, 拟南芥种子油增加了21.68%~77.89% (图5), 说明在种子油积累中起重要作用, 能提高种子含油量。TAG中不饱和脂肪酸的积累首先是将官能团插入酰基链中, 然后将不饱和的脂肪酸组装到TAG。在本实验中, 外源基因在拟南芥中的过表达导致多不饱和脂肪酸亚麻酸、花生一烯酸、花生二烯酸和二十二一烯酸的增加, 棕榈酸、硬脂酸、油酸、亚油酸和花生酸降低(图6), 显然对种子中亚麻酸等不饱和脂肪酸积累起着重要作用。Chen等[38]发现,表现出了对不饱和脂肪酸的底物偏好性, 其中亚油酸的含量增加, 而亚麻酸的含量减少。Zheng等[27]在拟南芥中过表达椰子, 导致拟南芥的种子亚油酸含量显著增加, 花生一烯酸和花生酸的比例降低, 表现出对亚油酸底物的偏爱。在这些研究中, 与本试验亚麻酸、二十二一烯酸等含量增加, 亚油酸等含量减少不同的是, 过表达大豆、椰子、油棕等植物的基因都表现出了亚油酸含量增加, 其他不饱和脂肪酸含量减少, 例如亚麻酸或花生一烯酸减少。这可能是因为这些植物的脂肪酸组分不同, 例如油棕榈中果皮只有10%亚油酸, 不含亚麻酸[39], 而酿酒酵母不含亚油酸或不含亚麻酸[25]。紫苏含丰富的α-亚麻酸, 因此其表现出对亚麻酸等组分的偏好性, 导致在TAG组装过程中, 有更多的亚麻酸、花生一烯酸、花生二烯酸和二十二一烯酸组装到TAG骨架上, 从而降低了棕榈酸、硬脂酸、油酸、亚油酸和花生酸含量。
[1] Dyer J M, Stymne S, Green A G, Carlsson A S. High-value oils from plants., 2008, 54: 640–655.
[2] Xu C, Shanklin J. Triacylglycerol metabolism, function, and accumulation in plant vegetative tissues., 2016, 67: 179–206.
[3] 陶国琴, 李晨. α-亚麻酸的保健功效及应用. 食品科学, 2004, 21(12): 140–143. Tao G Q, Li C. Health effects and application of α-linolenic acid., 2004, 21(12): 140–143 (in Chinese).
[4] 彭小平, 熊劲松. 我国紫苏产业化研究现状与展望.安徽农业科学, 2010, 38(16): 439–441. Peng X P, Xiong J S. Research present situation in industrialization and development prospect of(Linn.) Britt in China., 2010, 38(16): 439–441(in Chinese with English abstract).
[5] Yoon S H, Noh S. Positional distribution of fatty acids in Perilla (L.) oil., 2011, 88: 157–158.
[6] Liu Q, Guo Q G, Akbar S, Zhi Y, Anna E T, Madeline M, Li Z Y, Pushkar S, Thomas V, Jean P R, Liang G L, Wang M B, Rosemary W, Philip L, Surinder S, James P. Genetic enhancement of oil content in potato tuber (L.) through an integrated metabolic engineering strategy., 2017, 15: 56–67.
[7] Weselake R, Taylor D C, Rahman M H, Shah S, André L, Mcvetty P B E, Harwood J L. Increasing the flow of carbon into seed oil., 2009, 27: 866–878.
[8] Zou J, Wei Y, Jako C, Kumar A, Taylor D C. TheTAG1 mutant has a mutation in a diacylglycerol acyltransferase gene., 1999, 19: 645–653.
[9] Saha S, Enugutti B, Rajasekharan R R. Cytosolic triacylglycerol biosynthetic pathway in oil seeds. Molecular cloning and expression ofcytosolic diacylglycerol acyltransferase., 2006, 141: 1533–1543.
[10] Lehner R, Kuksis A. Biosynthesis of triacylglycerols., 1996, 35: 169–201.
[11] Cases S, Smith S J, Zheng Y W, Myers H M, Lear S R, Sande E, Novak S, Colins C, Welch C B, Lusis A J, Erickson S K, Farese R V. Identification of a gene encoding an acyl CoA:diacylglycerol acyltransferase, a key enzyme in triacylglycerol synthesis., 1998, 95: 13018–13023.
[12] Liu Q, Siloto R M P, Lehner R, Stone S J, Weselake R J. acyl-CoA:diacylglycerol acyltransferase: molecular biology, biochemistry and biotechnology., 2012, 51: 350–377.
[13] Shockey J M. Tung tree DGAT1 and DGAT2 have nonredundant functions in triacylglycerol biosynthesis and are localized to different subdomains of the endoplasmic reticulum., 2006, 18: 2294–2313.
[14] Li-Beisson Y, Shorrosh B, Beisson F, Andersson M X, Ohlrogge J. Acyl-lipid metabolism., 2013, 11: e0161.
[15] Kalscheuer R, Alexander S. A novel bifunctional wax ester synthase/acyl-CoA:diacylglycerol acyltransferase mediates wax ester and triacylglycerol biosynthesis in acinetobacter calcoaceticus, ADP1*., 2003, 278: 8075–8082.
[16] Li F, Wu X, Lam P, David B, Zheng H Q, Samuels L, Jetter R, Kunst L. Identification of the wax ester synthase/acyl-coenzyme A:aiacylglycerol acyltransferase WSD1 required for stem wax ester biosynthesis in., 2008, 148: 97–107.
[17] King A, Nam J W, Han J, Jaworski H J G. Cuticular wax biosynthesis inpetals: cloning and characterization of an alcohol-acyltransferase that synthesizes wax-esters., 2007, 226: 381–394.
[18] Katavic V, Reed D W, Taylor D C, Giblin E M, Barton D L, Zou J T, MacKenzie S L, Covello P S, Kunst L. Alteration of seed fatty acid composition by an ethyl methanesulfonate-induced mutation inaffecting diacylglycerol acyltransferase activity., 1995, 108: 399–409.
[19] Jako C, Kumar A, Wei Y, Zou J T, Barton D L, Giblin E M, Covello P S. Seed-specific over-expression of ancDNA encoding a diacylglycerol acyltransferase enhances seed oil content and seed weight., 2001, 126: 861–874.
[20] Chapman K D, Ohlrogge J B. Compartmentation of triacylglycerol accumulation in plants., 2012, 287: 2288–2294.
[21] Burgal J, Shockey J, Lu C, Dyer J, Larson T, Graham I, Browse J. Metabolic engineering of hydroxy fatty acid production in plants:drives dramatic increases in ricinoleate levels in seed oil., 2008, 6: 819–831.
[22] Oelkers P. Alecithin cholesterol acyltransferase-like gene mediates diacylglycerol esterification in yeast., 2000, 275: 15609–15612.
[23] Li R, Yu K, Hildebrand D F. DGAT1, DGAT2 and PDAT expression in seeds and other tissues of epoxy and hydroxy fatty acid accumulating plants., 2010, 45: 145–157.
[24] Jin Y H, Yuan Y J, Gao L C, Sun R H, Chen L Z , Li D D, Zheng Y S. Characterization and functional analysis of a type 2 diacylglycerol acyltransferase () gene from oil palm (Jacq.) mesocarp in saccharomyces cerevisiae and transgenic., 2017, 8: 1791.
[25] Zheng Y, Jin Y, Yuan Y, Feng D, Chen L, Li D, Zhou P. Identification and function analysis of a type 2 diacylglycerol acyltransferase (DGAT2) from the endosperm of coconut (L.)., 2019, 702: 75–82.
[26] Ezaki O, Takahashi M, Shigematsu T, Shimamura K, Kimura J, Ezaki H, Gotoh T. Long-term effects of dietary. ALPHA-linolenic acid fromoil on serum fatty acids composition and on the risk factors of coronary heart disease in Japanese elderly subjects., 1999, 45: 759–772.
[27] Renaud S, Lanzmann-Petithory D. Dietary fats and coronary heart disease pathogenesis., 2002, 4: 419–424.
[28] 梁倩, 李璐, 周雅莉, 安茜, 王计平.紫苏基因生物信息学及表达特性分析.华北农学报, 2017, 32(5): 90–94. Liang Q, Li L, Zhou Y L, An Q, Wang J P. Bioinformatics and expression analysis ofgene in., 2017, 32(5): 90–94 (in Chinese with English abstract).
[29] Liao B N, Hao Y J, Lu J X, Bai H Y, Guan L, Zhang T. Transcriptomic analysis ofseed to insight into the biosynthesis and metabolic of unsaturated fatty acids., 2018, 19: 213.
[30] Li S S, Yuan R Y, Chen L G, Wang L S, Hao X H, Wang L J, Zheng X C, Du H. Systematic qualitative and quantitative assessment of fatty acids in the seeds of 60 tree peony (sectionDC.) cultivars by GC–MS., 2015, 173: 133–140.
[31] 付松, 徐先顺, 向奋飞. 保健油脂中多不饱和脂肪酸的GC/MS分析.中国卫生检验杂志, 2005, 15: 1042–1044. Fu S, Xu X S, Xiang F F. Analysis of the multi-unsaturated fatty acids in healthy oils by GC/MS., 2005, 15: 1042–1044 (in Chinese with English abstract).
[32] Stone S J, Levin M C, Farese R V. Membrane topology and identification of key Functional amino acid residues of murine acyl-CoA:diacylglycerol acyltransferase-2., 2006, 281: 40273–40282.
[33] Liu Q, Siloto R M P, Snyder C L, Randall J. Weselake functional and topological analysis of yeast acyl-CoA:diacylglycerol acyltransferase 2, an endoplasmic reticulum enzyme essential for triacylglycerol biosynthesis., 2011, 286: 13115– 13126.
[34] 郑玲, 史灵敏, 田海莹, 单雷, 边斐, 郭峰, 宣宁, 万书波, 彭振英. 花生基因启动子的克隆和功能验证. 作物学报, 2016, 42: 1094–1099. Zheng L, Shi L M, Tian H Y, Shan L, Bian F, Guo F, Xuan N, Wan S B, Peng Z Y. Cloning and functional analysis of peanutpromoter., 2016, 42: 1094–1099 (in Chinese with English abstract).
[35] He X, Turner C, Chen G Q, Lin J T, McKeon T A. Cloning and characterization of a cDNA encoding diacylglycerol acyltransferase from castor bean., 2004, 39: 311–318.
[36] Bourgis F, Kilaru A, Cao X, Frank G, Ebongue N, Drira N, Ohlrogge J B, Arondel V. Comparative transcriptome and metabolite analysis of oil palm and date palm mesocarp that differ dramatically in carbon partitioning., 2011, 108: 12527–12532.
[37] Tranbarger T J, Dussert S, Joet T, Argout X, Summo M, Champion A, Cros D, Omore A, Nouy B, Morcillo F. Regulatory mechanisms underlyingfruit mesocarp maturation, ripening, and functional specialization in lipid and carotenoid metabolism., 2011, 156: 564–584.
[38] Chen B, Wang J, Zhang G, Liu J, Manan S, Hu H, Zhao J. Two types of soybean diacylglycerol acyltransferases are differentially involved in triacylglycerol biosynthesis and response to environmental stresses and hormones., 2016, 6: 28541.
[39] Sambanthamurthi R. Chemistry and biochemistry of palm oil., 2000, 39: 507–558.
Cloning and function analysis of a type 2 diacylglycerol acyltransferase (DGAT2) from
LU Geng, TANG Xin, LU Jun-Xing, LI Dan, HU Qiu-Yun, HU Tian, and ZHANG Tao*
College of Life Sciences, Chongqing Normal University, Chongqing 401331, China
Diacylglycerol acyltransferase (DGAT) is a key enzyme in the final step of triacylglycerol (TAG) synthesis in plant. In seed oil of certain plants, DGAT2 can selectively accumulate more unsaturated fatty acids. In this paper, we successful clonedfromand performed bioinformatics analysis. Real-time fluorescence quantitative analysis showed thatwas expressed in different organs, with the highest in seeds at 10 d after anthesis, the medium in roots, and gradual decrement in the middle and late stages of seed. Compared with the wild-type, the oil content of seeds intransgenicwasincreased by 21.68%–77.89%. The fatty acid components of the four strains with the largest increase in seed oil content were analyzed. Compared with the control, linolenic acid (C18:3), arachidonic acid (C20:1), arachidonic acid (C20:2), docosaenoic acid (C22:1) increased significantly by 4.57%, 7.44%, 5.40%, and 0.37%, respectively. Palmitic acid (C16:0), stearic acid (C18:0), and linoleic acid (C18:2) were obviously reduced by 3.47%, 6.64%, and 4.83%, respectively. Oleic acid (C18:1) only decreased by 0.18% and arachidic acid (C20:0) by 1.91%. In conclusion thatgene can not only increase the oil content, but promote the accumulation of unsaturated fatty acids such as linolenic acid and arachidonic acid, which provides a reference and theoretical basis for studying the synthesis and accumulation of unsaturated fatty acid in plants.
diacylglycerol acyltransferase; seed oil content; unsaturated fatty acid;
本研究由国家自然科学基金项目(31171588)和重庆市技术创新与应用发展项目(cstc2019jscx-msxm0612)资助。
This study was supported by the National Natural Science Foundation of China (31171588) and the Chongqing Technology Innovation and Application Development Project (cstc2019jscx-msxm0612).
10.3724/SP.J.1006.2020.94192
张涛, E-mail: zht2188@126.com, Tel: 023-65910119
E-mail: 778448973@qq.com
2019-12-11;
2020-03-24;
2020-04-26.
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20200426.1401.004.html

