玉米阳离子/质子逆向转运蛋白ZmNHX7的功能鉴定
张凌霄 焦珍珍 卜华虎 王逸茹 李 健, 3 郑 军,*
玉米阳离子/质子逆向转运蛋白ZmNHX7的功能鉴定
张凌霄1,2焦珍珍2卜华虎2王逸茹2李 健2, 3郑 军1,2,*
1北京农学院植物科学技术学院, 北京 102206;2中国农业科学院作物科学研究所, 北京 100081;3吉林农业大学农学院, 吉林长春 130118
植物阳离子/质子逆向转运蛋白可以维持细胞内的离子平衡, 在抵御离子毒害过程中发挥重要作用。本研究克隆了一个编码玉米阳离子/质子逆向转运蛋白的基因, 命名为。该基因编码序列(coding sequence, CDS)全长3411 bp, 编码一条含1136个氨基酸的多肽链。基因在玉米各组织部位均有表达, 在V7 (第7片叶完全展开)时期的根和茎中表达量较高。在NaCl与LiCl的胁迫条件下, 该基因表达量上调。系统进化树分析将ZmNHX7与拟南芥质膜阳离子/质子逆向转运蛋白AtNHX7和AtNHX8归为一类, 亚细胞定位结果表明该蛋白定位于细胞膜和核膜上。将基因转入拟南芥T-DNA插入突变体中, 转基因互补株系可以恢复该突变体对Li+的耐受性。这些结果表明,编码一个玉米质膜阳离子/质子逆向转运蛋白, 在缓解Li+对植物的毒害和维持细胞内的离子平衡等方面发挥重要作用。
玉米;; 逆向转运蛋白; 离子毒害
盐胁迫是造成农作物减产的主要非生物胁迫之一, 是一种多形态胁迫, 通过渗透胁迫、营养胁迫和离子毒害3种途径来降低作物产量甚至导致植物死亡[1]。在耐盐实验研究中, Li+常常被用作Na+的代替物, 因为Li+可能和Na+有相同的转运系统及毒性目标物, 且Li+的离子毒害性更强[2]。锂是自然界中最轻的碱金属元素, 主要以锂辉石等矿物质的形式存在于土壤中[3], 随着岩石、矿物的风化和水的下游流动, 锂在土壤中的浓度逐渐增加, 此外锂电池、陶瓷、玻璃等行业也使用了锂元素[4], Li2CO3常作为情绪稳定剂和治疗躁郁症的药物, 这些人为活动导致自然界中的Li+浓度升高[5], 许多作物正在遭受离子毒害。因此研究作物解毒和维持细胞内离子平衡的分子机理具有重要意义。
已有报道表明, 植物阳离子/质子逆向转运蛋白主要有两类。第一类是液泡膜型, 在液泡膜或者其他细胞器膜上表达, 当受到盐胁迫时该类蛋白可以将Na+局域化在液泡内从而维持细胞内的离子稳态[6]。AtNHX1就是典型的液泡膜型的Na+/H+逆向转运蛋白[7], 在其他物种中也克隆到了该基因的同源基因。玉米Na+/H+逆向转运蛋白ZmNHX1是液泡膜型的, 当玉米受到盐胁迫时, 根中的基因表达量上调, 提高玉米的耐盐性[8]。OsNHX1蛋白被定位在液泡膜上, 当水稻细胞质中Na+浓度过高时, 它可以将Na+区隔在液泡内; 将其在水稻中过表达, 水稻的耐盐性增强[9-10]。第二类是质膜型阳离子/质子逆向转运蛋白, 主要起到有害阳离子外排的作用, 该类蛋白通常需要借助质膜H+-ATPase水解ATP的能量将H+泵出细胞质, 产生跨膜的H+电化学势梯度, 驱动质膜上的Na+/H+逆向转运蛋白将细胞内的Na+排出细胞, 降低胞质内Na+浓度[11-12]。Shi等[13]克隆了一个拟南芥质膜Na+/H+逆向转运蛋白AtNHX7, 该基因在维持细胞内的钠钾平衡方面发挥了重要作用, 该基因突变后植物对高Na+和低K+环境的生长抑制表现得更加敏感。AtNHX8与AtNHX7的氨基酸序列相似性高达76%, 定位在细胞膜上的该基因被证明是一个质膜Li+/H+逆向转运蛋白, 它可特异地恢复酿酒酵母突变体的Li+敏感表型而不能互补Na+敏感表型,基因被证明与植物体解除Li+毒性紧密相关[2,14]。
玉米是我国重要的粮饲兼用型作物, 研究表明离子毒害对玉米的生长发育具有不利影响[15]。因此了解玉米对离子胁迫的解毒机理, 深入研究玉米解除离子毒害相关基因的功能对玉米的正常生长发育具有重要意义。本研究利用组织特异性表达、胁迫诱导表达、转基因互补和亚细胞定位等方法, 对玉米7基因的功能进行了研究, 实验证明其可以缓解Li+对植物的毒害作用, 维持细胞内的离子平衡。
1 材料与方法
1.1 试验材料
所用玉米材料为自交系B73, 拟南芥材料为野生型(wild type, WT) Columbia-0和由SALK突变体库提供的拟南芥T-DNA插入突变体, 其编号为Salk_070497。所用菌株包括大肠杆菌DH5α和农杆菌GV3101, 载体包括表达载体pEarleyGate 104[16]与入门载体pGWC[17]。
1.2 基因序列获取与分析
在拟南芥TAIR (http://www.arabidopsis.org/)数据库获取拟南芥基因家族成员序列, 根据拟南芥基因家族成员序列在maize GDB (https:// www.maizegdb.org/)和NCBI (https://blast.ncbi.nlm. nih.gov/Blast.cgi)中进行BLASTP分析, 获得了7个玉米基因家族成员的基因序列与编码氨基酸序列[8]。利用MEGA 6 (Molecular Evolutionary Genetics Analysis version 6)软件对拟南芥和玉米NHX家族成员进行系统进化树分析, 使用邻近法(neighbour- joining, NJ)构建进化树, 设Bootstrap值为1000[18]。使用CLUSTALW程序比对蛋白序列[19], 默认参数设置, 用GeneDoc编辑比对后的序列。
1.3 DNA提取与ZmNHX7基因克隆
采用CTAB法提取玉米基因组DNA[20]。根据CDS序列, 利用Primer 5软件设计全长引物(ZmNHX7-G-F1/R1)(表1), 通过聚合酶链式反应(polymerase chain reaction, PCR)扩增获取基因全长。PCR扩增体系(50 μL)含有2×Phanta Max buffer 25 μL, dNTP (2.5 μmol L–1) 1 μL, 上下游引物(10 μmol L–1)各1 μL, DNA聚合酶(1.0 U L–1) 1 μL, 模板DNA 1 μL, 用ddH2O配平至50 μL。扩增程序为95℃预变性3 min, 95℃变性15 s, 60℃退火15 s, 72℃延伸1 min, 35个循环; 72℃彻底延伸5 min。扩增产物与Loading buffer混合, 经1%琼脂糖凝胶电泳15 min后, 在凝胶成像分析仪中观察目的条带。
1.4 ZmNHX7基因表达分析
1.4.1组织特异性分析 取玉米B73材料V1 (第1片叶完全展开)时期的根和叶, V7 (第7片叶完全展开)和R2 (籽粒建成)时期根、茎、叶, 以及苞叶、穗轴、雄穗、花丝、籽粒等部位样品, 置液氮中速冻, 使用植物总RNA提取试剂盒(北京天根生化科技公司, Cat#DP432)提取上述样品总RNA, 利用反转录试剂盒(北京全式金生物科技有限公司, Cat#AU311-03)反转录为cDNA, 以cDNA为模板进行实时荧光定量PCR[21]。实时荧光定量PCR以玉米组成型基因为内参(表1), 设计基因的特异性引物(ZmNHX7-Q-F/R)(表1), 每个样品设计3个生物学重复, 在Applied Biosystems 7300实时荧光定量PCR仪上分析, 导出CT值, 用2–ΔΔCT公式计算获取定量结果。

表1 引物序列
1.4.2 Li+和Na+胁迫下基因的表达模式
为了研究基因在外源Li+和Na+胁迫下的表达模式, 将B73种子置湿润的发芽纸上卷起来, 放入28℃培养箱培养2~3 d, 待种子生根后水培。令营养液没过种子根部, 2 d换一次营养液。培养7 d后用不同浓度的LiCl和NaCl处理5 h[22], 用植物总RNA提取试剂盒提取玉米幼苗总RNA, 用反转录试剂盒将RNA反转录为cDNA, 以cDNA为模板, 以ZmNHX7-Q-F/R与为引物(表1)进行实时荧光定量PCR分析。用2–ΔΔCT公式计算目标基因的相对表达量, 设LiCl和NaCl的浓度为0时,表达量为1, 计算出不同浓度LiCl和NaCl处理后玉米幼苗的表达量。
1.5 亚细胞定位
根据基因CDS序列设计引物(ZmN HX7-L-F/R)(表1), PCR扩增获得基因全长, 将目的片段与入门载体pGWC连接后转化大肠杆菌感受态细胞DH5α, 测序正确的阳性克隆与表达载体pEarleyGate 104[23]进行LR反应, 筛选阳性克隆, 采用电转法转化农杆菌GV3101感受态细胞, 将空载体pEarleyGate 104转化农杆菌GV3101感受态细胞作为阴性对照。将亚细胞定位表达载体与膜和核膜marker PM-2K同时扩繁, 用缓冲液将二者OD600值调成一致后, 按1∶1混合, 注射至烟草, 避光处理2~3 d后, 用Zeiss LSM700激光共聚焦显微镜观察该基因编码蛋白的亚细胞定位[24-25]。
1.6 ZmNHX7的转基因互补实验
应用农杆菌蘸花法侵染拟南芥获取转基因互补纯合株系。将拟南芥突变体置于MS培养基上, 4℃春化3 d后转入培养室中培养, 培养条件是光照16 h/黑暗8 h, 温度22℃, 相对湿度(relative humidity, RH)为50%。7 d后将拟南芥移至培养土(蛭石∶营养土=1∶1)中培养约20 d, 待拟南芥初生花序生长至5~15 cm进行侵染。将pEarleyGate 100- ZmNHX7转化农杆菌GV3101, 扩繁后侵染拟南芥进行转化, 拟南芥培养至成熟后单株收获种子, 即为T1代种子。pEarleyGate 100上含有草铵膦(phosphinothricin, ppt)筛选标记, 因此将T1代种子种在含有ppt的MS培养基上培养1周, 存活的幼苗移苗培养至成熟即获得T2代种子, 直至收获的种子在含有ppt的培养基上完全存活, 证明已获得转基因互补纯合株系。经过逐代筛选的方法共得到4个转基因互补纯合株系, 命名为COM1、COM2、COM3、COM4 (简称COM1~COM4)。提取4周龄的WT、、COM1~COM4的DNA, 设计基因的特异性引物(ZmNHX7-G-F2/R2)(表1)进行PCR扩增, 提取上述材料的总RNA, 设计和基因的特异性引物(AtNHX8-G-F/R, ZmNHX7-G-F2/ R2)(表1)进行分子验证。
1.7 拟南芥表型数据调查
1.7.1 拟南芥表型及鲜重数据分析 将拟南芥野生型(WT)、突变体材料和4个转基因互补材料(COM1~COM4)同期分别种在含有0 mmol L–1、5 mmol L–1、10 mmol L–1和15 mmol L–1的Li+以及50 mmol L–1、75 mmol L–1和100 mmol L–1的Na+的MS培养基上, 4℃春化3 d后转入培养室, 培养条件是16 h光照/8 h黑暗, 温度22℃, 湿度50% RH, 将培养皿水平放置, 使其垂直接受光照。于第7天拍照记录各个株系的生长状况, 同时选取每个处理条件下的每个株系各20株称重, 统计植株鲜重[26]。
1.7.2 拟南芥根长情况及数据分析 将拟南芥野生型(WT)、突变体材料和2个转基因互补材料(COM1, COM4)同期分别种在含有0 mmol L–1、5 mmol L–1、10 mmol L–1和15 mmol L–1的Li+以及50 mmol L–1、75 mmol L–1和100 mmol L–1的Na+的MS培养基上, 4℃春化3 d后转入培养室, 培养条件同上。将培养皿竖直放置, 使根系竖直生长。于第7天照相记录各个株系的根长, 同时选取每个处理条件下的每个株系各10株统计根长。
2 结果与分析
2.1 玉米ZmNHX基因鉴定和系统发育分析
通过对拟南芥家族成员基因BLASTP分析,获得7个玉米相关基因, 分别命名为(表2)[8], 其中位于玉米1号染色体上, 基因序列号为(GRMZM2G098494), 该基因全基因组序列长度为17,992 bp, CDS序列长度3411 bp, 编码1136个氨基酸, 有22个外显子和21个内含子。
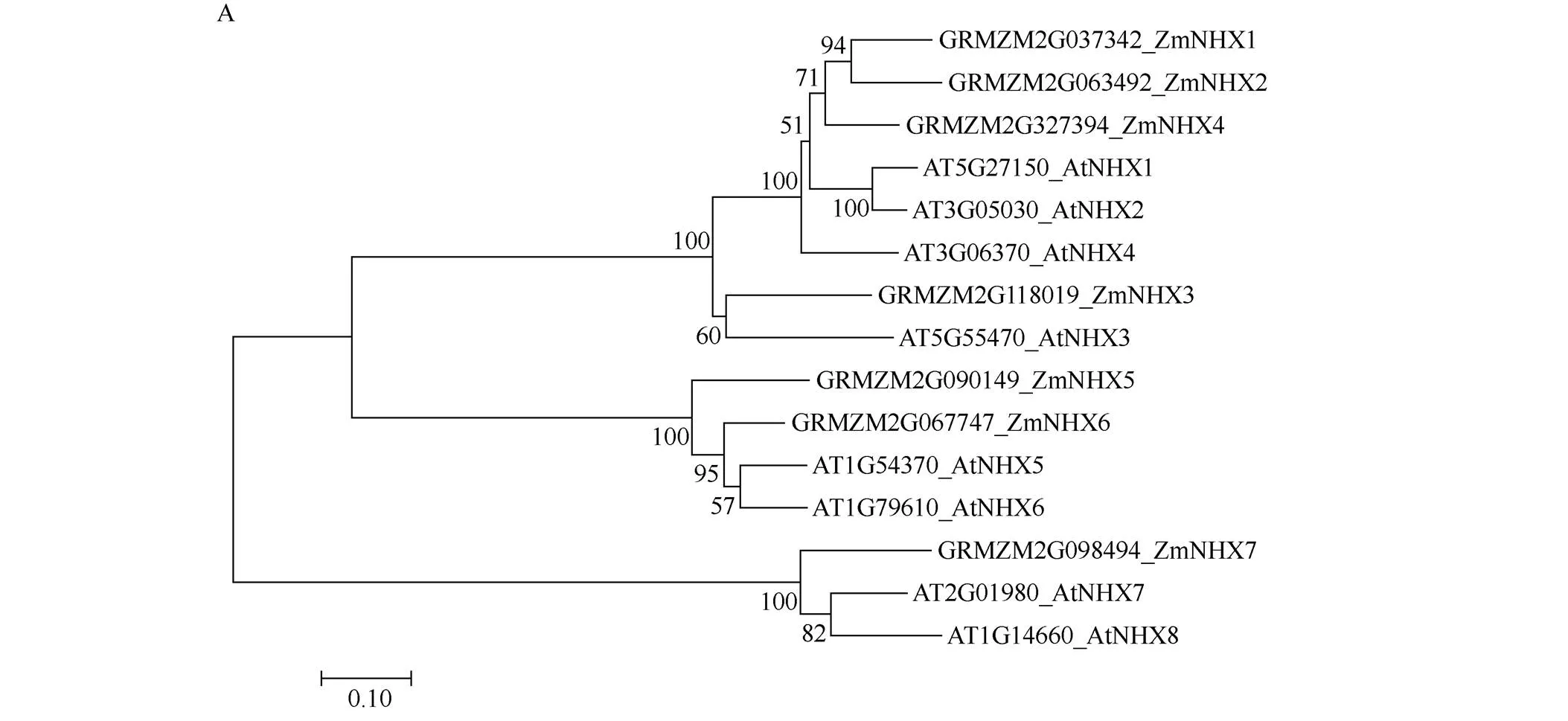
7个玉米和8个拟南芥NHX逆向转运蛋白进化树表明, ZmNHX7氨基酸序列与AtNHX7和AtNHX8同源性较高, 属于同一个分支(图1-A)。有研究表明AtNHX7与AtNHX8都是定位在质膜上的阳离子/质子逆向转运蛋白[2,11-14], 由此推测基因也与质膜上阳离子的逆向运输有关。将ZmNHX7和拟南芥阳离子/质子逆向转运蛋白AtNHX7和AtNHX8进行蛋白序列比对, 结果表明ZmNHX7与AtNHX7和AtNHX8的N端高度保守, 且有3个保守结构域[8](图1-B)。
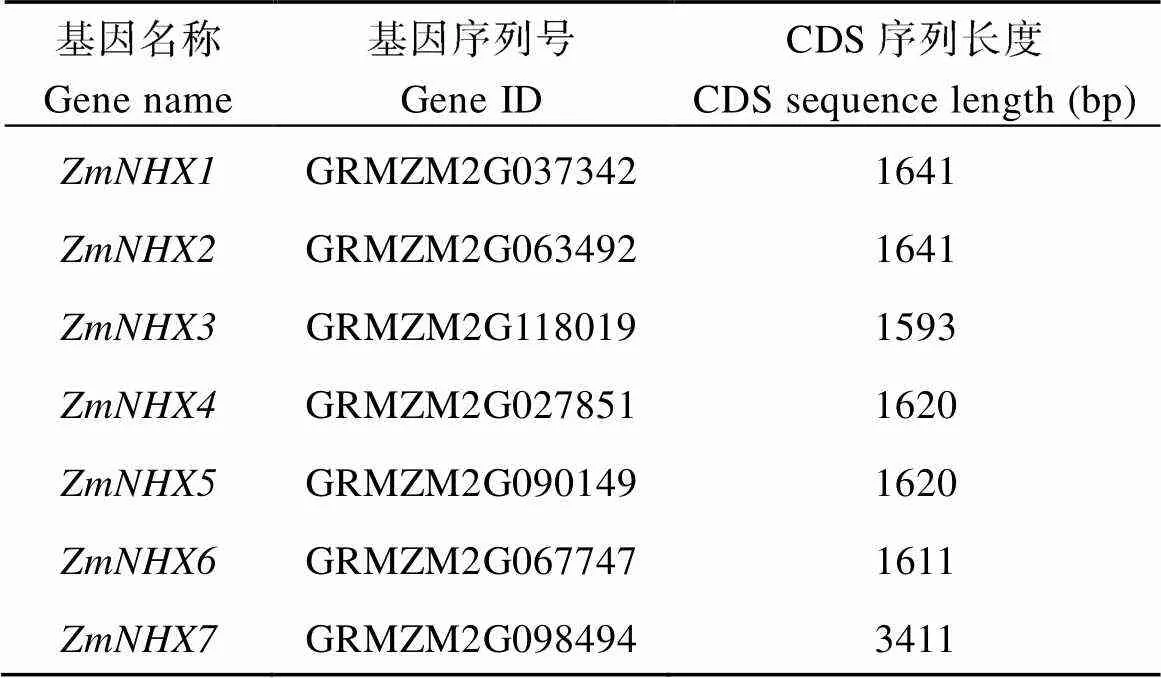
表2 玉米NHX基因信息
2.2 玉米ZmNHX7基因的组织表达分析
实时荧光定量PCR结果表明在玉米V1时期的根和叶, V7和R2时期根、茎、叶, 以及苞叶、花丝、穗轴、雄穗、籽粒等部位均有表达, 但在花丝中表达量最低, V7时期茎的表达量最高, 约是花丝中表达量的3倍, 其次是在V7时期的根中表达量较高, 约是花丝表达量的2.2倍(图2)。
2.3 ZmNHX7基因的诱导表达情况
实时荧光定量PCR结果显示, 在不同浓度的LiCl与NaCl处理5 h后,基因的表达量显著上升(图3)。用10 mmol L–1LiCl处理5 h后,基因表达量上升为对照的3.24倍, 当用30 mmol L–1LiCl处理5 h后, 表达量上升为对照的3.54倍(图3-A)。用100 mmol L–1和400 mmol L–1的NaCl处理玉米幼苗5 h后,基因的表达量分别上升为对照条件的1.76倍和3.36倍(图3- B)。说明基因受到外源Li+和Na+的诱导表达。
(图1)
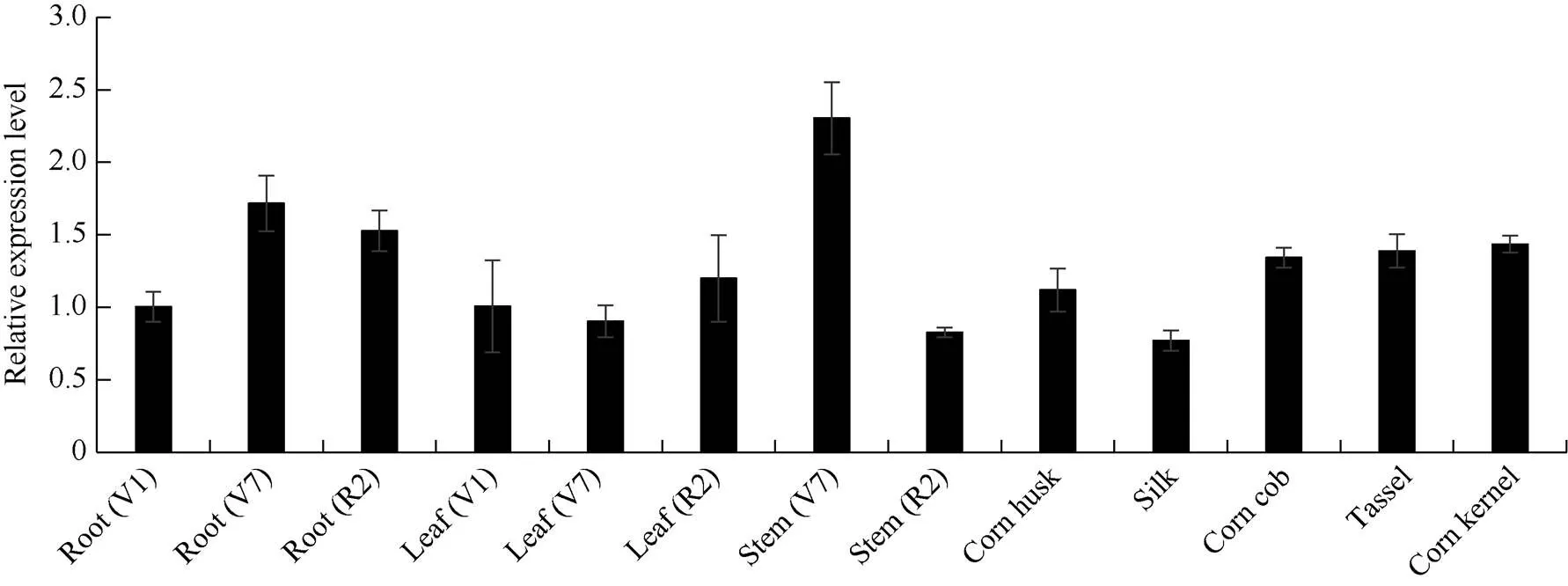
图2 荧光定量PCR分析ZmNHX7基因在玉米不同组织中的表达
V1: 玉米第1片叶完全展开; V7: 玉米第7片叶完全展开; R2: 籽粒建成。误差线表示3次生物学重复的标准差, 以基因V1时期根的相对表达水平为对照。
V1: the first leaf of maize was fully expanded; V7: the seventh leaf of maize was fully expanded; R2: grain formation period. The error bar shows the standard deviation of three biological replicates, the relative expression level in root (V1) was used as the control.
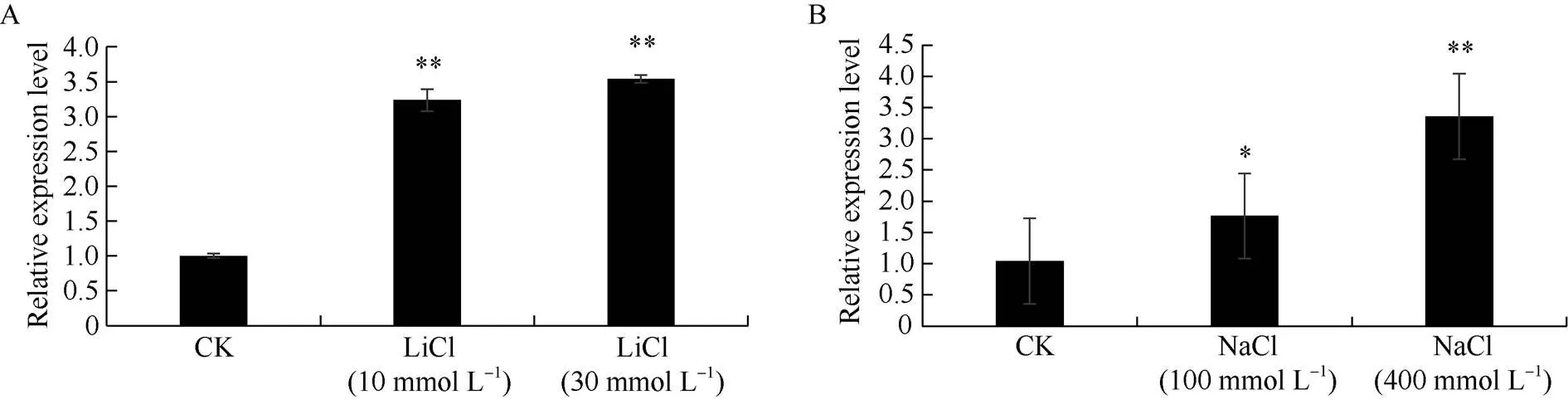
图3 ZmNHX7基因的诱导表达情况
A:基因在不同浓度LiCl处理5 h后的表达量分析; B:基因在不同浓度NaCl处理5 h后的表达量分析。误差线代表3个独立重复的标准差, *和**分别表示不同浓度离子胁迫条件下基因相对表达量与对照在< 0.05和< 0.01水平差异显著。
A: analysis of the expression level ofafter treatment with different concentrations of LiCl for 5 hours; B: analysis of the expression level ofafter treatment with different concentrations of NaCl for 5 hours. error bars represent standard errors of three independent repetitions; * and **: the relative expression ofunder different concentrations of ion stress is significantly different from the content at the 0.05 and 0.01 probability levels, respectively.
2.4 ZmNHX7的亚细胞定位
构建ZmNHX7的亚细胞定位载体, 通过农杆菌侵染使ZmNHX7在烟草中瞬时表达, 以确定其亚细胞定位。空载体在烟草叶片细胞的细胞核、细胞膜和细胞质中均可以检测到黄色荧光(图4-A), 而含有目的基因的表达载体只在细胞膜和核膜上检测到了荧光信号(图4-B), 将发红色荧光的质膜与核膜marker PM-2K与ZmNHX7表达载体共同转化烟草, 共定位结果显示目的基因发出的黄色荧光与定位在质膜与核膜上的PM-2K所发的红色荧光完全重合(图4-C)。说明ZmNHX7定位于细胞质膜和核膜。
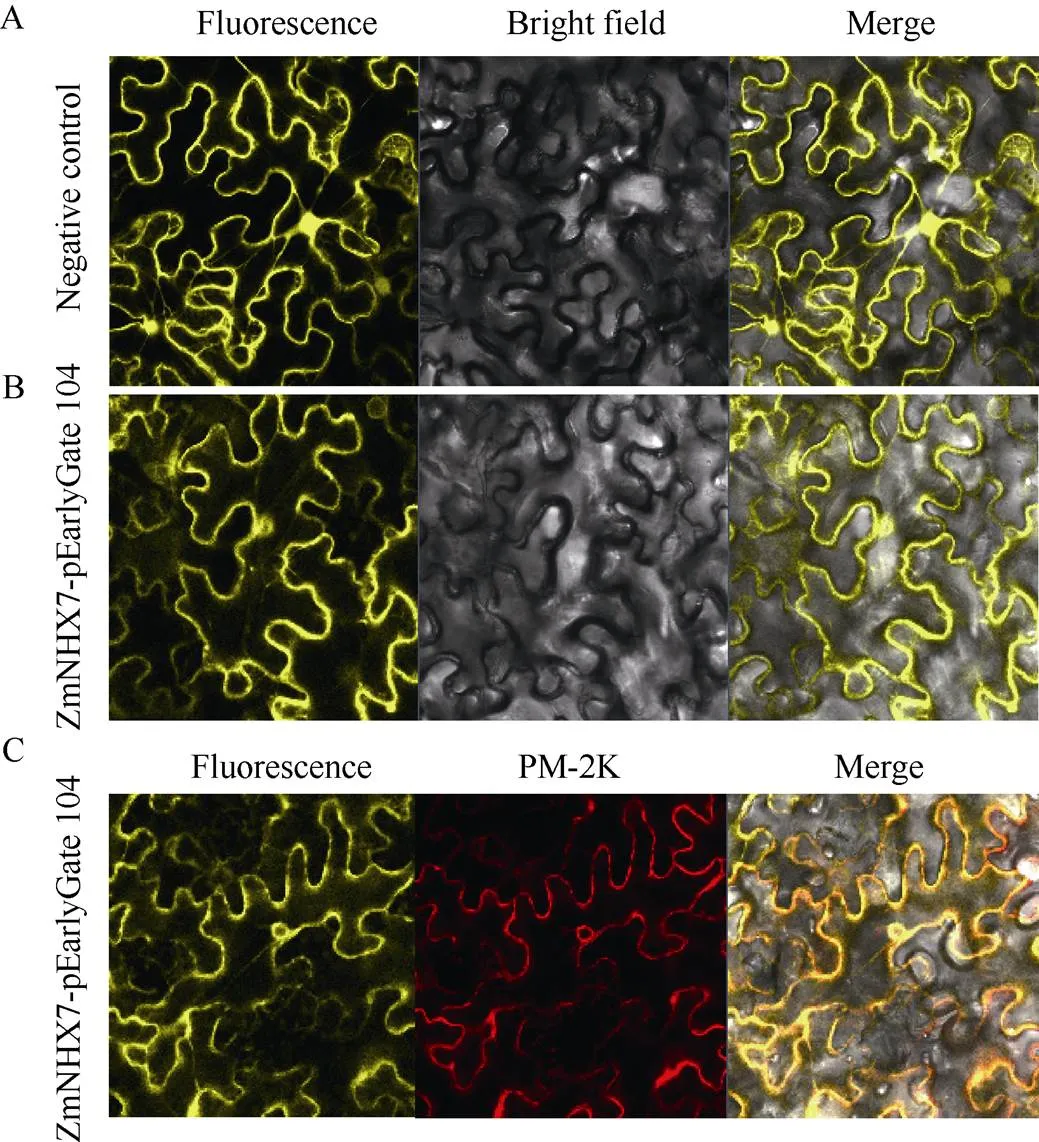
图4 ZmNHX7的亚细胞定位
A: YFP空载在烟草叶片中的表达; B: ZmNHX7-YFP在烟草叶片中的表达; C: 加上marker的ZmNHX7-YFP在烟草叶片中的表达。
A: localization of YFP fluorescence in tobacco leaves; B: localization of ZmNHX7-YFP fluorescence in tobacco leaves; C: localization of ZmNHX7-YFP and marker fluorescence in tobacco leaves.
2.5 ZmNHX7的转基因互补实验
2.5.1转基因互补实验分子验证 提取拟南芥WT、、COM1~COM4的DNA和RNA进行分子验证。用的特异性引物在WT和的cDNA中进行扩增, 其中WT可以扩增出条带,中未扩增出条带, 证明在突变体中已经不能正常转录(图5-A)。在WT、和COM1~ COM4的DNA中扩增基因, COM1~COM4可以扩增出条带, 而WT和中没有条带, 证明基因已经成功转入4个转基因互补株系4 (图5-B)。在WT、和COM1~COM4的cDNA中扩增基因, COM1~COM4可以扩增出条带证明基因在转基因互补株系中正常转录(图5-C)。
2.5.2转基因互补植株表型及鲜重统计分析 根据对拟南芥不同株系(WT、COM1~ COM4)表型观察(图6-A)和鲜重统计发现(图6-B),基因只对Li+敏感, 该基因突变后, 拟南芥在含有Li+的培养基上生长受限, 当Li+浓度达到10 mmol L–1时, 拟南芥的存活率显著降低, 但转基因互补材料COM1~COM4与WT相比在表型与鲜重方面均无显著差异, 说明的转入可以缓解突变体对Li+的敏感性。另一方面基因对Na+不敏感, WT、和COM1~COM4在含有不同浓度Na+的培养基上表型和鲜重均无显著差异, 这与之前的研究编码一个专性的Li+/H+逆向转运蛋白相一致, 缺失该基因拟南芥易受到Li+毒害, 但Na+对该缺陷型的影响不显著[2,14]。在中转入基因后可以明显缓解Li+对拟南芥的毒害作用。
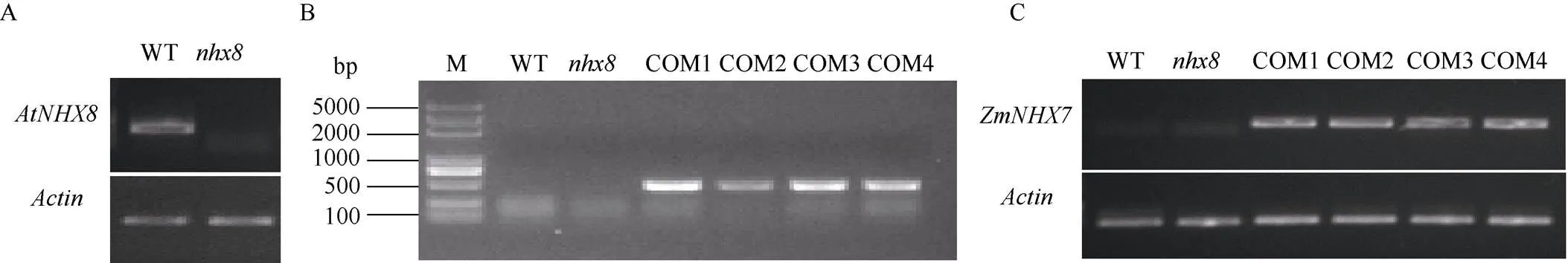
图5 通过PCR鉴定ZmNHX7基因在拟南芥中的转入与表达
A: RT-PCR检测基因在WT和中的转录表达; B:基因在不同拟南芥株系中的表达; C:基因在不同拟南芥株系中的转录表达。M: D2000 plus DNA marker。
A: RT-PCR was used to verify the transcription ofgene in WT and; B: expression ofgene in differentlines; C: transcriptional expression ofgene in differentlines. M: D2000 plus DNA marker.
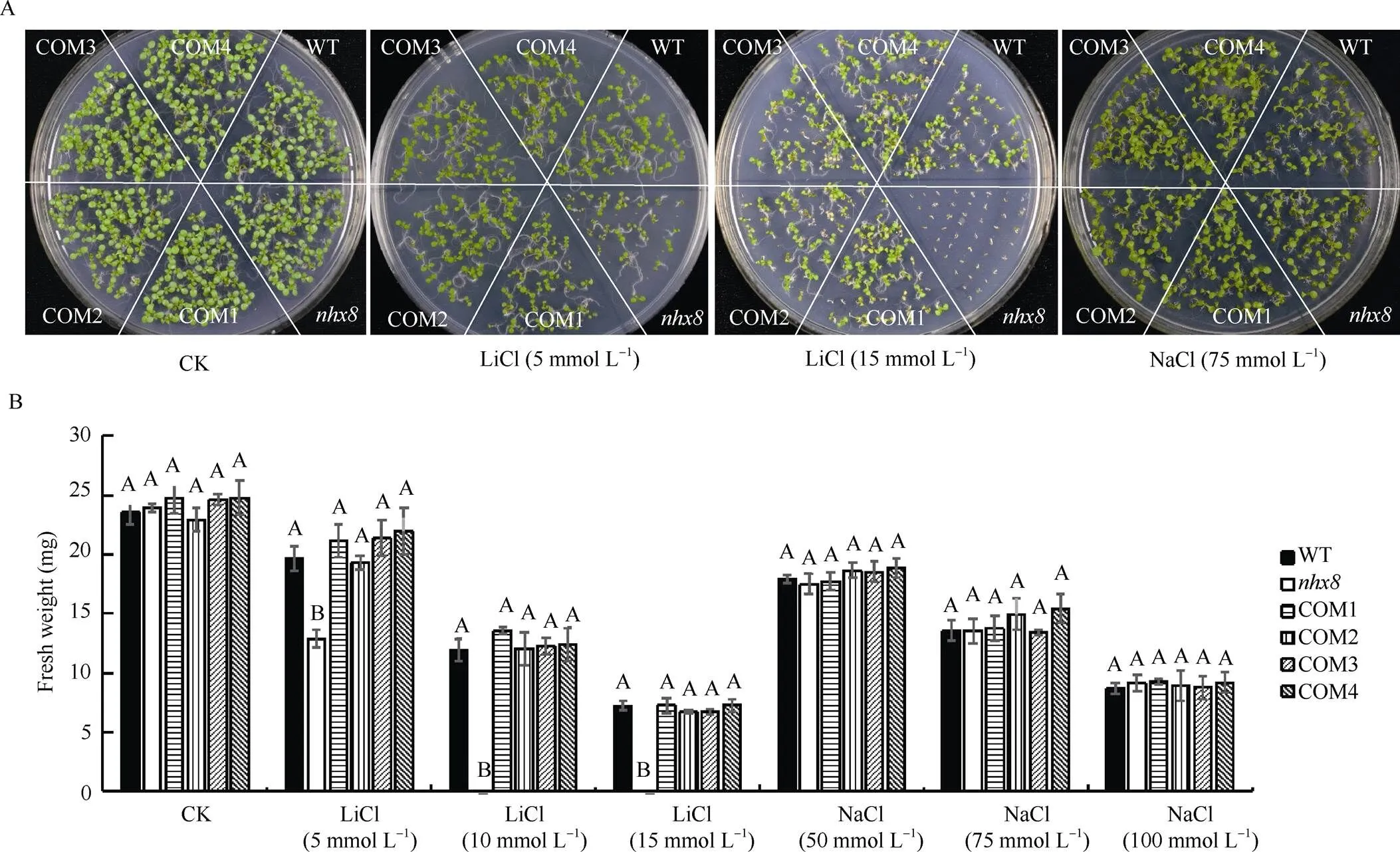
图6 拟南芥不同株系表型图及鲜重情况
A: WT、和COM1~COM4在含有0、5、15 mmol L–1LiCl, 75 mmol L–1NaCl的MS培养基上的生长表型图; B: WT、和COM1~COM4在含有离子胁迫的培养基上生长7 d后的鲜重情况(数据显示为平均值±SD,= 20。图柱上不同大写字母表示在0.01水平上同一处理下的材料间差异显著)。
A: germination and subsequent growth of wild type,and COM1–COM4 plants under MS agar medium and MS medium containing 5 or 15 mmol L–1LiCl, or 75 mmol L–1NaCl. B: the fresh weight of wild type,and COM1–COM4 after seven days of growth on medium containing ionic stress (the data are shown as mean ± SD,= 20. Bars superscripted by different capitals are significantly different at< 0.01 within a treatment).
2.5.3 根长情况分析 由不同株系拟南芥根长生长情况观察(图7)可知, 在Li+胁迫下, 拟南芥突变体根部的生长受到影响, 当Li+浓度大于10 mmol L–1时, 突变体的根部已停止生长, 转基因互补株系(COM1、COM4)与WT的根长在同种浓度的Li+胁迫下无显著差异。在同浓度的Na+的处理下, WT、、COM1和COM4根长表型相近。由此可以证明基因的转入可以缓解突变体对Li+的敏感性, 使拟南芥的根恢复正常生长。
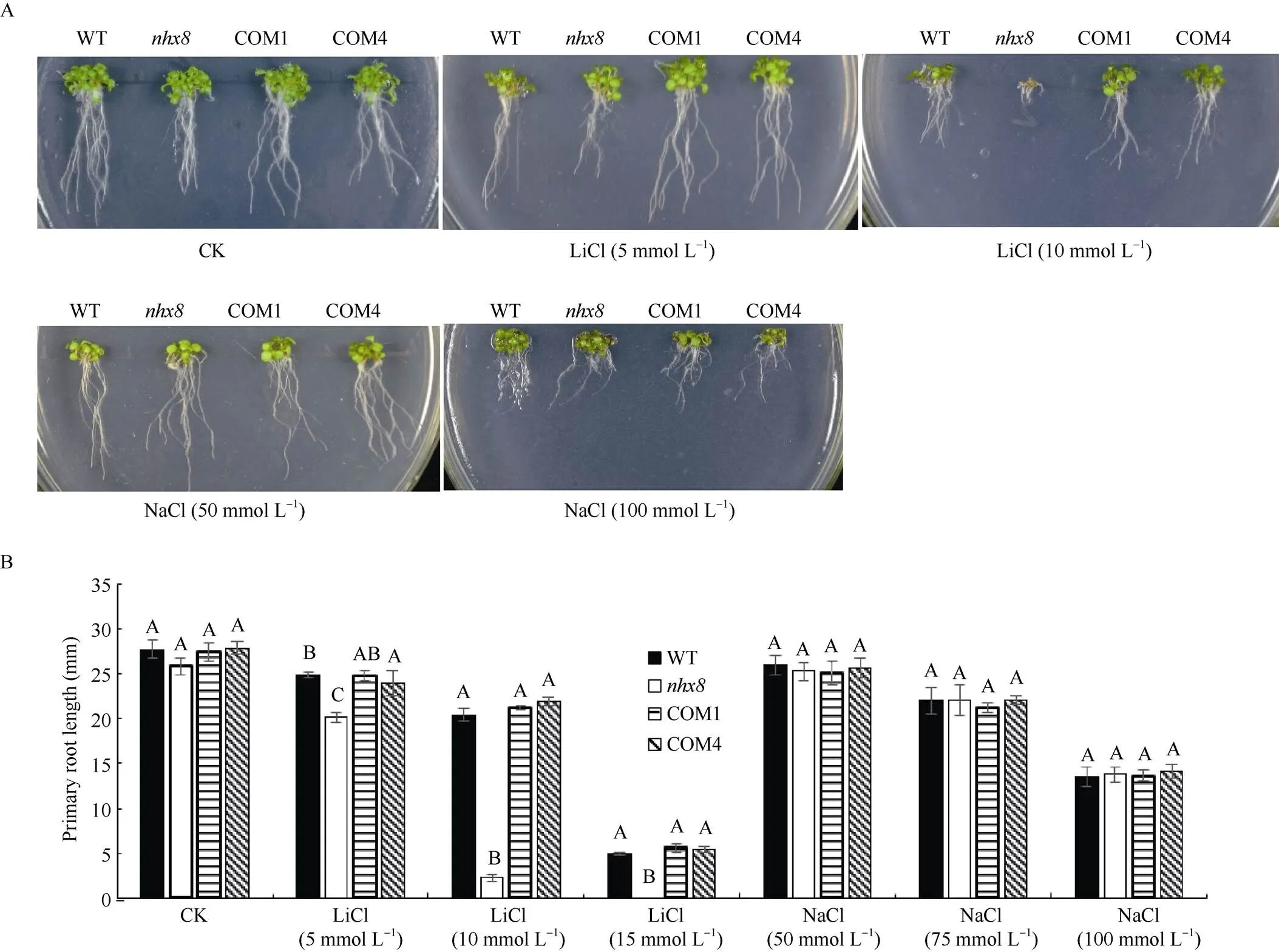
图7 拟南芥根长及其数据统计
A: WT、、COM1和COM4在含有0、5、10 mmol L–1LiCl, 50、100 mmol L–1NaCl的MS培养基上的根长表型图; B: WT、、COM1、COM4在含有离子胁迫的培养基上生长7 d后的根长数据统计(数据显示为平均值±SD,= 10。图柱上不同大写字母表示在0.01水平上同一处理下的材料间差异显著)。
A: root length phenotype of WT,, COM1, and COM4 on MS medium containing 0, 5, 10 mmol L–1LiCl, and 50, 100 mmol L–1NaCl. B: the root length of WT,, COM1, and COM4 after seven days of growth on medium containing ionic stress (The data are shown as mean ± SD,= 10. Bars superscripted by different capitals are significantly different at the< 0.01 within a treatment).
3 讨论
植物的正常生长离不开无机盐, 但是盐浓度过高会造成作物代谢不平衡、渗透胁迫及离子毒害, 进一步引起氧化胁迫甚至死亡[27]。土壤中Li+含量过高会对作物产生毒害作用, 降低种子萌发率和叶绿素含量、影响干物质积累和根系发育[5,28]、抑制花粉的产生和植物的节律运动。此外, Li+在细胞质的积累过程中可能与蛋白质相互作用并调节各种生化过程, 例如, Li+可能与三磷酸肌醇相互作用并抑制肌醇-1-磷酸酶活性, 因此破坏钙依赖性信号传导途径[29]; Li+和K+具有相似的运输途径, 因此Li+可能破坏依赖于K+的各种代谢功能[30]。为了使作物正常生长需要解除离子毒性, 将细胞内多余的Li+排出体外。
已有报道AtNHX8是拟南芥阳离子/质子逆向转运蛋白家族中的一个专性Li+/H+逆向转运蛋白, 其在拟南芥的根、茎、叶、花等部位均有表达, 亚细胞定位结果显示该蛋白定位于细胞质膜, 它在解除植物体内的Li+毒性及维持胞内离子平衡等方面发挥重要的作用[2,14]。通过同源克隆的方法, 本研究在玉米基因组中鉴定到与拟南芥Li+/H+逆向转运蛋白AtNHX8高度同源的基因, 该基因CDS全长3411 bp, 编码1136个氨基酸, 同样具有解除Li+毒性的作用。将ZmNHX7与AtNHX7和AtNHX8进行蛋白序列比对发现, 这些蛋白的N端高度保守, 这可能与它们的基因结构相关, 此类蛋白的N端对应着跨膜区, C端对应着亲水性尾巴[2,13]。有研究表明AtNHX7的C端亲水区约含700个氨基酸, 其N端跨膜区和C端长链尾巴共同构成一个同源二聚体结构, 无盐胁迫时, AtNHX7的C末端自抑制域与相邻的激活域相互结合, 保持休眠状态, 在盐胁迫下, AtNHX7蛋白C末端自抑制域被解除, 转为活化状态, 把细胞内过多的Na+排出细胞外, 从而减少Na+对细胞的危害, 使植物表现出较高的耐盐性[31]。相较于的基因序列更长, 通过蛋白序列比对其多出的序列位于C端, 推测这部分序列可能编码C端长链尾巴, 在盐胁迫和离子毒害过程中使基因转为活化状态, 对细胞内金属阳离子的外排过程发挥作用。
已有研究表明Li+对植物的毒害作用可能是由于植物细胞中的微管去磷酸化作用引起的[32]。这样, Li+会影响叶片组织中ATP的生成, 而叶片组织中的ATP是植物组织中各种代谢过程的主要能源, ATP合成量的减少可能会使重要的细胞功能暂停, 进一步会影响细胞的生理活性。因此较高浓度的Li+可能会影响细胞的伸长和分化, 从而降低叶面积并最终降低作物鲜重。例如, Jurkowska等[33]报道, Li+浓度达到25 mg kg–1时足以抑制燕麦的生长, 玉米和菠菜在Li+浓度达到40 mg kg–1的土壤中生长发育就会受到抑制。另外, 植物根在与Li+的接触过程中改变了根的重力生长[34], 例如, 在富含Li+的土壤中种植玉米, 玉米的根尖受损, 根毛和根冠的发育受限[35]。在本研究中, 拟南芥基因突变后, 拟南芥解除Li+毒害的功能缺失, 比较相同浓度Li+培养基上的WT、和转基因互补纯合株系的鲜重与根长情况,的鲜重降低和根长发育受限情况最为显著, 但转基因互补纯合株系在鲜重积累与根长发育等方面和WT相比均无显著差异, 证明基因可以发挥离子解毒的功能, 将细胞内多余的Li+排出体外, 维持细胞内正常的离子平衡。有研究表明基因也可以将Na+排出细胞外, 在玉米抵御盐胁迫的过程中也发挥了重要作用[36], 而在本研究中并没有构建相关的转基因互补株系, 因此该结论需要进一步研究论证。
4 结论
玉米阳离子/质子逆向转运蛋白ZmNHX7与拟南芥Li+/H+逆向转运蛋白AtNHX8亲缘关系较近,在玉米各个时期组织部位均有表达, 在V7时期的根和茎中表达量较高, 它被定位在细胞质膜与核膜上, 在受到盐离子胁迫时基因表达量上调。将该基因转入拟南芥突变体中, 经筛选得到的纯合转基因互补株系可以恢复突变体对Li+的敏感性。表明在解除Li+毒害和维持植物细胞内离子平衡等方面发挥重要作用。
[1] Nublat A, Desplans J, Casse F, Berthomieu P., anmutant overaccumulating sodium in the shoot, shows deficiency in the control of the root radial transport of sodium., 2001, 13: 125–137.
[2] 安瑞. 拟南芥基因的克隆及其功能研究. 中国农业大学博士学位论文, 北京, 2006. An R. Cloning and Functional Analysis ofGene. PhD Dissertation of China Agricultural University, Beijing, China, 2006 (in Chinese with English abstract).
[3] Laurence K, Jerome K, Guiomar G C, Andrew L, John C. Induced plant accumulation of lithium., 2018, 8: 56–73.
[4] Kszos L A, Stewart A J. Review of lithium in the aquatic environment: distribution in the United States, toxicity and case example of groundwater contamination., 2003, 12: 439–447.
[5] Jiang L, Wang L, Zhang L, Tian C. Tolerance and accumulation of lithium inSchrenk., 2018, 6: e5559.
[6] Apse M P, Aharon G S, Snedden W A, Blumwald E. Salt tolerance conferred by overexpression of a vacuolar Na+/H+antiport in., 1999, 285: 1256–1258.
[7] Kumar S, Kalita A, Srivastava R, Sahoo L. Co-expression ofand bar improves the tolerance to salinity, oxidative stress, and herbicide in transgenic mungbean., 2017, 8: 1896.
[8] 卜华虎. 玉米Na+/H+质子泵ZmNHX1功能的初步研究. 中央民族大学硕士学位论文, 北京, 2011. Bu H H. Preliminary Study on the Function of Maize Na+/H+Proton Pump ZmNHX1. MS Thesis of Minzu University of China, Beijing, China, 2011 (in Chinese with English abstract).
[9] Fukuda A, Nakamura A, Tanaka Y. Molecular cloning and expression of the Na+/H+exchanger gene in., 1999, 1446: 149–155.
[10] Fukuda A, Nakamura A, Tagiri A, Tanaka H, Miyao A, Hirochika H, Tanaka Y. Function, intracellular localization and the importance in salt tolerance of a vacuolar Na+/H+antiporter from rice., 2004, 45: 146–59.
[11] 徐璐, 郭善利, 尹海波. Na+/H+逆向转运蛋白与植物耐盐性研究. 湖北农业科学, 2016, 55: 2727–2730. Xu L, Guo S L, Yin H B. The Na+/ H+antiporter and its relation to salt tolerance in plants., 2016, 55: 2727–2730 (in Chinese with English abstract).
[12] 马清, 包爱科, 伍国强, 王锁民. 质膜Na+/H+逆向转运蛋白与植物耐盐性. 植物学报, 2011, 46: 206–215 Ma Q, Bao A K, Wu G Q, Wang S M. Plasma membrane Na+/H+antiporter is involved in plant salt tolerance., 2011, 46: 206–215 (in Chinese with English abstract).
[13] Shi H, Ishitani M, Kim C, Zhu J K. Thesalt tolerance geneencodes a putative Na+/H+antiporter., 2000, 97: 6896–6901.
[14] An R, Chen Q J, Chai M F, Lu P L, Su Z, Qin Z X, Chen J, Wang X C., a member of the monovalent cation: proton antiporter-1 family in, encodes a putative Li+/H+antiporter., 2010, 49: 718–728.
[15] 沈丹丹, 程文, 王志武, 卢增斌, 赵苏娴, 丁照华, 张恩盈. 我国玉米耐盐种质研究现状与展望. 山东农业科学, 2018, 50(11): 163–167. Shen D D, Cheng W, Wang Z W, Lu Z B, Zhao S X, Ding Z H, Zhang E Y. Research advances and prospects of salt tolerant maize germplasms in China., 2018, 50(11): 163–167 (in Chinese with English abstract).
[16] 许静, 单亚楠, 何豆, 陈淞渝, 庄炜, 王爱荣. 甘蓝型油菜SNARE蛋白SYP122叶片瞬时表达体系的建立. 福建农林大学学报(自然科学版), 2019, 48: 459–465. Xu J, Shan Y N, He D, Chen S Y, Zhuang W, Wang A R. Establishment of transient expression system of SNARE protein SYP122 inleaves.(Nat Sci Edn), 2019, 48: 459–465 (in Chinese with English abstract).
[17] 李磊, 杨远柱, 刘泓, 杜长青, 林建中, 朱咏华, 刘选明. 金针菇谷氨酸脱氢酶基因的克隆及原核表达. 生命科学研究, 2013, 17: 230–237. Li L, Yang Y Z, Liu H, Du C Q, Lin J Z, Zhu Y H, Liu X M. Cloning of a glutamate dehydrogenase gene fromand prokaryotic expression., 2013, 17: 230–237 (in Chinese with English abstract).
[18] 高凯. NJ进化树构建方法的改进及其应用. 北京工业大学硕士学位论文, 北京, 2008. Gao K. Improvement and Application of Neighbor-Joining Method for Phylogenetic Tree Reconstruction. MS Thesis of Beijing University of Technology, Beijing, China, 2008 (in Chinese with English abstract).
[19] Higgins D G, Thompson J D, Gibson T J. Using CLUSTAL for multiple sequence alignments., 1996, 266: 383–402.
[20] Attitalla I H. Modified CTAB method for high quality genomic DNA extraction from medicinal plants., 2011, 14: 998–999.
[21] 杨明峰, 韩宁, 陈敏, 王宝山. 植物盐胁迫响应基因表达的器官组织特异性. 植物生理学通讯, 2002, 38: 394–398. Yang M F, Han N, Chen M, Wang B S. Organ tissue specificity of plant salt stress response gene expression., 2002, 38: 394–398.
[22] Zhao W T, Feng S J, Li H, Faust F, Kleine T, Li L N, Yang Z M. Salt stress-inducedimproves resistance to salt stress by limiting sodium accumulation in., 2017, 7: 14737.
[23] Earley K W, Haag J R, Pontes O, Opper K, Juehne T, Song K, Pikaard C S. Gateway-compatible vectors for plant functional genomics and proteomics., 2006, 45: 616–629.
[24] Batistic O, Sorek N, Schültke S, Yalovsky S, Kudla J. Dual fatty acyl modification determines the localization and plasma membrane targeting of CBL/CIPK Ca2+signaling complexes in., 2008, 20: 1346–1362.
[25] 许青松, 赵佳, 魏运民, 韩蓉蓉, 刘卢生, 蒋曹德, 玉永雄. 紫花苜蓿基因的克隆及表达分析. 浙江农业学报, 2019, 31: 11–19. Xu Q S, Zhao J, Wei Y M, Han R R, Liu L S, Jiang C D, Yu Y X. Cloning and expression analysis of oxalate oxidase genefrom., 2019, 31: 11–19 (in Chinese with English abstract).
[26] Zhang F, Li L, Jiao Z, Chen Y, Liu H, Chen X, Fu J, Wang G, Zheng J. Characterization of the Calcineurin B-Like (CBL) gene family in maize and functional analysis ofunder abscisic acid and abiotic stress treatments., 2016, 253: 118–129.
[27] 蔡晓锋, 胡体旭, 叶杰, 张余洋, 李汉霞, 叶志彪. 植物盐胁迫抗性的分子机制研究进展. 华中农业大学学报, 2015, 34(3): 134–141. Cai X F, Hu T X, Ye J, Zhang Y Y, Li H X, Ye Z B. Molecular mechanisms of salinity tolerance in plants., 2015, 34(3): 134–141 (in Chinese with English abstract).
[28] Hawrylak N B, Kalinowska M, Szymańska M. A study on selected physiological parameters of plants grown under lithium supplementation., 2012, 149: 425–430.
[29] Harwood A J. Lithium and bipolar mood disorder: the inositol-depletion hypothesis revisited., 2005, 10: 117–126.
[30] Bakhat H F, Rasul K, Farooq A B U, Zia Z, Natasha, Fahad S, Abbas S, Shah G M, Rabbani F, Hammad H M. Growth and physiological response of spinach to various lithium concentrations in soil., 2019, 11: 1–9.
[31] 李晓院, 解莉楠. 盐胁迫下植物Na+调节机制的研究进展. 生物技术通报, 2019, 35(7): 148–155. Li X Y, Xie L N. Research progress in Na+regulation mechanism of plants under salt stress., 2019, 35(7): 148–155 (in Chinese with English abstract).
[32] Bartolo M E, Carter J V. Lithium decreases cold-induced microtubule depolymerization in mesophyll cells of spinach., 1992, 99: 1716–1718.
[33] Jurkowska H, Rogoz A, Wojciechowicz T. Comparison of lithiumtoxic influence on some cultivars of oats, maize and spinach., 2018 36: 37–42.
[34] Mulkey T J. Alteration of growth and gravitropic response of maize roots by lithium., 2005, 18: 119–120.
[35] Kabata P A, Mukherjee A B. Trace Elements from Soil to Human. Berlin: Environmental Chemistry Press, 2007. pp 9–38.
[36] 赵祥强. 玉米Na+/H+逆向转运蛋白基因的克隆与鉴定. 安徽农业科学, 2009, 37: 17843–17848.Zhao X Q. Cloning and identification of a new Na+/H+antiporter genein maize., 2009, 37: 17843–17848 (in Chinese with English abstract).
Functional identification of maize cation/proton antiporter ZmNHX7
ZHANG Ling-Xiao1,2, JIAO Zhen-Zhen2, BU Hua-Hu2, WANG Yi-Ru2, LI Jian2,3, and ZHENG Jun1,2,*
1College of Plant Science and Technology, Beijing University of Agriculture, Beijing 102206, China;2Institute of Crop Sciences, Chinese Academy of Agricultural Sciences, Beijing 100081, China;3College of Agronomy, Jilin Agricultural University, Changchun 130118, Jilin, China
Plant cation/proton antiporters can maintain intracellular ion homeostasis and resist ion toxicity. In this study, a gene encoding a maize cation/proton antiporter was cloned and named as. The coding sequence ofwas 3411 bp, encoding a protein with 1136 amino acids.is ubiquitously expressed in various tissues of maize, With higher expression level in roots and stems at the V7 stage. The expression ofwas induced by NaCl and LiCl stresses. In phylogenetic tree ZmNHX7 showed a close relation with AtNHX7 and AtNHX8of. ZmNHX7 was located in cell membrane and nuclear membrane by confocal laser scanning microscopy analysis of the lower epidermis of tobacco leaves. Whengene was transformed into theT-DNA insertion mutant, the transgenic complementary lines could restore the tolerance ofto Li+. These results indicate thatencodes a plasma membrane cation/proton antiporter of maize, which plays an important role in reducing the toxicity of Li+to plants and maintaining intracellular ion homeostasis.
maize;; antiporter; ion toxicity
10.3724/SP.J.1006.2020.93062
本研究由国家重点研发计划项目(2016YFD0101002)资助。
This work was supported by the National Key Research and Development Program of China (2016YFD0101002).
郑军, E-mail: zhengjun02@caas.cn
E-mail: 13522840682@163.com
2020-02-06;
2020-03-24;
2020-04-03.
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20200402.2005.004.html

