有氧运动联合水飞蓟宾对阻塞性黄疸小鼠模型肠黏膜屏障的影响
彭律成,邵长凤,陈嘉勤,陈 伟,3
1 永州职业技术学院,湖南 永州 425100;2 湖南师范大学 体适能与运动康复湖南省重点实验室,长沙 410006;3 湖南体育职业学院,长沙 410019
阻塞性黄疸(obstructive jaundice,OJ)指肝管梗阻后胆汁排泄不畅,胆红素反流入血,而出现巩膜及其全身皮肤黄染,也称为外科黄疸[1]。肠道胆汁缺乏会使肠黏膜屏障受到破坏,肠道细菌和内毒素进入血液循环,引发全身性炎症及多器官功能障碍[2-4]。目前OJ对肠黏膜屏障的影响已成为热点。研究[5]发现,microRNAs(miRNAs)能直接或间接与炎症通路的很多关键基因作用。miRNA-21是迄今研究的最为广泛的miRNAs之一[6]。有研究[7-8]报道,miRNA-21参与了缺血后处理抗肠缺血再灌注损伤的调控过程,其已成为抗炎反应的一个关键因子。Toll样受体4(TLR4)可通过激活其下游效应因子NF-κB,促进炎症介质的释放,导致炎症反应的发生[9]。新近研究[10]证实,TLR4是miRNA-21的下游靶蛋白。miRNA-21过表达可通过抑制TLR4及其下游 NF-κB的活化,降低炎症因子的表达。但miRNA-21/TLR4/NF-κB通路是否参与了OJ肠损伤的调控过程,尚缺少文献报道。作为天然多酚类黄酮,水飞蓟宾具有抗炎、抗脂质过氧化、抗脂氧酶等活性,可以减少炎症细胞因子的产生,并减轻结肠黏膜屏障的损伤[11-12]。有氧运动作为一种简单、易行且经济的临床康复治疗手段,对OJ肝损伤具有改善作用[13-14],同时可以改善肠缺血再灌注、炎症性肠病和结肠癌肠黏膜损伤。但有氧运动和水飞蓟宾,以及联合干预在OJ肠损伤中的作用及机制,鲜有相关文献报道。为此,本研究利用本课题组胆总管结扎法,采用手术线直角悬挂胆总管72 h构建小鼠OJ模型,探讨有氧运动及水飞蓟宾对OJ小鼠肠黏膜屏障的影响及可能的交互效应。
1 材料与方法
1.1 主要试剂与仪器 主要试剂:Trizol(Inventragtion)、反转录试剂盒(TAKA-RA,美国)、mRNA引物(上海生工生物工程技术服务有限公司)、miRNA-21 引物(Ribobio)、兔抗多克隆抗体TLR4、NF-κB(南京建成生物工程研究所)、DAB显色试剂盒(武汉博士德)、TBil、ALT、AST、二胺氧化酶(DAO)、内毒素检测试剂盒(南京建成生物工程研究所)、D-乳酸试剂盒(上海江莱生物科技有限公司)。主要仪器:YD-6D型生物组织石蜡包埋机、YD-A生物组织摊烤片机、LEICA RM2235 切片机、WFG 7200型可见分光光度计、Bio-Rad CFX96Touch 实时荧光定量 PCR 仪、倒置相差显微镜、高速低温离心机、099C K54型电动匀浆机、高性能超净工作台。
1.2 动物模型构建与分组 选取成年健康雄性昆明小鼠,体质量18~22 g,由湖南斯莱克景达实验动物中心提供(生产许可证 SCXK〔Xiang〕2016-0002)。采用国家标准啮齿类动物饲料饲养1周后,参照本课题组大鼠胆总管结扎构建OJ模型[15]并加以改进, 构建一种新的胆总管短期(72 h)悬挂OJ小鼠模型。操作如下:麻醉状态下,镊子夹起腹部皮肤,剪刀纵向开1~1.5 cm切口,暴露肝脏。距肝门1 cm处分离胆总管,4-0不可吸收手术线将其悬挂于腹壁。假手术组小鼠仅在腹部开同等长度切口,缝合。小鼠放笼饲养,待自然苏醒。2 d后解除悬挂,复位胆总管。构建OJ模型成功的小鼠随机分为模型组(M)、有氧运动组(E)、水飞蓟宾组(S)和有氧运动联合水飞蓟宾组(ES),另设假手术组(GO),每组10只。
1.3 干预方案 确定小鼠运动能力正常,E组和ES组采用中等强度跑台训练,训练前进行为期1周的运动强度适应,固定于每天下午4点。第1~2天,设置运动跑台坡度为0°,速度6 m/min,训练25 min/d;第3~4天,设置运动跑台坡度为5°,速度8 m/min,训练40 min/d;第5~6天设置运动跑台坡度为8°,速度10 m/min,训练1 h/d。之后保持此强度共训练至第7周,每周休息1 d。S组和ES组按人与小鼠体表面积折算等效剂量经口灌胃(200 mg/kg体质量,0.4 ml生理盐水进行溶解)。GO组、M组和E组进行相同体积的生理盐水灌服,1次/d,共7周。
1.4 样品采集与处理 干预7周后,小鼠禁食过夜,2%戊巴比妥钠(500 mg/kg)麻醉,确认无翻转反射后,眼科镊子摘眼球取血至5 ml 抗凝管中,4 ℃、4500 r/min 离心15 min,吸取上清液,-20 ℃保存备用。手术剪开腹,分离组织,暴露小肠段,距回盲部约3cm处,向近端依次切取末端回肠3段,每段约1 cm,生理盐水洗净回肠组织,最末端加入1 ml Trizol,储存于-80 ℃;次末端液氮速冻后储存于-80 ℃,用于检测基因和蛋白表达;近端用10%多聚甲醛固定,备用于相关染色。
1.5 病理学观察 回肠组织石蜡切片,厚度4 μm,脱蜡、乙醇梯度脱水,HE染色,乙醇梯度脱水,二甲苯透明,滴加中性树胶进行封片,于光学显微镜下观察回肠组织的形态。
1.6 血清学指标检测 利用全自动生化分析仪测定TBil、ALT和AST;速率法检测血清中DAO活性;ELISA法检测血清D-乳酸水平。采用终点显色法(显色基质)定量检测内毒素含量,Bradford法测定回肠组织TLR4、NF-κB、TNFα蛋白含量。
1.7 免疫组化染色 回肠组织石蜡切片,厚度4 μm,步骤按说明书操作,PBS替代一抗作阴性对照。采用链霉亲和素-生物素-过氧化物酶复合物技术(SABC法)检测回肠组织中TLR4、NF-κB及TNFα阳性表达,用Simple PCI图像分析系统进行结果分析,Olympus光学显微镜下计算阳性表达面积百分比。
1.8 real-time PCR检测及高通量测序
1.8.1 回肠组织总RNA提取 按照说明书使用高容量的cDNA逆转录试剂盒进行cDNA的合成。使用 Prime Script®RT Master Mix Perfect Real Time kit 定量检测TLR4、NF-κB、TNFα mRNA表达水平,One Step Prime Script®miRNA cDNA Synthesis Kit 试剂盒逆转录试剂盒和 SYBR Green PCR Master Mix Kit(Applied biosystems)PCR试剂盒逆转录与定量miRNA-21基因水平。qRT-PCR使用 CFX Connect PCR 系统(BioRad,USA)进行 40 个循环,GAPDH和U6作为内部参照。根据GeneBank 核酸数据库中神经组织各因子cDNA 序列,TLR4、NF-κB、TNFα mRNA基因引物均由上海生工生物工程技术服务有限公司设计合成(表1),miRNA-21、U6(内参基因)亦按照miR Base database 数据库中的碱基由广州 Ribobio生物科技有限公司提供。PCR 检测过程每样本设3个重复,测试结果采用 2-△△Ct法计算组织中基因表达水平,ΔΔCt=实验组(Ct目的基因-Ct内参基因)-校正组(Ct目的基因-Ct内参基因)。

表1 mRNA基因引物序列
1.8.2 高通量测序 提取检测样本肝组织总RNA,待琼脂糖电泳检测其纯度合格后,用带有Oligo(dT)的磁珠富集mRNA,向得到的mRNA中加入Fragmentation Buffer使其成为短片段,再以片断后的mRNA为模板,用六碱基随机引物合成cDNA第一链,并加入缓冲液、dNTPs、RNaseH和DNA Polymerase Ⅰ合成cDNA第二链,经过QIAQuick PCR试剂盒纯化并加EB缓冲液洗脱。洗脱纯化后的双链cDNA再进行末端修复、加碱基A、加测序接头处理,然后经琼脂糖凝胶电泳回收目的大小片段并进行PCR扩增,完成整个文库制备工作。采用Illumina HiSeq 2500进行测序。测序策略为SE50,DEGseq基因表达分析不同组别测序结果的差异性,选取|log2Ratio|≥1与q<0.05的差异表达基因,获取上下调差异表达基因。
1.9 伦理学审查 本研究方案经由湖南师范大学医学伦理委员会科学研究项目审批(批号:2018183),符合实验室动物管理与使用准则。
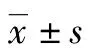
2 结果
2.1 一般情况 在模型构建过程中,建模小鼠均未出现由手术或其他原因造成的死亡情况。梗阻约48 h,小鼠嗜睡,精神萎靡,行动迟缓,毛发杂乱、无光泽,尿色变黄。梗阻72 h左右,小鼠尾巴、耳尖及腹部开始出现皮肤黄染,大便色浅、量少,个别小鼠呈现便秘状态,解剖发现构模小鼠胆管悬挂处出现囊性扩张,肝脏呈淤胆样改变。有氧运动及水飞蓟宾干预7周后,相比M组,E组、S组、ES组OJ生理病理症状明显减轻。
2.2 回肠组织病理学改变 图1可见,GO组小鼠肠黏膜正常,腺体、绒毛形态正常,腺上皮排列整齐,基底膜及肌层完整。M组肠黏膜结构破坏严重,绒毛稀疏、变细,部分腺体萎缩且高度不均,脱落,间质水肿,局部有炎症细胞浸润,肌层萎缩。E组肠黏膜结构有所改善,腺体排列整齐,细胞形态正常,水肿消失,少有炎症细胞浸润。S组腺上皮排列整齐,腺体分泌活跃。ES组长绒毛形态,接近正常肠上皮。
2.3 肝功能测定结果 M组小鼠血清TBil、ALT 和AST水平最高;E组、S组血清TBil、ALT和AST水平较M组均明显降低(P值均<0.01);与E组、S组相比,ES组TBil、ALT 和AST水平降低(P值均<0.05)(表2)。且有氧运动与水飞蓟宾间对血清TBil、ALT 和AST水平存在协同作用(P值均<0.05)。

表2 各组血清TBil、ALT、AST水平的比较
2.4 血清DAO、D-乳酸和内毒素测定结果 M组血清中肠屏障功能指标DAO、D-乳酸及内毒素水平最高;相比M组,E组、S组和ES组血清中DAO、D-乳酸水平及内毒素水平均下降(P值均<0.05);相比E组、S组,ES组DAO与D-乳酸水平下降均具有非常显著性差异(P值均<0.01),内毒素水平下降具有显著性差异(P<0.05)(表3)。对于上述指标,除DAO水平以外,有氧运动和水飞蓟宾间均存在协同作用(P值均<0.05)。

表3 肠屏障功能相关指标检测结果
2.5 回肠组织TLR4、NF-κB、TNFα免疫组化染色结果TLR4免疫阳性细胞呈棕褐色,NF-κB、TNFα呈淡蓝色,胞体染色深,胞核不着色(图2)。GO组中小鼠肠组织TLR4、NF-κB、TNFα蛋白阳性表达面积最低,M组表达最高;相比M组,E组、S组、ES组各炎性因子蛋白阳性面积均显著下降(P值均<0.01),相比E、S组,ES组各因子阳性表达面积降低(P值均<0.01)(表4)。对于NF-κB、TNFα蛋白表达,有氧运动和水飞蓟宾间具有协同作用(P值均<0.05)。

表4 相关因子蛋白阳性表达面积
2.6 回肠组织TLR4、NF-κB、TNFα蛋白水平检测 M组肝组织中TLR4、NF-κB、TNFα蛋白水平最高,ES组最低。相比M组,E组、S组、ES组肝组织TLR4、NF-κB、TNFα蛋白水平均显著降低(P值均<0.05);相比E组、S组,ES组TLR4、NF-κB、TNFα蛋白水平均具有明显降低趋势(P值均<0.05)(表5)。除NF-κB蛋白水平外,有氧运动和水飞蓟宾对TLR4、TNFα蛋白水平的升高具有协同作用(P值均<0.05)。
2.7 高通量测序的KEGG功能富集关联分析 实验为探究不同组别样本转录组间差异,主要对E组与M组、E组与ES组、S组与ES组间肝组织的差异表达基因进行筛选,共鉴定出10 657个差异表达基因,含7415个上调基因,3242个下调基因,其主要在炎症信号通路激活后诱发,与炎性因子释放密切相关,以及涉及参与调控细胞增殖分化、细胞损伤修复和心血管神经变性的相关蛋白抑制剂等。高通量测序结果显示共207个差异表达基因富集于60个KEGG通路,主要参与肝纤维化发病机制、TNFα通路、胆汁分泌、NOD样受体信号传导、TLR-NF-κB 信号通路、炎症介质调节信号通路、TGFβ信号通路等。另细胞增殖、分化、硫代谢、多巴胺等差异表达基因也富集于KEGG 通路,虽不具非常显著性差异,但差异表达基因所对应的富集通路具有一定意义。
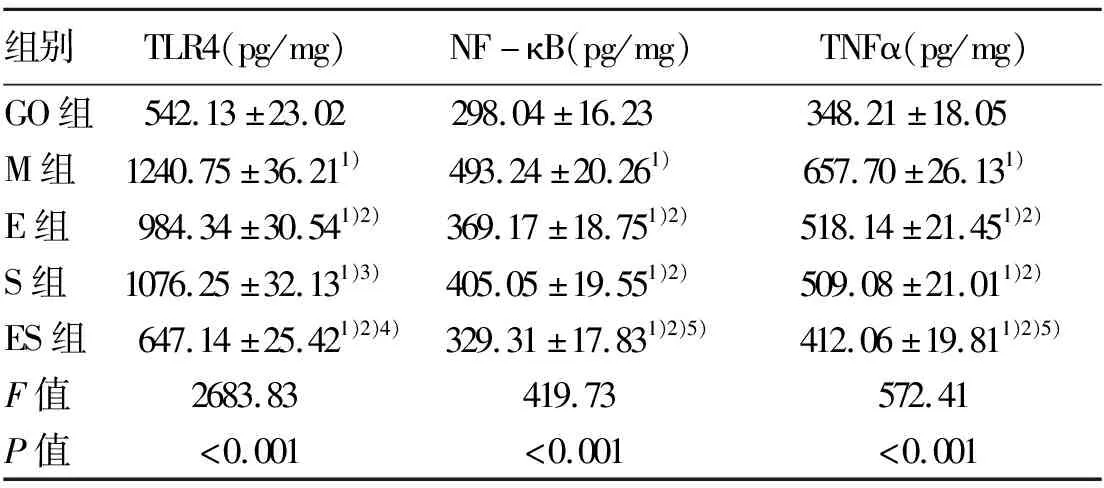
表5 回肠组织相关因子蛋白水平检测
2.8 回肠组织miRNA-21/TLR4/NF-κB通路轴相关因子基因表达 相比M组,7周有氧运动干预后E组、S组、ES组miRNA-21基因表达均显著升高(P值均<0.05),相比E组、S组,ES组miRNA-21基因表达显著升高(P值均<0.01)。M组小鼠TLR4、NF-κB、TNFα mRNA表达最高(P值均<0.01)。与M组比较,E组、S组TLR4、NF-κB、TNFα mRNA表达显著降低(P值均<0.01);与E组、S组相比,ES组TLR4、NF-κB、TNFα mRNA表达显著下降(P值均<0.01)(表6)。除miRNA-21 mRNA表达水平外,有氧运动和水飞蓟宾对于TLR4、NF-κB、TNFα mRNA表达存在协同效应(P值均<0.05)。

表6 回肠组织miRNA-21、TLR4、NF-κB、TNFα mRNA表达
3 讨论
胆汁是肝脏合成及分泌的一种复杂水溶液,对于小肠中脂肪和脂溶性维生素的消化和吸收至关重要。此外,胆汁是消除过量胆固醇、内毒素、胆红素、药物和有毒化合物的重要途径[16]。多种原因诱发胆汁分泌或排泄障碍时,造成肝脏内毒性和代谢废物的堆积,胆汁酸与胆红素在机体体循环中含量增加,同时由于肠道胆汁缺乏,肠道细菌繁殖受到抑制及肠源性内毒素降解减慢,呈现胆汁淤积性病变,致使肠屏障功能障碍,促进细菌移位,炎性因子“瀑布样”效应,对多器官生理功能造成影响[17]。胆汁的分泌与排泄信号传导机制错综复杂,主要依靠肝细胞、胆管肠细胞膜上相关蛋白质进行转运。Chiang等[18]研究发现胆汁酸对于保护肝脏和其他组织及细胞免受胆固醇和胆汁酸毒性至关重要。同时也是维持肠屏障功能稳态的重要物质,胆汁酸稳态的改变将导致胆汁淤积性肝病、肠道消化系统炎性疾病、肥胖症和糖尿病。Yang等[19]采用内毒素血症的大鼠胆汁对正常小鼠进行饲养,发现小鼠肝组织巨噬细胞向胆汁中释放了大量的炎症细胞,且胆汁流速显著下降,黏膜通透性和肠道细菌易位性增加。本实验中,高通量测序KEGG分析显示,OJ小鼠肝细胞中转运系统的蛋白分子发生活性变化,肝胞质膜钠依赖牛磺胆酸共转运体、多耐药相关蛋白(multidrug resistance,MRP)3、有机阴离子转运多肽、转运蛋白质、胆盐输出泵(BSEP)等活性下降,MRP4和MRP1活性增加,明显降低胆汁酸排泄和胆汁流量。血清肠屏障功能指标DAO、D-乳酸和内毒素水平显著上升,回肠组织显微结构病理改变明显,同时肝功能指标AST、ALT和TBil水平增加,结合小鼠一般行为学观察结果。提示,OJ小鼠构模成功,并导致肠屏障功能受损,但是否与炎性因子的释放有关尚未确定。
miRNAs是一类内源性表达的、具有多种调控功能的非编码RNA,其长度约为20~25个核苷酸,它可以和靶基因mRNA碱基互补配对,促使沉默复合体对mRNA进行降解,或干扰其翻译,进而影响细胞的增殖、侵袭、凋亡、氧化应激等生理过程[20]。近年来,miRNA对肠道屏障功能的调控作用正逐渐被揭示。目前已经发现诸多miRNA分子在肠黏膜组织中表达异常,引起肠黏膜组织内免疫功能紊乱,损伤肠上皮细胞屏障功能,导致肠黏膜组织内异常炎症免疫反应。miRNA-126通过抑制靶基因S1PR2激活PI3K/AKT信号通路,导致上皮细胞屏障功能受损[21];miRNA-10a在炎症性肠病患者及小鼠炎症肠黏膜组织中表达降低,诱导炎症发生,据报道miRNA-21参与了缺血后处理抗肠缺血再灌注损伤的调控过程[22],已成为抗炎反应的一个关键媒介。对于TLR4与miRNA-21的研究也有部分报道,新近研究[23]证实,TLR4 是miRNA-21的下游靶蛋白。miRNA-21过表达可通过抑制 TLR4 及其下游 NF-κB的活化,降低炎症因子的表达[11]。提示miRNA-21可能具有通过调控TLR4通路而影响肠黏膜损伤发生、进展的潜在作用。然而,miRNA-21/TLR4/NF-κB是否参与OJ肠黏膜损伤过程,仍未得到充分的证实。本实验中,M组miRNA-21表达水平高于GO组,表明OJ小鼠肠组织miRNA-21应激性升高。TLR4、NF-κB、TNFα mRNA表达水平明显上调,TLR4/NF-κB炎性信号通路激活,促进下游TNFα等炎性信号因子的活化,造成炎症瀑布式效应,结合血生化及组织相关指标检测,提示OJ小鼠可能激活miRNA-21/TLR4/NF-κB通路诱发炎症。免疫组化染色及回肠组织蛋白检测结果显示,TLR4、NF-κB、TNFα阳性表达面积及蛋白水平显著上升,结合高通量测序结果,进一步表明miRNA-21/TLR4/NF-κB通路参与了OJ所导致的肠黏膜上皮细胞炎性损伤过程,且胆汁排泄障碍可激活miRNA-21/TLR4/NF-κB炎性通路轴,致使肠屏障功能炎性损伤。
有氧运动和水飞蓟宾抑炎的作用早已被证实,但其是否对miRNA-21起到调控作用,进而下调其靶基因TLR4信号传导机制发挥抑炎作用在很大程度上仍是未知的。多项研究表明,间歇和中等强度运动训练对miRNAs具有调控作用[24]。Baggish等[25]研究发现运动诱导相关miRNAs 的变化,如血管生成(miRNA-20a、miRNA-210、miRNA-221、miRNA-222和miRNA-328)、炎症(miRNA-21和miRNA-146a)、心肌和骨骼肌的收缩(miRNA-21和miRNA-133a)、肌肉对低氧和缺血的适应(miRNA-21、miRNA-146a和miRNA-210)。Dimassi等[26]探讨了9种miRNAs对有氧运动在肥胖调节炎症和血管功能中的作用。根据孟宪欣等[27]的前期报道,长期规律运动下调miRNA-214表达可有效抑制NF-κB活性从而使结肠炎症得到改善,保护炎症性肠病肠黏膜损伤。水飞蓟宾是一种传统草药,可以抑制肠道肿瘤细胞的活力,并抑制肠道炎症。在不同的细胞模型中, 水飞蓟宾都显示对NF-κB等多种炎症因子活性的抑制作用。但目前有氧运动联合水飞蓟宾对OJ致肠屏障功能损伤的文献鲜有报道。本实验中,7周有氧运动和水飞蓟宾灌胃干预后,一般情况观察黄疸症状明显改善,血清AST、ALT和TBil水平显著降低,且有氧运动与水飞蓟宾间存在协同作用。肠黏膜病理结构改善显著,腺体排列整齐,细胞形态正常,水肿消失,少有炎症细胞浸润。血清肠屏障功能指标DAO、D-乳酸和内毒素水平下降,除DAO水平外,有氧运动与水飞蓟宾间存在协同作用。结合回肠组织TLR4、NF-κB、TNFα阳性表达面积及蛋白水平降低结果,表明有氧运动、水飞蓟宾干预与OJ后肠屏障功能的稳定及炎症因子的介导密切相关,且有氧运动与水飞蓟宾对炎性因子的调控存在协同效应。为进一步验证有氧运动、水飞蓟宾与TLR4/NF-κB炎性通路间的关系,本研究对M组、E组、S组与ES组小鼠肝组织进行mRNA高通量测序,且对其测序结果进行关联分析,结合miRNA-21、TLR4、NF-κB、TNFα基因表达结果,有氧运动、水飞蓟宾可显著升高miRNA-21 mRNA表达水平,下调TLR4/NF-κB通路轴,抑制单核细胞等分泌TNFα炎性细胞因子,介导一系列生理(免疫反应性强化)和病理(炎症)反应,保护肠黏膜屏障功能,除miRNA-21基因水平外,有氧运动与水飞蓟宾对于TLR4、NF-κB、TNFα基因表达存在协同作用。
miRNA-21/TLR4/NF-κB通路轴对OJ小鼠致肠屏障功能炎性损伤具有重要调控作用,7周有氧运动与水飞蓟宾可促进miRNA-21高表达,显著下调TLR4的表达,促进炎性因子NF-κB、TNFα低表达,对肠黏膜屏障的炎性损伤发挥了较明显的保护作用,且有氧运动联合水飞蓟宾干预效果更佳,在肠屏障功能的恢复及炎症反应的抑制上,有氧运动与水飞蓟宾间存在协同效应。

