胆管癌中转录因子EB和自噬相关蛋白Beclin 1的表达及其与预后的关系
阮 萍,何婷婷,彭忠异,姚 平
胆管癌的手术治疗切除率低,缺乏有效的辅助化疗药物,且术后复发率高[1]。寻找标志性致癌分子,深入探讨胆管癌发生、发展的机制,是提高胆管癌治疗效果和预后的关键所在。细胞自噬(autophagy)对于肿瘤来说是一柄双刃剑[2]。转录因子EB(transcription factor EB, TFEB)可通过调节从自噬小体形成到降解的整个过程中各种相关基因的表达来调节自噬水平[3]。但关于TFEB在胆管癌中与自噬关系的研究尚未见报道。本实验通过检测TFEB和自噬相关蛋白Beclin 1在胆管癌中的表达,探讨TFEB和Beclin 1作为胆管癌预后指标的可能性。
1 材料与方法
1.1 一般资料收集2011年1月~2017年12月广西中医药大学附属瑞康医院手术切除并确诊的75例胆管癌手术标本(其中肝内胆管癌24例、肝外胆管癌51例)。同时收集所有病例完整的临床资料与随访信息,患者术前均未行放、化疗及生物治疗。随访截至2018年1月。手术日期至复发日期或末次随访日期为无复发生存时间,手术日期至死亡日期或末次随访日期为总生存时间。肝内胆管癌随机选取同期手术切除的20例肝细胞癌(无病毒性肝炎感染史、肝硬化病变及胆道结石病史)的癌旁正常胆管作对照分析,肝外胆管癌随机选取同期手术切除的20例经病理学证实未发现肿瘤细胞浸润的阴性切缘标本作为对照分析。本组所有组织标本的获取均取得患者知情同意,签订由医院伦理委员会批准的患者知情同意书。
1.2 主要试剂兔抗人TFEB和Beclin 1多克隆抗体为美国Novus公司产品、PV 9000两步法免疫组化检测试剂盒及浓缩型DAB染色试剂盒均为北京中杉金桥公司产品,其他常用试剂均为国产分析纯试剂。
1.3 免疫组化标本均经10%中性福尔马林固定、石蜡包埋。切片经二甲苯脱蜡及梯度乙醇至水化;按抗体说明书进行柠檬酸盐或EDTA高温高压修复;3%H2O2抑制内源性过氧化物酶;滴加适当浓度的一抗工作液,4 ℃冰箱孵育过夜;按试剂盒说明书EnVision两步法滴加二抗;滴加DAB显色。对照设计:每批染色分别用一抗说明书建议的组织切片作阳性对照;以非免疫正常兔血清代替一抗作为阴性对照;空白对照以PBS代替一抗。
1.4 结果判定Beclin 1以胞质呈棕黄色颗粒为阳性,TFEB以细胞核出现棕黄色颗粒为阳性。随机选取5个高倍视野(400×),每个视野计数100个肿瘤细胞。按细胞染色强度计分:无阳性着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。按阳性细胞所占百分比计分:无阳性细胞或阳性细胞数<5%为0分,阳性细胞数占5%~24%为1分,25%~49%为2分,50%~74%为3分,≥75%为4分。将两项得分结果相加作为最终结果:>4分为高表达,≤4分为低表达[4]。
1.5 统计学方法所有数据均采用SPSS 17.0软件进行统计学分析,计数资料的描述采用率或构成比。计数资料采用χ2检验或Fisher精确检验。采用Kaplan-Meier法绘制无复发生存曲线及总生存曲线,Log-rank法对组间生存率进行比较。初步筛选无复发生存率和总体生存率的影响因素。将各临床病理因素纳入Cox比例风险模型进行多因素分析,确定预后影响因素。Beclin 1和TFEB的表达相关性采用Spearman等级相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 胆管癌中TFEB及Beclin 1表达TFEB蛋白表达主要定位于胆管癌组织与癌旁正常胆管上皮细胞的胞核。在肝内胆管癌中TFEB蛋白高表达12例(50.00%),癌旁正常胆管上皮高表达2例(10.00%),两组相比差异有统计学意义(χ2=8.046,P=0.005)。在肝外胆管癌中TFEB蛋白高表达24例(47.06%),癌旁正常胆管上皮高表达1例(5.00%),两组相比差异有统计学意义(χ2=11.14,P=0.001,图1A、B)。
Beclin 1蛋白主要定位于胆管癌组织与癌旁正常胆管上皮细胞的胞质。在肝内胆管癌中Beclin 1蛋白高表达10例(41.27%),癌旁正常胆管上皮高表达4例(20.00%),两组相比差异无统计学意义(χ2=0.361,P=0.124)。在肝外胆管癌中Beclin 1蛋白高表达24例(47.06%),癌旁正常胆管上皮高表达2例(10.00%),两组相比差异有统计学意义(χ2=13.824,P<0.001,图1C、D)。

ABCD
在12例TFEB高表达肝内胆管癌中,Beclin 1高表达4例;12例TFEB低表达肝内胆管癌中,Beclin 1低表达6例。24例TFEB高表达肝外胆管癌中,Beclin 1高表达2例;27例TFEB低表达肝外胆管癌中,Beclin 1低表达5例。通过Spearman相关性分析表明,肝内及肝外胆管癌中TFEB及Beclin 1的表达呈负相关,其中肝外胆管癌中TFEB及Beclin 1的负相关差异有统计学意义(rs=-0.731,P<0.001)。
2.2 胆管癌中TFEB及Beclin 1表达与临床病理特征的关系75例胆管癌中,TFEB表达与肿瘤大小、淋巴结转移、血管侵犯及AJCC分期呈正相关(P均<0.05),与患者年龄、性别、解剖部位及分化程度无关(P均>0.05);Beclin 1表达与肿瘤大小、淋巴结转移、血管侵犯及AJCC分期呈负相关(P均<0.05,表1)。
2.3 胆管癌中TFEB及Beclin 1表达与患者预后的关系75例胆管癌患者中位随访时间18.32个月,52例死亡,死亡原因均为肿瘤复发转移、病情进展导致的多器官衰竭,无其他死亡原因。肝内胆管癌TFEB低表达组中位无复发生存期(6.53个月)及中位总生存期(21.80个月)均比高表达组长(3.40、6.17个月),高、低表达组中位总生存期差异有统计学意义(χ2=4.937,P=0.026)。肝外胆管癌TFEB低表达组中位无复发生存期(23.10个月)及中位总生存期(36.77个月)均比高表达组长(6.33、11.70个月),高、低表达组的中位无复发生存期及中位总生存期差异均有统计学意义(χ2=12.278,P<0.001;χ2=12.955,P<0.001)。

表1 胆管癌中TFEB及Beclin 1表达与临床病理特征的相关性
肝内胆管癌中Beclin 1高表达组中位无复发生存期(41.37个月)及中位总生存期(43.47个月)均比低表达组长(4.33、6.10个月),中位无复发生存期及中位总生存期差异均有统计学意义(χ2=10.816,P=0.001;χ2=17.072,P<0.001)。肝外胆管癌中Beclin 1高表达组中位无复发生存期(36.23个月)及中位总生存期(38.77个月)均比低表达组长(4.97、9.93个月),中位无复发生存期及中位总生存期差异均有统计学意义(χ2=20.237,P<0.001;χ2=18.516,P<0.001,图2)。
单因素分析显示,胆管癌的无复发生存期及总生存期与患者年龄、解剖部位、肿瘤大小、血管侵犯、AJCC分期、TFEB及Beclin 1表达等因素有关(P均<0.05,表2)。将上述单因素分析差异具有显著性的指标纳入Cox比例风险模型,分别对无复发生存期和总生存期进行多因素分析,结果显示,TFEB及Beclin 1表达均是影响肝内、肝外胆管癌患者术后总生存期及无复发生存期的显著性因素,TFEB是不良预后因素,而Beclin 1是保护因素。淋巴结转移是影响肝内胆管癌患者术后总生存期及无复发生存期的显著性不良预后因素,血管侵犯是影响肝内胆管癌患者术后总生存期的显著性不良预后因素(P=0.045)。AJCC分期是影响肝外胆管癌患者术后总生存期及无复发生存期的显著性不良预后因素(P均<0.05,表3、4)。
3 讨论
胆管癌是一种起源于胆管上皮的恶性肿瘤,发病率占胃肠道系统所有恶性肿瘤的3%[5]。我国胆管癌的发病率普遍高于世界平均水平,上海市胆道癌研究协作组1997~2001年进行的流行病学研究结果显示,上海35~74岁市民胆管癌的发病率为0.58/10万人,低于泰国的96.00/10万人,高于澳大利亚的0.20/10万人[6]。胆管癌发病隐匿,恶性程度高,晚期胆管癌的5年生存率为5%~15%[1]。手术治疗是胆管癌的首选方案,但手术治疗切除率较低,且胆管癌高度促结缔组织增生的能力、多样的肿瘤微环境及高度的异质性决定了其易对化疗药物产生耐药性[1],目前尚无针对胆管癌十分有效的靶向治疗药物,因此深入研究胆管癌的发病机制,从而更为有效地治疗胆管癌,提高患者预后是目前研究的重中之重。
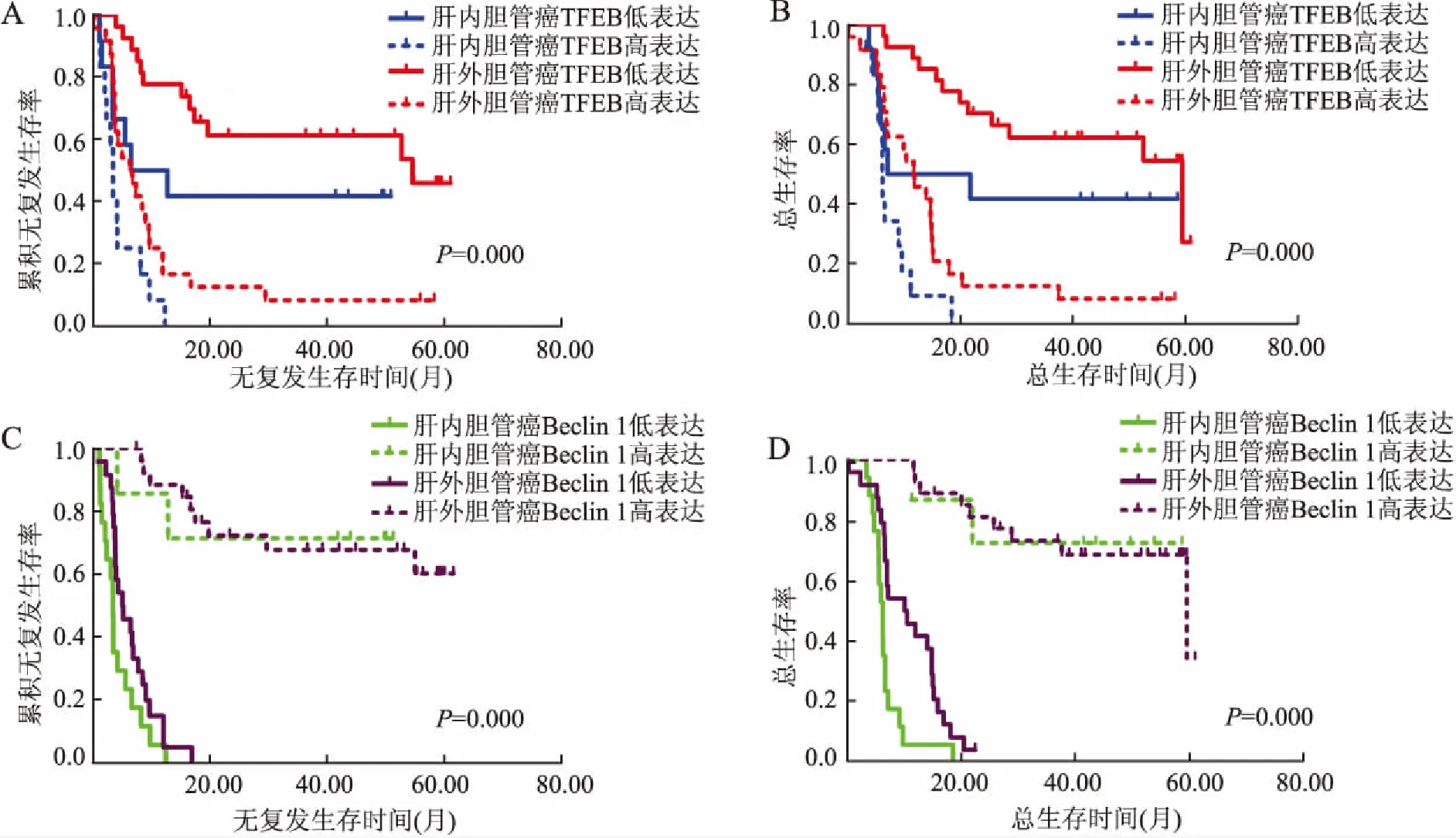
图2 胆管癌中TFEB及Beclin 1与患者无复发生存期和总生存期的关系:A.TFEB表达与无复发生存期的关系;B.TFEB表达与总生存期的关系;C.Beclin 1表达与无复发生存期的关系;D.Beclin 1表达与总生存期的关系

表2 胆管癌患者术后无复发生存期及总生存期的单因素分析
自噬是细胞在各种代谢压力下(如能量缺乏、饥饿等)的一种促使胞内代谢废物降解的生物学行为,是真核细胞进行自我消化从而获得存活机会的一种高度保守生物学过程。研究证实,自噬在胆管癌的发生、发展、血管生成、转移、复发、耐药等方面有着重要影响,在胆管癌发展的最初阶段表现为自噬的抑制,而在肿瘤发展及侵袭的过程中自噬标记的蛋白表达增加[7]。在过去几十年,自噬的研究主要集中在其起始阶段,近年来的研究逐渐集中在溶酶体(lysosome)上。TFEB蛋白属于基本螺旋环螺旋亮氨酸拉链(basic helix-loop-helix-leucine-zipper, bHLH-LZ)类转录因子中MiT家族成员,通过调控溶酶体途径及细胞自噬在不少肿瘤的发生、发展过程中发挥了重要的作用[8]。TFEB入核后,主要通过两种分子作用机制发挥自噬转录调控作用:(1)通过转录激活多种自噬相关分子的表达,使细胞自噬活性增强;(2)通过结合靶分子的E-box结合元件,转录激活溶酶体通路相关分子,尤其是溶酶体膜蛋白1(lysosomal-associated membrane protein 1, LAMP 1)的表达,促进溶酶体外排。这种机制能够显著增强溶酶体的合成与外排,被称为协同溶酶体表达与调控网络(coordinated lysosomal expression and regulation network, CLEAR network)[9]。许多研究提示,肿瘤发生过程中TFEB的表达和活性会发生改变,如肾细胞癌、胰腺导管细胞癌、恶性胶质瘤、黑色素瘤、肺小细胞癌及乳腺癌等[10-11]。那么TFEB在胆管癌发病过程中扮演着何种角色?是否参与了胆管癌细胞自噬的调节,与胆管癌的病程发展及侵袭性、复发等生物学行为关系如何?至今国内外尚未见相关研究报道。本实验结果表明,与癌旁正常组织相比,肝内、外胆管癌的TFEB均出现过表达。且胆管癌中TFEB高表达与肿瘤的恶性进展和患者的预后不良有关。TFEB高表达组患者的无复发生存期及中位总生存期低于低表达组,且在TFEB高表达组中,淋巴结转移及血管侵犯更多见。这与Liang等[12]在结肠癌的发现一致,敲除结直肠癌细胞的TFEB基因能阻止肿瘤细胞的增殖和扩散。这可能与沉默TFEB后,肿瘤细胞相互间黏附能力增强,而侵袭力降低有关[13]。

表3 肝内胆管癌患者术后无复发生存期及总生存期的多因素分析
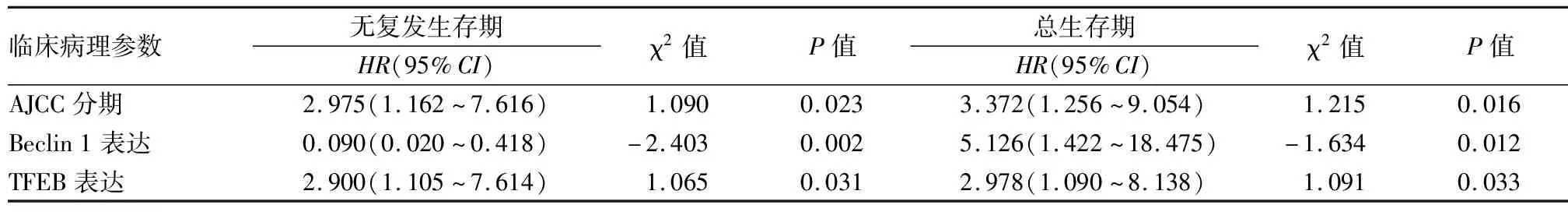
表4 肝外胆管癌患者术后无复发生存期及总生存期的多因素分析
在已发现的自噬相关蛋白中,Beclin 1是目前发现的哺乳动物中参与自噬的特异性基因,其在自噬泡形成过程中起重要作用。Sasaki等[14]研究发现,与非肿瘤性大胆管上皮细胞相比,胆管上皮内瘤变、胆管内乳头状瘤等系列癌前病变及胆管浸润性癌细胞中的LC3、Beclin 1及p62表达均有显著增高,提示自噬参与胆管癌的发生、发展进程。本实验在探讨胆管癌中Beclin 1与临床病理特征及预后的关系时,却呈现与前述研究相反的结果。Beclin 1高表达组的患者往往呈现小体积肿瘤、无淋巴结转移及血管侵犯、低级别的AJCC分期等,提示Beclin 1高表达组患者有更长的生存期及无复发生存期,这与Dong等[15-16]的研究结果相一致。提示Beclin 1不仅可能成为胆管癌预后良好的预示指标,可能为胆管癌治疗方案的确定提供潜在的临床应用。另一方面,Zhang等[17]研究证实,Beclin 1过表达不仅可通过诱导结肠癌HCT-15和HCT-116细胞增殖下降、细胞周期紊乱、吞噬增加和凋亡来抑制结肠癌细胞的生长,而且还可减少结肠癌细胞的迁移、侵袭和片状脂膜的形成从而抑制结肠癌的侵袭和转移。本实验中Beclin 1低表达与淋巴结转移及血管侵犯具有相关性,同样提示Beclin 1表达缺失可能是肿瘤侵袭性生长及转移的危险因素。有趣的是,在Beclin 1低表达患者的分层生存分析中,肝内胆管癌患者的总体生存期和无复发生存期均少于肝外胆管癌,这可能提示自噬对肝内胆管癌这一亚群的影响更大,该亚群自噬水平的下调与较差预后相关。
本实验同时也揭示,肝内、外胆管癌中TFEB及Beclin 1的表达呈负相关,其中样本例数较多的肝外胆管癌中两者表达呈显著负相关。这提示Beclin 1低表达可能与TFEB高表达相关,TFEB通过抑制Beclin 1表达,从而调节自噬,促进肿瘤生长和转移。这两个指标相结合,可作为胆管癌的预后因素和潜在的治疗靶点。
综上所述,TFEB可能通过下调Beclin 1表达从而调控、抑制胆管癌的自噬,从而导致了胆管癌的发生、发展及不良预后。在未来的研究中,本课题组将深入探讨自噬影响胆管癌发生、发展以及胆管癌中自噬调控的具体机制,以期为胆管癌的临床治疗领域提供新的基因靶点。

