基底节区血肿定位后经颞锁孔神经内镜下血肿清除的效果分析
郑鹏锋,魏 德,廖晶威
自发性脑出血为神经外科常见病及多发病,具有高致残率、致死率特点,目前有大骨瓣开颅血肿清除术、小骨窗显微镜下血肿清除术、立体定向下血肿腔置管引流等,总体上朝微创方向发展,但国内外对于脑出血的最佳治疗方式目前仍有争议[1]。近年来笔者所在医院对于自发性基底节出血患者,采用新的定位方法定位后经颞锁孔神经内镜清除血肿取得较好临床效果,现报告如下。
1 资料与方法
1.1一般资料回顾性分析2015年5月—2019年5月笔者所在医院收治50例自发性基底节区出血患者,根据手术方式分为内镜组与传统组。传统组25例,其中男12例,女13例;年龄37~72岁,平均(51.2±1.1)岁;平均发病到手术时间(11.4±0.3) h;出血量 30~60 ml,平均(45.1±1.5) ml;GCS 评分 9~15分。内镜组25例,其中男13例,女12例;年龄36~74岁, 平均 (50.3±1.2) 岁; 平均发病到手术时间(11.5±0.2) h;出血量 30~60 ml,平均(47.2±1.0) ml;GCS评分9~15分。用专业统计软件对患者基本资料进行分析,结果差异无统计学意义。患者或其家属签署了诊疗知情同意书,手术方案通过医院伦理学委员会批准。
1.2纳入标准所有患者术前均完成颅脑CT及CTA检查,明确为自发性基底节区出血,血肿量大于30 ml,GCS评分>9分,复查颅脑CT未见血肿明显扩大。
1.3排除标准动脉瘤、动静脉畸形、肿瘤等引起出血,长期服用抗凝药物等继发性脑出血患者。排除深度昏迷、晚期脑疝形成、脑干功能衰竭患者,以及心肺功能差者、无法耐受手术者、手术意愿不强者。
1.4传统显微镜手术方法患者采取传统骨窗开颅显微镜手术方法,具体过程为:术者根据术前颅脑CT,经验性判断颅内血肿位置、大小等,从而确定手术切口。于患者头部做弧状或马蹄形切口,骨窗约4 cm×5 cm,应用显微镜下血肿清除。手术通道选择分离侧裂经岛叶或者侧裂上下方皮质非功能区切开皮质长约2 cm,逐层进入血肿腔,应用牵引器把脑组织牵离,清除血肿后以电凝凝血,于血肿腔内敷贴止血纱贴,血肿腔放置引流管,修复脑硬膜及骨瓣,逐层闭合头皮。
1.5新型内镜手术方法术前定位:根据新型定位方法(专利ZL201820627556.7)术前进行血肿定位,术前应用临床常见用物进行制作定位贴,包括无菌口罩、硅胶引流管、胶布。取引流管硅胶帽头作为标准点,无菌口罩及口罩内金属线作为底座,进行规律排列及组装成定位贴。经患者及家属知情同意后,黏附于头部,术前再次颅脑CT扫描,根据后期影像制作可精准定位出血肿位置,具体的标志物在CT检查后可显影,可直接明确血肿距离皮质最近的标志物,从而明确血肿相对应颞部的二维投影位置,精准定位血肿(图1)。进行术前手术计划,手术规划应选择血肿距离皮质最近位置,避开功能区,避开富含血管区如侧裂静脉区等(图2)。
手术过程:根据术前的手术计划,选择颞部手术切口约5 cm。切开头皮,颅骨钻1小骨孔,铣刀形成骨瓣直径约2.5 cm大小。根据距离血肿最近的位置,经侧裂或直接非功能区皮质造瘘显露血肿,对于血肿较浅,距离皮质近的病例可直接脑组织隧道下神经内镜下显微操作清除血肿,脑皮质切口及隧道一般不超过1.5 cm。在无牵拉或轻牵拉隧道中操作,避免损伤血肿周围的脑组织和血管;通过改变内镜方向,在不损伤血肿腔周围脑组织、不引起新的出血的前提下彻底清除血肿。对于血肿位置较深部位,则采用套筒作为工作通道,在套筒中清除血肿。对于活动性出血,适当进行隧道牵拉,可充分暴露出血动脉,予以双极或单极电凝止血;对于静脉血性渗血,予适当明胶及棉片压迫止血;彻底止血且确认脑压不高,脑搏动良好后,缝合硬脑膜,骨瓣复位,无须放置引流管。
1.6观察指标术后两组病例药物治疗相同,主要为控制血压、脱水药物降颅内压等。术后1 d常规复查颅脑CT,对比术前术后影像片,评估残余血肿体积。血肿量计算采用多田公式,血肿清除率为(术前血肿-术后血肿量)/术前血肿量×100%。对比两组手术方式的手术情况,包括总手术时间、血肿清除时间,术中出血量,血肿清除率。比较两组预后情况,包括患者住院天数,术后并发症情况主要为新发感染发生情况(如术后颅内感染、其他系统器官感染情况)以及采用GOS预后评分评估6个月预后情况,GOS评分<4分为预后不良,GOS评分4分及以上为预后良好。
1.7统计学方法利用SPSS 19.0统计学软件对该次治疗结果进行分析,计量资料以(±s)表示,组间比较采用t检验;计数资料以(%)表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1两组患者手术指标比较内镜组患者总手术时间、血肿清除时间、术中出血量少于传统组,血肿清除率高于传统组(P<0.05)。 见表 1。
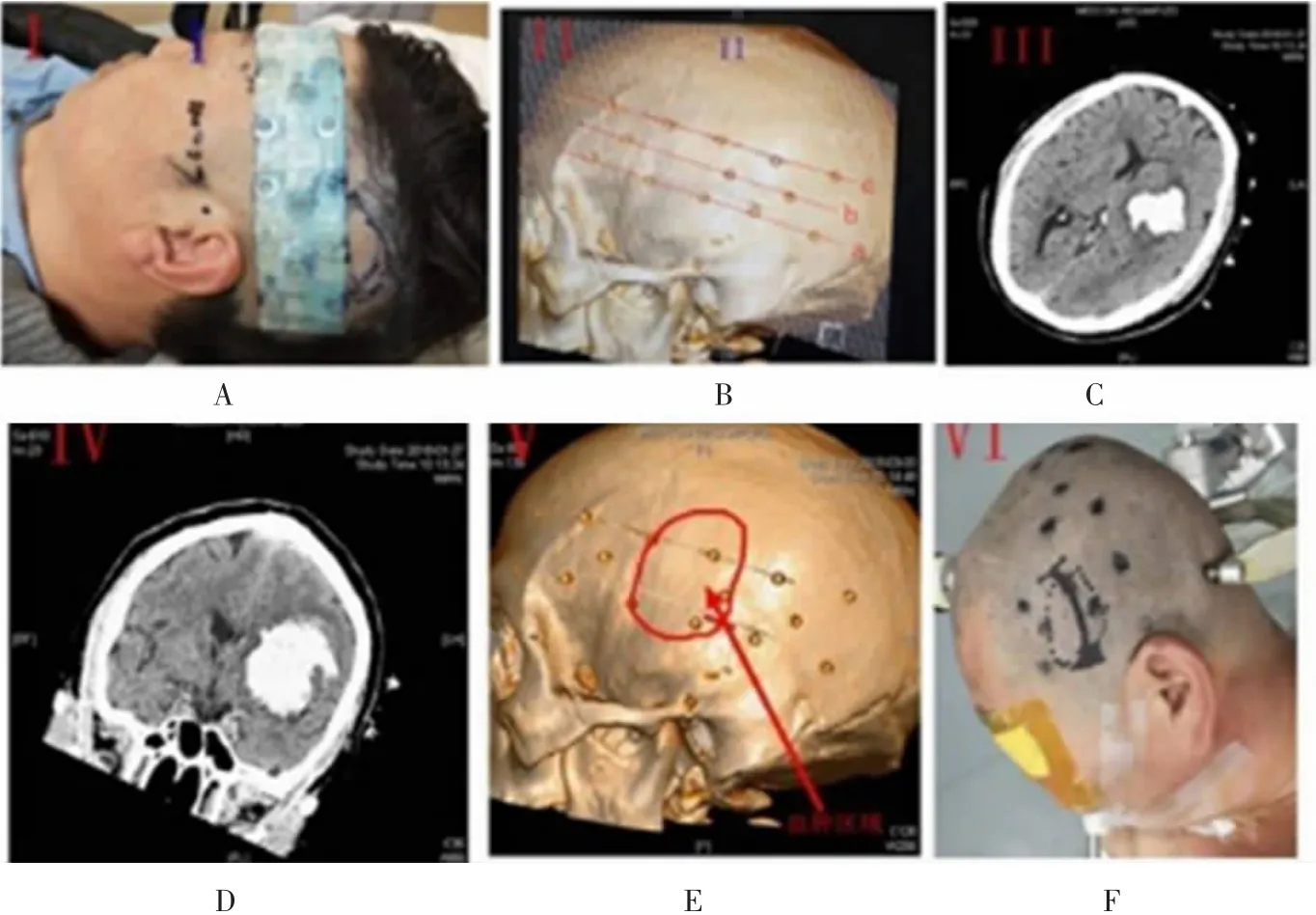
图1 术前血肿定位及手术计划
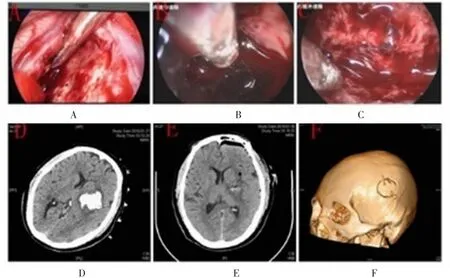
图2 内镜血肿清除
表1 内镜组与传统组手术指标比较(±s)
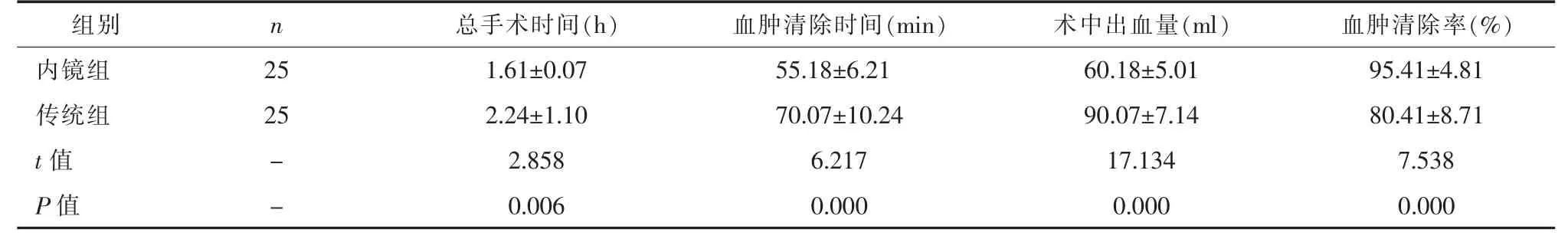
表1 内镜组与传统组手术指标比较(±s)
组别 n 总手术时间(h) 血肿清除时间(min) 术中出血量(ml) 血肿清除率(%)内镜组 25 1.61±0.07 55.18±6.21 60.18±5.01 95.41±4.81传统组 25 2.24±1.10 70.07±10.24 90.07±7.14 80.41±8.71 t 值 - 2.858 6.217 17.134 7.538 P 值 - 0.006 0.000 0.000 0.000
2.2两组预后情况比较术后并发症主要为感染,内镜组患者有2例(8%)发生感染,均为肺部感染,而传统组则有6例(24%)发生感染,其中肺部感染5例,颅内感染1例。内镜组平均住院天数为(10.01±1.20) d,明显低于传统组(15.12±1.02) d,差异具有统计学意义。两组患者在6个月GOS预后评分上,内镜组16例预后良好(64%),传统组为14例(56%),两组比较差异无统计学意义(P=0.773)。
3 讨论
脑出血的外科治疗主要是通过手术清除血肿起到降低颅内压,解除血肿对脑组织的压迫,减轻血肿液化后继发的毒性反应及周围脑组织水肿[2]。目前被广泛采用的方案为小骨窗下显微镜血肿清除术,但随着医疗设备以及微创理念的进步,神经内镜下清除血肿以其疗效显著并且创伤更小而越来越受到重视[3]。该组25例采用精准定位后经颞锁孔神经内镜下清除血肿,不仅在皮瓣、骨窗暴露上更微创,同时在血肿清除率、手术时间、并发症发生率、住院时间等方面上同样也更优于采用传统显微镜下清除血肿的病例,与ZHANG等报道一致[4]。
微创手术的基础在于血肿的准确定位,而该研究的创新点之一就在于术前的精准定位。目前临床上广泛采用的血肿定位方法为阅读颅脑CT片后根据术者经验来判断血肿位置。这种传统方法的不足之处在于,不能肯定血肿的确切位置,术中常发生手术路径偏离血肿主体,在探查血肿过程多次改变或扩大手术路径,从而加大对脑组织损伤、术中出血增多,同时也延长手术时间。为解决血肿定位问题,有采用头皮粘附物体进行CT下定位的方法,但因过于简易单一,仍难以精准定位;为精准定位脑血肿位置,目前主要采用神经导航、立体定向等手段[5],但因设备昂贵、术前定位步骤烦琐等因素,而难以在各级别医院普及应用。同时近些年也有一些新型的定位方法被研发及应用如采用3D-Slicer联合Sina软件、简易虚拟现实和增强现实定位等[6-8],但终究需要应用一些特殊软件以及术前的影像处理相对复杂,目前仍难以广泛应用。为解决上述问题,笔者对该组25例患者采取自主研发的新型定位方法,应用自己制作的体表标志物粘附于患者头部经过CT扫描后,进行后期影像处理,可精准定位脑血肿在颅内的位置;通过术前的影像处理进行术前手术计划,手术切口设计避开功能区,选择合适的手术切口。该定位方法,因采用临床中常用物品,容易制作;术前只需要简单影像处理,即可获得血肿的三维位置,故该方法经济、简易且定位准确适合推广。
对于基底节区血肿手术,目前流行的神经内镜手术采取的方法为应用套筒作为工作通道经额入路[12],而本组内镜组病例采用经颞部入路。因基底节区血肿其距离体表的最近投射位置为颞部,故该组病例采用经颞部锁孔手术方案。该组25例内镜手术病例术前均采用新型定位方法,术中严格采用术前计划,术中快速准确找到血肿位置。对于基底节区血肿位置较深病例,可采用套筒作为工作通道;但对于血肿较为表浅的病例可不需采用套筒作为通道,在血肿距离皮质最近的位置直接造瘘,对血肿清除同样取得较为满意的效果。无套筒通道的限制,通过改变内镜方向,可清除各方向血肿死角,特别对于基底节区血肿形态不规则病例,血肿清除更彻底。
该研究中传统显微镜手术病例组,因照明的限制,存在视觉盲区,有时无法准确判断出血位置,盲目止血过程导致对正常脑组织的医源性损伤;术中有时为更充分暴露血肿需反复改变显微镜或患者体位,导致术中血肿清除时间更长。而内镜优势在于具有良好的照明和广泛的视野,可清晰辨别血肿与脑组织界限,对于是否有动脉活动性出血以及血肿的残留情况判断更准确,因此血肿清除更彻底,对于正常脑组织的损伤更小。另外内镜组病例术前精准定位后,设计骨窗更准确、更小,暴露的皮瓣、骨瓣及脑皮质少;术中探查血肿方向明确,可迅速找到血肿位置,减少医源性脑损伤。该组内镜下血肿清除术患者血肿的清除率更高、对正常脑组织的损伤更小,术后患者的肺部感染、颅内感染等并发症更少,患者住院时间明显缩短。

