气虚血瘀证缺血中风大鼠肠道菌群对补阳还五汤有效成分的吸收影响研究
吴万丰 程诚 聂慧芳 孙艺航 罗宁 蒋成婷 成绍武 葛金文

〔摘要〕 目的 探讨补阳还五汤在气虚血瘀证缺血中风大鼠肠道微生态环境下药物成分的吸收。方法 采用力竭游泳法联合线栓法建立气虚血瘀证缺血中风大鼠模型,模型组与假手术组大鼠同时于术后1 h、24 h及48 h灌胃补阳还五汤,两组大鼠均于术后72 h取盲肠粪便行16S rRNA基因测序检测肠道菌群,采集分离血浆后运用液相色谱-质谱联用的非靶向代谢组学方法检测血浆代谢物,对肠道菌群及血浆代谢产物进行组间差异分析及关联分析。结果 两组大鼠肠道菌群组成结构及血浆代谢轮廓存在明显差异,与假手术组比较,缺血中风气虚血瘀证大鼠中甜菜碱、α-紫罗兰酮、甲基没食子酸-O-硫酸盐、阿拉伯糖、棕榈酸、紫花前胡醇显著上调(P<0.05),阿糖腺苷、3-O-甲基没食子酸显著下调(P<0.05)。除3-O-甲基没食子酸外,上述其他7种药物成分的组间差异均与肠道菌群有相关性。结论 气虚血瘀证缺血中风大鼠肠道菌群差异影响补阳还五汤药物成分在肠道的吸收。
〔关键词〕 缺血中风;气虚血瘀证;补阳还五汤;肠道菌群;代谢产物
〔中图分类号〕R285.5;R255.2 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2020.06.005
〔Abstract〕 Objective To explore the absorption of drug components of Buyang Huanwu Decoction under the intestinal micro-ecological environment of rats with ischemic stroke of Qi deficiency and blood stasis syndrome. Methods We established the rat models of Qi deficiency and blood stasis syndrome of ischemic stroke by exhausting swimming method combined with thread embolism. The model group and the sham operation group were gavaged with Buyang Huanwu Decoction at 1 h, 24 h and 48 h after operation. After 72 hours, cecal feces samples were taken for 16S rRNA gene sequencing. After collection and separation of plasma, non-targeted metabolomics of liquid chromatography-mass spectrometry was used to detect plasma metabolites. Difference analysis and correlation analysis of intestinal flora and plasma metabolites were performed. Results There were significant differences between the 2 groups in the gut microbiota composition structure and the plasma metabolic profiles. Betaine, α-ionone, methyl gallic acid-O-sulfate, arabinose, palmitic acid, decursinol in rat models of Qi deficiency and blood stasis syndrome of ischemic stroke were significantly up-regulated(P<0.05), and vidarabine, 3-O-methyl gallic acid were significantly down-regulated(P<0.05). In addition to 3-o-methyl gallic acid, the differences of other 7 drug components were correlated with gut microbiota. Conclusion The difference of gut microbiota in rats with Qi deficiency and blood stasis syndrome of ischemic stroke affected absorption of Buyang Huanwu Decoction in intestinal tract.
〔Keywords〕 ischemic stroke; Qi deficiency and blood stasis syndrome; Buyang Huanwu Decoction; gut microbiota; metabolites
人體胃肠道寄生着大量的微生物,菌群种类达到1 000多种,在维持人体正常生理中发挥着重要的作用[1-2]。肠道菌群参与机体物质代谢,如饮食中的多糖、胆汁酸的代谢及维生素、氨基酸的合成[3-4];肠道菌群中含有部分药物代谢酶,参与许多中西药成分的转化代谢[5];肠道菌群参与肠黏膜屏障的形成及维持[6],影响药物的吸收。
课题组前期研究发现,气虚血瘀证缺血中风组与气滞血瘀证缺血中风组、大脑中动脉栓塞(middle cerebral artery occlusion, MCAO)组及假手术组大鼠之间有着不同的肠道菌群组成,提示肠道菌群可能参与气虚血瘀证缺血中风证候的形成,那么肠道菌群是否参与补阳还五汤药物成分的代谢吸收?本文通过建立具有不同肠道微生态环境的大鼠模型,灌胃补阳还五汤干预72 h后,采用16S rRNA基因测序检测肠道菌群联合超高效液相色谱-质谱(UPLC-MS)检测血浆代谢产物的方法,探讨肠道菌群对补阳还五汤代谢及吸收的影响,现报道如下。
1 材料
1.1 实验动物
7~9周龄SD雄性大鼠,SPF级,体质量240~270 g,购自湖南斯莱克景达实验动物有限公司,动物许可证号:SCXK(湘)2016-0002。动物饲养于湖南中医药大学附属第一医院动物实验中心,动物许可证号:SYXK(湘)2015-0003,湿度45%~65%,室温25 ℃,自由饮水,摄食。
1.2 药品
补阳还五汤出自《医林改错》,处方组成为:黄芪120 g,当归尾6 g,赤芍4.5 g,地龙3 g,川芎3 g,桃仁3 g,红花3 g。饮片购自湖南中医药大学第一附属医院。
1.3 主要试剂与仪器
MCAO栓线-2634A4(北京西浓科技有限公司,中国);E.Z.N.A粪便DNA提取试剂盒(安诺伦生物科技有限公司,美国)。QuantiFluorTM荧光计(普洛麦格生物技术有限公司,美国);Hiseq2500 PE250测序系统(Illumina公司,美国);超高效液相1290 UHPLC(安捷伦科技有限公司,美国);高分辨质谱Triple TOF 5600(美国应用生物系统公司,美国)。
2 方法
2.1 药品制备
将补阳还五汤处方饮片混合,用3倍体积蒸馏水先浸泡2 h,武火煮沸0.5 h,文火慢煎1 h,然后过滤收集滤液,按上述步骤再次提取滤液1次,将两次滤液混合后采用旋转蒸发器浓缩中药水提液,最终药物生药浓度为2 g/mL。
2.2 气虚血瘀证缺血中风大鼠模型制备
参照张锦等[7]研究方法,将大鼠按4.0%±0.5%质量负重后放进内径150 cm、水深40 cm的圆形游泳池,水温控制在(20±1) ℃,强迫其不停游泳直至力竭后捞出,力竭指征为游泳动作失调、水淹没鼻尖、身体下沉超过10 s不能浮出水面。先适应性游泳训练3 d,然后每天力竭性游泳1次,持续21 d,于实验第22天采用改良的线栓法制备大鼠MCAO模型[8],阻塞右侧大脑中动脉,大鼠手术麻醉清醒后出现左侧肢体瘫痪,站立不稳,提尾时向一侧转圈为模型成功的判断标准。最终制备气虚血瘀证缺血中风大鼠模型。大鼠脑缺血期间保持体温在(37.0±0.5) ℃。
假手术组大鼠不予游泳,常规饲养,与气虚血瘀证缺血中风大鼠于同日按照改良线栓法制作MCAO模型的方法分离血管,但不插入栓线,然后缝合。
2.3 动物分组干预及标本采集处理
将大鼠分为假手术组(sham operation group, SOG)和气虚血瘀证缺血中风组(Qi deficiency and blood stasis syndrome of ischemic stroke group,QDBSG),两组大鼠分别为8只和12只。QDBSG大鼠手术苏醒后经神经行为学评分确定模型成功后与SOG大鼠同时开始给予补阳还五汤灌胃,给药时间点分别为术后1 h、24 h及48 h,给药剂量为12 mL/kg(按体表面积计算,相当人临床等效剂量的2倍,12.87 g/kg)。所有大鼠于手术后72 h用水合氯醛35 mg/kg腹腔麻醉,用5 mL肝素钠抗凝管腹主动脉采血,立即3 000 r/min离心15 min分离血浆,1.5 mL EP管留存血浆于-80 ℃冰箱保存;用15 mL灭菌离心管收取盲肠内容物储存于-80 ℃冰箱。上述标本均用干冰填埋转运至广州基迪奥生物科技有限公司分别检测血浆代谢产物及肠道菌群。
2.4 16S rRNA基因测序
按E.Z.N.A粪便DNA试剂盒说明的步骤从两组每只大鼠的盲肠内容物中分别提取总DNA,用带有barcode的特异引物(341F:5'-CCTAYGGGRBGCASCAG-3';806R:5'-GGACTACNNGGGTATCTAAT-3')和Phanta Max Super-Fidelity DNA Polymerase试剂盒(Vazyme Biotech Co., Ltd)扩增 DNA 样本中16S rDNA的V3-V4区。进行两轮PCR扩增,第一轮PCR以总DNA为模板,扩增条件为:94 ℃预变性2 min,接着98 ℃10 s、62 ℃30 s、68 ℃30 s30个循环,最后68 ℃延伸5 min。将第一轮扩增的产物纯化后进行第二轮PCR反应,反应条件为94 ℃预变性2 min,接着98 ℃10 s、65 ℃ 30 s、68 ℃ 30 s15个循环,最后68 ℃延伸5 min。PCR扩增产物切胶回收后从2%琼脂糖凝胶中提取并纯化,用QuantiFluorTM荧光计进行定量。将纯化的扩增产物进行等量混合,连接测序接头,构建测序文库,Hiseq2500 PE250上机测序。
2.5 UPLC-MS检测代谢产物
从每只大鼠血浆样本中取100 μL,加入400 μL含有内标(L-2-氯苯丙氨酸)的提取液(甲醇乙腈体积比=1∶1,内标浓度1 mg/mL),涡旋混匀30 s,超声5 min(冰水浴),-20 ℃靜置1 h,将样本于4 ℃、12 000 r/min离心15 min,小心地取出425 μL上清于 EP 管中,在真空浓缩器中干燥提取物,向干燥后的代谢物加入100 μL提取液(乙腈水体积比=1∶1)复溶,涡旋30 s,冰水浴超声10 min,将样本于4 ℃、12 000 r/min离心15 min,小心地取出60 μL上清液于2 mL进样瓶,每个样本各取10 μL混合成质控样本,再取60 μL上机进行UPLC-MS代谢组学分析。
色谱柱为UPLC HSS T3(2.1 mm×200 mm,1.7 μm),进样体积为3 μL,流动相A为水(含有25 mmol/L的醋酸铵及25 mmol/L的氨水),流动相B为乙腈。梯度洗脱程序:0~7 min,95%B;7~8 min,65%B;8~9.1 min,40%B;9.1~12 min,95%B。流速500 μL/min。
质谱条件:AB 6600 Triple TOF质谱仪在控制软件(Analyst TF 1.7, AB Sciex)控制下基于IDA功能进行一级、二级质谱数据采集。在每个数据采集循环中,筛选出强度最强且大于100的分子离子进行采集对应的二级质谱数据。轰击能量:30 eV,每50 ms采集15张二级谱图。ESI离子源参数设置如下:雾化气压(GS1):60 Psi,辅助气压:60 Psi,气帘气压:35 Psi,温度:650 ℃,喷雾电压:5 000 V(正离子模式)或-4000 V(负离子模式)。
2.6 16S rRNA基因测序生物信息学分析
测序得到raw reads之后,对低质量reads进行过滤,然后进行组装和过滤,使用Uparse(usearch v9.2.64)软件按照一致性>97%将测序序列聚类成为分类操作单元(operational taxonomic units, OTUs),依次用RDP Classifier(version 2.2),与Greengene或SLIVA数据库进行物种注释(设定置信度的阈值为 0.8~1),用QIIME软件计算样本α多样性指标及β多样性指标,采用t检验进行两两比较分析组间差异,P<0.05提示有统计学意义。
2.7 非靶向代谢组学数据分析
使用ProteinWizard软件将质谱原始数据转成mzXML格式,使用XCMS做保留时间矫正、峰识别、峰提取、峰积分、峰对齐等工作。根据公共数据库与软件自建二级质谱数据库对代谢物进行定性;利用归一化后的数据矩阵进行多元统计分析(PCA分析、PLS-DA分析、OPLS-DA分析);利用多元统计分析OPLS-DA和单变量统计分析相结合的方法筛选差异代谢物。
2.8 肠道菌群与血浆代谢产物相关性分析
为了整合肠道微生物群和代谢组学数据,进行O2PLS分析。利用代谢物丰度数据集和微生物区系各分类水平的数据集(包括门级和属级),建立O2PLS模型。计算O2PLS模型,利用R语言中OmicsPLS包开展O2PLS分析。为了探索微生物群与代谢组学之间的关系,用R语言(3.5.1版)计算微生物群在门和属水平与代谢组学数据集之间的Pearson相关系数。在R语言中使用Pheatmap生成相关热图,用Igraph进行网络分析。
3 结果
3.1 两组大鼠灌胃补阳还五汤后肠道菌群差异比较
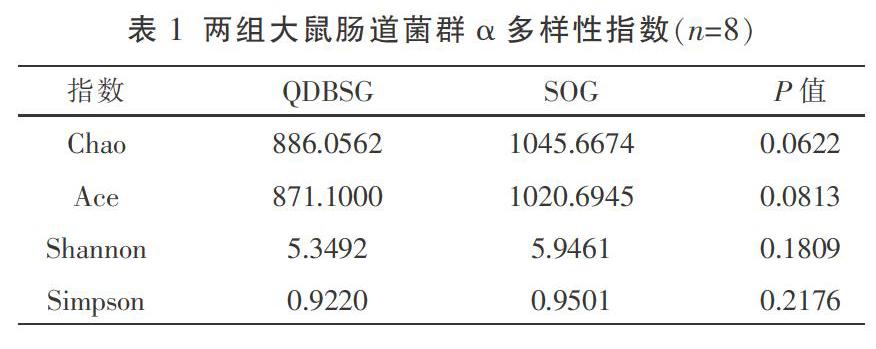
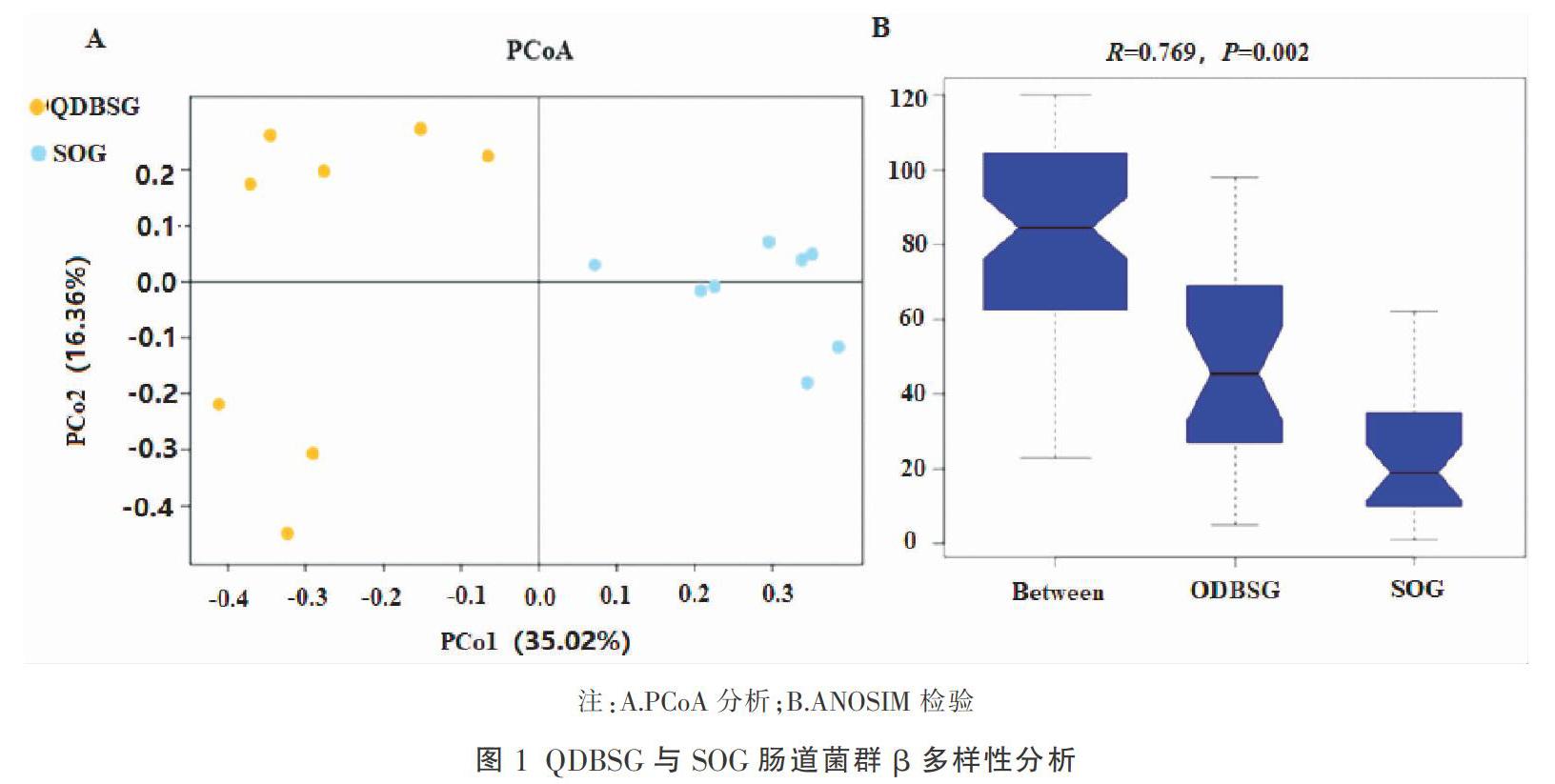
3.1.1 肠道菌群多样性差异分析 QDBSG大鼠术后72 h内死亡4只,有效取材每组各8只,死亡原因考虑为大脑中动脉阻塞后大面积脑梗死相关,SOG无大鼠死亡,有效取材8只。对QDBSG及SOG大鼠进行肠道菌群α多样性分析,结果显示:两组间Chao、Ace、Shannon、Simpson指数均无显著性差异(表1),提示两组肠道菌群物种丰富度及均匀度无统计学差异(P>0.05)。进一步进行β多样性分析,在OTU水平上基于Bray-Curtis距离开展PCoA主坐标分析,并经T检验发现两组肠道菌群群落组成有显著性差异(图1-A,P=0.000 2),ANOSIM检验进一步证实两组间样本组间差异显著大于组内差异(图1-B,Bray-Curtis,R=0.769,P=0.002)。
3.1.2 肠道菌群组成结构差异分析 在肠道菌群属分类水平进行了差异物种分析,物种分类堆叠图可见两组物种丰度存在差异(图2-A),经Welchs T检验证实两组间有20个菌属存在显著性差异(P<0.05),与SOG比较,QDBSG有10个菌属丰度显著升高,10个菌属丰度显著降低,QDBSG中Bacteroides、Alloprevotella、Parabacteroides、Phascolarctobacterium、Butyricimonas等菌属丰度显著升高,而Lactobacillus、Helicobacter、Tyzzerella、Lachnospiraceae_NK4A136_group、Ruminiclostridium_9等菌属丰度显著降低(图2-B)。综上可见,两组大鼠灌胃补阳还五汤后肠道菌群组成存在显著性差异。
3.2 两组大鼠补阳还五汤相关血浆代谢产物存在差异
利用正交最小偏二乘判别分析(OPLS-DA)方法分析代谢组学数据,发现在正离子模式(positive ionmode,POS)和负离子模式(negative ion mode,NEG)两种电离模式下,QDBSG与SOG大鼠经补阳还五汤干预后血浆代谢轮廓存在很大差异,交叉验证证实模型稳定可靠,无过度拟合(正离子模式:R2Y=0.925,Q2Y=0.778;负例子模式:R2Y=0.968,Q2Y=0.857)。差异代谢物聚类热图直观地显示出两组正、负离子模式下的代谢产物的聚类差异(图3-A、3-B)。
结合多元統计分析OPLS-DA的VIP值和单变量统计分析t检验P值来筛选不同比较组间的显著差异代谢物,显著差异的阈值为:VIP≥1且T-test P<0.05[9]。在POS和NEG模式下分别检测到154和151个明显失调的代谢物。与SOG比较,QDBSG大鼠POS模式下有64个代谢产物上调,90个代谢产物下调,NEG模式下有77种代谢产物上调,74种代谢产物下调。这些失调的代谢产物中,将已经被鉴定出的代谢产物与上海有机所中药和化学成分数据库中补阳还五汤组成药物的有效成分进行比对,发现8种中药代谢成分存在着显著性差异(表2)。综上可见,补阳还五汤药物成分的吸收在QDBSG与SOG大鼠之间存在明显差异。
3.3 補阳还五汤差异血浆代谢物与肠道菌群相关
为了明确不同处理组之间补阳还五汤血浆代谢物差异与肠道菌群之间的关系,利用O2PLS模型关联分析肠道菌群与血浆代谢产物之间的相关性。通过计算皮尔逊相关系数(cor)得到相关矩阵,发现上述补阳还五汤相关的血浆代谢产物中有7个代谢物与肠道菌群之间存在显著相关性(cor>0.5或cor<-0.5,P<0.05),见表3,提示不同肠道微生态环境中补阳还五汤药物成分的吸收存在着差异,肠道菌群参与补阳还五汤药物在肠道的吸收。
4 讨论
中药与肠道菌群之间的作用是相互的,中药可以引起肠道微生物群落结构的改变,肠道微生物可以通过多个途径影响药物的代谢及吸收[10-11],主要表现为促进其人体吸收、增强药物疗效及参与毒性成分转化等方面。中药中有许多成分无法被胃肠道直接吸收利用,或者口服利用度低下,如多糖、皂苷类、多酚类等,而肠道菌群可参与其转化代谢,促进其吸收,提高生物利用度,如人参皂苷在肠道菌群作用下转化生成化合物K,从而更好的被吸收入血,并表现出更有效的药理作用[12]。Eu-bacterium菌能够将无致泻作用的芦荟大黄素苷代谢为aloe-emodin-9-anthrone,后者有显著的致泻作用[13]。Bacteroidetes的β-葡糖苷酶能将苦杏仁苷转化为氢氰酸,从而可能引起毒性反应[14]。
肠道菌群也参与补阳还五汤的代谢。叶肖栗等[15]通过HPLC法发现肠道菌群对补阳还五汤的4个主要成分具有较强的代谢作用,在菌群作用下毛蕊异黄酮苷和刺芒柄花苷迅速脱糖而成为苷元,造成2个苷元含量的迅速升高,苷元的含量在短时间内达到最大值后开始慢慢下降,证明菌群对苷元也具有较强的代谢能力。Ruina Zhou等[16]也证实黄芪甲苷经大鼠肠道菌群代谢,在体内转化为皂苷元及皂苷元异构体。药菌共孵育方法证实没食子酸在大鼠肠道细菌各种酶的作用下发生脱羧和甲基化反应[17]。但补阳还五汤作为用于治疗缺血中风气虚血瘀证的代表方,其在缺血中风气虚血瘀证特定的肠道微生态环境下的代谢及吸收情况如何,其肠道菌群的差异是否是辨证使用补阳还五汤的生物学基础之一,均有待于进一步研究。
本研究表明,缺血中风气虚血瘀证大鼠与假手术组大鼠经补阳还五汤干预后两组间肠道菌群组成结构存在显著性差异,证实两组间存在肠道微生态的差异。通过代谢组学检测两组血浆代谢产物,发现两组间血浆代谢产物存在明显差异,尤其是8种补阳还五汤代谢产物血浆中浓度两组间存在明显差异,其中缺血中风气虚血瘀证大鼠中甜菜碱、α-紫罗兰酮、甲基没食子酸-O-硫酸盐、阿拉伯糖、棕榈酸、紫花前胡醇显著上调,阿糖腺苷、3-O-甲基没食子酸显著下调,并经相关性分析发现其中7种与属分类水平肠道菌群存在着显著的相关性。已有的研究证实,缺血中风气虚血瘀证大鼠组上调的甜菜碱(POS972)在多种疾病中具有抗炎作用,可以改善硫氨基酸代谢与氧化应激,抑制Nuclear factor-κB活动和NLRP3 inflammasome的激活,调节能量代谢,减轻内质网应激和细胞凋亡[18];当归中的有效成分紫花前胡醇(NEG3499)则通过调节生长因子等显示出潜在的抗炎活性[19];而下调的甲基没食子酸则有促氧化作用,导致DNA损伤,增加细胞内活性氧的水平,诱导神经元细胞的细胞毒性[20]。
本文实验结果提示,缺血中风气虚血瘀证大鼠肠道菌群差异导致补阳还五汤在肠道的吸收存在差异,部分具有抗炎、抗氧化应激作用的药物成分表达吸收增加,而具有促炎作用的物质表达吸收减少,从而可能更好地起到脑保护作用,这种差异可能是其辨证用药的基础。但由于运用UPLC-MS的非靶向代谢组学的方法鉴定的化合物分子量较小(<1 000 Da),且质谱数据库不全,大部分代谢物无法定性,导致很多补阳还五汤相关代谢产物无法鉴定而遗漏,还有待进一步研究。
参考文献
[1] NICHOLSON J K, HOLMES E, WILSON I D. Gut microorganisms,mammalian metabolism and personalized health care[J]. Nature Reviews Microbiology, 2005, 3(5): 431-438.
[2] MARCHESI J R, ADAMS D H, FAVA F, et al. The gut microbiota and host health: a new clinical frontier[J]. Gut, 2016, 65(2): 330-339.
[3] LEBLANC J G, MILANI C, DE GIORI G S, et al. Bacteria as vitamin suppliers to their host: a gut microbiota perspective[J]. Current Opinion in Biotechnology, 2013, 24(2): 160-168.
[4] MARDINOGLU A, SHOAIE S, BERGENTALL M, et al. The gutmicrobiota modulates host amino acid and glutathione metabolism in mice[J]. Molecular Systems Biology, 2015, 11(10): 834-848.
[5] ZU X, LIN Z, XIE H, et al. Interaction of effective ingredients from traditional Chinese medicines with intestinal microbiota[J]. China Journal of Chinese Materia Medica, 2016,41(10): 1766-1772.
[6] ZHANG K, HORNEF M W, DUPONT A. The intestinal epithelium as guardian of gut barrier integrity[J]. Cellular Microbiology, 2015, 17(11): 1561-1569.
[7] 张 锦,张允岭,李 秀,等.缺血性脑卒中气虚血瘀证大鼠模型的研究[J].北京中医药大学学报,2008,31(9):590-593.
[8] 廖 君.基于铁代谢失调探讨脑缺血损伤新机制及益气活血法的干预作用[D].长沙:湖南中医药大学,2014.
[9] SACCENTI E, HOEFSLOOT H C, SMILDE A K, et al. Reflections on univariate and multivariate analysis of metabolomics data[J]. Metabolomics, 2014, 10(3): 361-374.
[10] 李寒冰,吴宿慧,张颜语,等.中药与肠道菌相互作用研究进展[J]. 中成药,2016,38(1):147-51.
[11] 陈玉艳,王 荣,张娟红,等.肠道菌群对药物代谢影响的研究进展[J].中国药理学通报,2019,35(2):25-29.
[12] KIM D-H. Gut microbiota-mediated pharmacokinetics of ginseng saponins[J]. Journal of Ginseng Research, 2018, 42(3): 255-263.
[13] HATTORI M, NAMBA T, AKAO T, et al. Metabolism of sennosides by human intestinal bacteria[J]. Pharmacology, 1988, 36(1): 172-179.
[14] JASWAL V, PALANIVELU J, RAMALINGAM C. Effects of the gut microbiota on amygdalin and its use as an anti-cancer therapy: substantial review on the key components involved in altering dose efficacy and toxicity[J]. Biochemistry and Biophysics Reports, 2018, 14:125-132.
[15] 叶肖栗,叶伟峰,张继业,等.HPLC法测定补阳还五汤中主要成分及其代谢研究[J].药物分析杂志,2016(5):765-775.
[16] ZHOU R N, SONG Y L, RUAN J Q, et al. Pharmacokinetic evidence on the contribution of intestinal bacterial conversion to beneficial effects of astragaloside IV, a marker compound of astragali radix, in traditional oral use of the herb[J]. Drug Metab Pharmacokinet, 2012, 27(6): 586-597.
[17] 羅 媛,杨 武,孙慧园,等.没食子酸和原儿茶酸在大鼠肠道菌群中的代谢研究[J].沈阳药科大学学报,2017,34(1):43-47.
[18] ZHAO G, HE F, WU C, et al. Betaine in inflammation: mechanistic aspects and applications[J]. Frontiers in Immunology, 2018,9:1070.
[19] SHEHZAD A, PARVEEN S, QURESHI M, et al. Decursin and decursinol angelate: molecular mechanism and therapeutic potential in inflammatory diseases[J]. Inflammation Research, 2018, 67(3): 209-218.
[20] HABTEMARIAM S. Methyl-3-O-methyl gallate and gallic acid from the leaves of Peltiphyllum peltatum: isolation and comparative antioxidant, prooxidant, and cytotoxic effects in neuronal cells[J]. Journal of Medicinal Food, 2011, 14(11): 1412-1418.

