非小细胞肺癌中GPR120、VEGF的表达及临床意义
姚 益,曾小飞,李 卫,姚中山,贾维坤
肺癌是发病率、病死率最高的恶性肿瘤,其中85%为非小细胞肺癌(non-small cell lung cancer, NSCLC)[1]。大多数肺癌患者就诊时肿瘤已发展为中晚期[2],5年生存率仅为19.7%,其术后复发和转移仍是两个最具挑战性的障碍[3]。然而,肿瘤的侵袭转移、增殖是多种抑癌基因及癌基因共同参与的病理过程[4]。本实验分析NSCLC中G蛋白偶联受体120(G-protein coupled receptor 120, GPR120)、血管内皮生长因子(vascular endothelial growth factorm, VEGF)的表达及与预后的关系,旨在寻找预测NSCLC侵袭转移及预后的分子标志物,初步探讨NSCLC的发生和浸润转移机制,有助于提前选择肺癌患者的综合治疗策略和进一步改善NSCLC患者的生存率。
1 材料与方法
1.1 临床资料(1)收集2017年6月~2019年10月成都医学院第一附属医院胸心外科行肺癌根治术的42例新鲜肺癌组织及对应的癌旁肺组织(距离肿瘤边缘>2 cm),均经病理学明确诊断。(2)另收集病理科2017年1月~2019年6月存档的85例NSCLC石蜡切块及62例对应癌旁正常肺组织。85例NSCLC中男性57例,女性28例;年龄36~79岁,平均61.9岁;肿瘤直径≥5 cm者30例,肿瘤直径<5 cm者55例;其中腺癌48例,鳞癌26例,其他类型11例;中+高分化56例,低+未分化29例;淋巴结转移阳性者32例;远处转移14例;TNM分期:Ⅰ期35例,Ⅱ期15例,Ⅲ期21例,Ⅳ期14例。随访采用查阅患者复查资料结合电话方式进行,随访时间6~36个月,随访截止时间2019年12月31日,失访者随访时间按截尾数据处理。
1.2 主要试剂总RNA提取试剂、cDNA逆转录试剂盒均购自索莱宝生物公司;Anti-GPCR GPR120抗体(ab230869)购自美国Abcam Biochemicals公司;Anti-VEGF购自武汉三鹰生物公司。
1.3 方法
1.3.1qPCR 对42例新鲜NSCLC肿瘤组织和癌旁组织样本进行qPCR分析。进行总RNA提取并进一步行qPCR分析,比较配对的两组间差异;同时绘制散点图,分析GPR120与VEGF mRNA表达的相关性。GPR120正向引物5′-TTGAACTTCTTGGT GCCAGGACTG-3′,反向引物5′-CCGTGAGCCTCTTC CTTGATGC-3′。VEGF正向引物5′-TGCAATGGAT CAAGGACCAGAGG-3′,反向引物5′-TGCAGCCAG CAAGAAGCATCAG-3′。标准化基准物为β-actin,其正向引物5′-GTGGCCGAGGACTTTGATTG-3′,反向引物5′-CCTGTAACAACGCATCTCATATT-3′。
1.3.2免疫组化 采用免疫组化SP法进行检测,一抗GPR120、VEGF的稀释浓度为1∶100。免疫组化结果判定:按阳性细胞染色强度评分:无阳性着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分;按阳性细胞所占百分比评分:阳性细胞0~20%为1分,21%~50%为2分,51%~100%为3分。两项评分结果相乘作为最终得分:<4分为低表达或不表达,而≥4分为高表达。
1.3.3Western blot检测 分别将收集的NSCLC与癌旁组织样本进行充分裂解,并采用BCA法进行总蛋白浓度的测定,将蛋白样本进行等量上样,上样量为10 μL,经聚丙烯酰胺凝胶电泳分离蛋白后,将蛋白转至PVDF膜上,以脱脂奶粉封闭1 h。而后加入一抗(1∶500),4 ℃孵育过夜,洗涤后加入二抗(1∶10 000),室温孵育1 h,洗涤后显色、定影,使用凝胶扫描成像系统(Bio-Rad公司,美国)观察。并对GPR120、VEGF蛋白与内参蛋白灰度值进行分析比较。
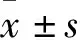
2 结果
2.1 NSCLC新鲜标本中GPR120、VEGF的表达对42例新鲜NSCLC肿瘤组织和癌旁组织行qPCR及Western blot检测GPR120、VEGF mRNA及蛋白的表达。结果表明,NSCLC中GPR120 mRNA在癌组织中和对应癌旁组织的相对表达量分别为1.82±0.58和1.32±0.58(t=5.219,P<0.001);VEGF mRNA在癌组织和对应癌旁组织中的相对表达量分别为1.73±0.43和0.95±0.35(t=8.900,P<0.000 1,图1)。NSCLC肿瘤组织GPR120蛋白条带的灰度比值(1.41±0.55)比对应癌旁组织(1.00±0.28)高(t=4.492,P<0.001);VEGF蛋白条带的灰度比值(1.58±0.76)比对应癌旁组织(1.01±0.23)高(t=4.990,P<0.001),且GPR120、VEGF蛋白表达量随着肿瘤TNM分期越晚表达具有上升趋势(图2)。NSCLC肿瘤组织中GPR120、VEGF mRNA及蛋白的表达明显高于对应癌旁组织(P<0.001)。通过散点图分析GPR120与VEGF mRNA表达的相关性结果显示,NSCLC癌组织中GPR120、VEGF mRNA表达量呈正性线性相关(r=0.738 6,P<0.000 1),即随着NSCLC癌组织中GPR120表达量增加,VEGF mRNA表达量亦随之增高(图3);癌旁正常肺组织中GPR120、VEGF mRNA表达量呈负性线性相关,即NSCLC癌旁正常组织中GPR120、VEGF mRNA表达无特定规律可循(r=-0.0743 0,P=0.640 0,图3)。
2.2 NSCLC石蜡组织中GPR120、VEGF的表达免疫组化显示GPR120、VEGF在NSCLC及其对应正常组织中均定位于细胞膜及细胞质(图4、5)。85例NSCLC石蜡样本中有50例(58.82%)观察到GPR120高表达,52例(61.18%)VEGF高表达,而在与之匹配的Ⅰ、Ⅱ、Ⅲ期共62例肿瘤邻近组织样本中有14例GPR120高表达(22.58%),10例(16.13%)VEGF高表达。NSCLC肿瘤组织中GPR120、VEGF表达明显高于癌旁组织(P<0.05)。
2.3 GPR120、VEGF表达的相关性及与NSCLC临床病理特征的关系在85例NSCLC组织中,GPR120、VEGF共同高表达39例,共同低表达22例。采用Spearman等级相关检验结果表明GPR120与VEGF表达呈显著强相关(r=0.413,P<0.001)。NSCLC中GPR120蛋白表达与淋巴结转移、远处转移、TNM分期密切相关(P<0.05);VEGF蛋白表达与淋巴结转移、TNM分期密切相关(P<0.05,表1)。
2.4 GPR120、VEGF表达与NSCLC患者生存期的关系85例NSCLC患者随访时间3~36个月,中位随访时间27个月。分别建立Kaplan-Meier生存模型曲线,采用Log-rank检验进行分析:GPR120、VEGF蛋白高表达患者比低表达患者预后水平差,累积存活时间低,差异有统计学意义(P<0.05)。GPR120、VEGF同时高表达患者与两者同时低表达及GPR120或VEGF仅有一种高表达患者相比预后水平差,累积存活时间相对较低,差异有统计学意义(P<0.05,图6)。
2.5 影响NSCLC患者预后的多因素Cox比例风险回归建立Cox比例风险回归模型,仍以本组85例NSCLC为样本,以预后状况为应变量,赋值0=生存,1=死亡。Cox回归模型多变量分析发现,85例NSCLC患者的总生存率与多种因素相关,其中淋巴结转移(P=0.017)、远处转移(P=0.007)、GPR120蛋白高表达(P=0.027)为NSCLC患者预后的危险因素(表2)。

图1 NSCLC癌组织及癌旁正常组织中GPR120(A)、VEGF(B)mRNA的表达
图2 Ⅰ、Ⅱ、Ⅲ期NSCLC肿瘤组织及对应癌旁组织中GPR120(A)、VEGF(B)蛋白的表达:N.癌旁正常组织;Ca.癌组织

图3 A.NSCLC癌组织中GPR120与VEGF mRNA表达散点图;B.癌旁正常肺组织中GPR120与VEGF mRNA表达散点图

表1 NSCLC中GPR120、VEGF表达与临床病理特征的关系

④A④B④C⑤A⑤B⑤C
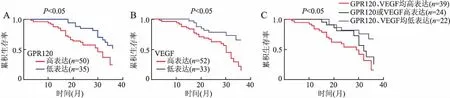
图6 A.GPR120表达和NSCLC患者预后的关系;B.VEGF表达和NSCLC患者预后的关系;C.GPR120、VEGF不同表达状态与NSCLC患者预后的关系
3 讨论
肺癌患者的5年生存率低,其中一项重要原因是患者就诊时肿瘤已为中晚期,表现出明显的侵袭转移特征[3]。然而,肿瘤的侵袭迁移、增殖的产生是多种抑癌基因及癌基因共同参与的病理过程[4]。新近发现的G蛋白偶联受体家族重要成员GPR120与部分恶性肿瘤关系密切,然而其作用及参与机制尚不清楚,可在不同肿瘤中或即使同一肿瘤的不同细胞系表现出相反的作用,且在肺癌中的研究较少[5-8]。VEGF在肿瘤中的作用研究一直为一个热门方向,其检测在NSCLC的诊断、治疗、预后评估等方面具有重要价值[9-11]。目前以VEGF为靶点治疗NSCLC的抗血管生成药物贝伐珠单抗在我国获批用于临床治疗晚期NSCLC。前期Wu等[5,12]对人类结直肠癌及食管癌研究中发现GPR120与VEGF表达密切相关。因此,探究GPR120、VEGF在NSCLC中的作用及关系对NSCLC的评估及治疗具有一定意义。
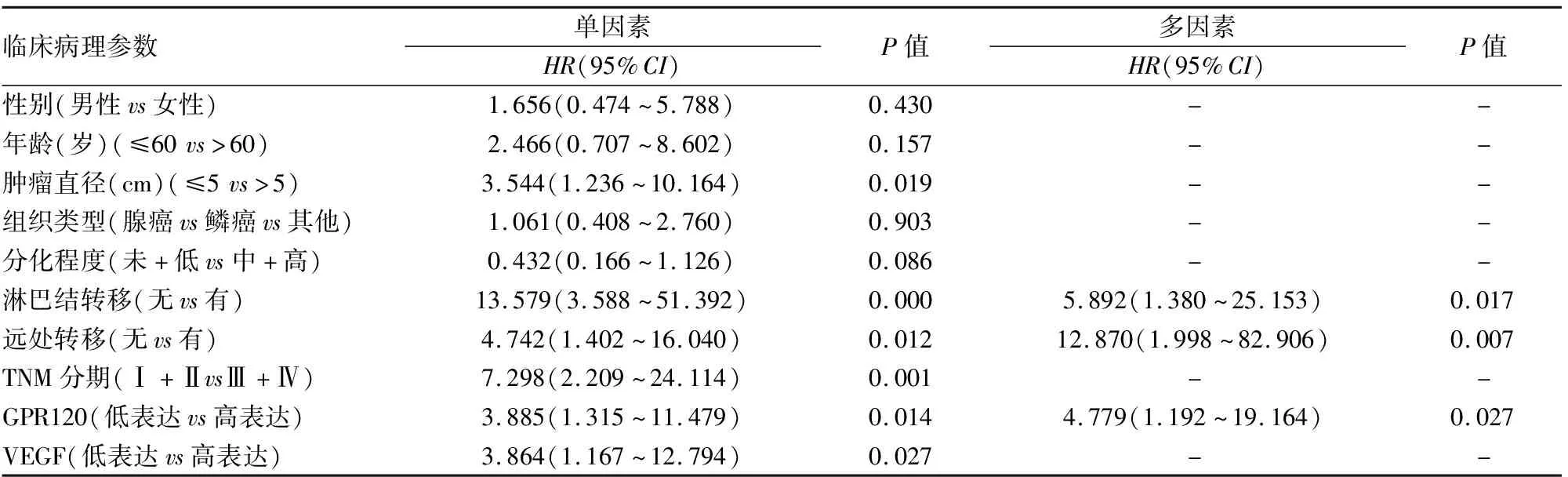
表2 影响NSCLC患者预后的Cox比例风险回归结果
本实验采用qPCR、Western blot、免疫组化检测均发现,NSCLC肿瘤组织中GPR120、VEGF表达高于对应癌旁肺组织,且随着肿瘤分期越晚表达越高。分析GPR120蛋白表达与临床病理特征的关系表明:GPR120蛋白高表达与NSCLC淋巴结转移、远处转移、TNM分期晚之间关系密切。上述结果提示,GPR120高表达NSCLC患者可能会有更多的淋巴结转移、更晚的临床分期。这也与结直肠癌[5]、食管癌[12]、乳腺癌[13]等癌组织中的研究结果相同。Wu等[5,12]研究表明在人类结直肠癌组织及食管癌中GPR120表达与肿瘤病理类型、TNM分期、淋巴结转移存在显著相关性。郭文静[13]亦发现,GPR120蛋白在乳腺癌组织中的阳性率明显高于癌旁正常组织,且与乳腺癌恶性程度呈正相关。本实验同样发现,NSCLC中VEGF蛋白表达与淋巴结转移、TNM分期显著相关,这与Lin等[10-11]的研究结果一致。此研究还表明GPR120与VEGF mRNA及蛋白表达显著相关,两者之间可能具有共同作用。这些结果说明GPR120在NSCLC中高表达的同时伴随着VEGF高表达。Wu等[5,12]在结直肠癌、食管癌中研究结果可能解释其原因,其研究显示GPR120上调可通过PI3K/Akt-NF-κB通路上调VEGF促进结直肠癌及食管癌血管生成,并参与肿瘤细胞的增殖及转移。因此,我们推测在NSCLC中GPR120高表达可使VEGF表达亦上调,GPR120高表达与淋巴结转移、远处转移、TNM分期之间相关可能是VEGF上调的结果。总之,GPR120、VEGF高表达可使NSCLC患者肿瘤细胞生长、迁移侵袭能力增强,可以向更深、更远处浸润转移。本实验还发现GPR120、VEGF蛋白表达与患者生存期密切相关,经Cox多因素回归分析也应证了这一点,同样也应证了GPR120与VEGF的共同作用促进了NSCLC的恶性进展,不利于NSCLC的预后。与Lin等[10]报道VEGF高表达预示不良的预后,具有更短的生存期一致。上述结果说明GPR120、VEGF表达可促进NSCLC的进展,并影响NSCLC患者的生存期,可以作为判断NSCLC预后的指标之一。
然而本组检测GPR120在临床标本上的表达与Kita等[8]研究肺癌细胞系发现的GPR120可能抑制肺癌A549细胞的恶性特征结果相反,分析其可能原因:(1)GPR120涉及的分子机制不同,GPR120在同种肿瘤中涉及到的机制不同可能表现出相反作用[5-6];(2)GPR40的干扰,正如Kita等[8]研究的结果一样,GPR120与GPR40在肺癌细胞中呈现出相反的作用,共同调节肺癌的细胞功能。在其他肿瘤中研究结果亦同样存在该现象[14];(3)肿瘤组织中间质细胞、免疫细胞对检测具有一定干扰。
本实验结果显示GPR120与VEGF均在NSCLC中表达上调,且显示出共同促进肿瘤发生、发展的作用,但其涉及的分子机制还不明确,后期还需进一步明确GPR120与VEGF之间的作用分子机制及调控关系,为进一步研究GPR120在NSCLC中的具体作用奠定基础。此外,GPR120及VEGF高表达提示NSCLC患者预后相对较差,Cox分析也进一步证实此结论。本实验结果表明GPR120可能通过VEGF发挥促癌作用,有望作为新的评估、治疗NSCLC的靶点。

