茶多酚对盐胁迫下小麦幼苗叶片生理特性的影响
司廉邦,李嘉敏,黎桂英,蒋晓煜,吕丽荣,杨颖丽
西北师范大学生命科学学院, 兰州 730070
盐害是影响植物生长发育和限制农业产量的世界性环境问题之一。据统计,世界上盐渍化的土地面积约9.5亿hm2,占全球陆地总面积的10%左右[1]。土壤盐碱化主要是由于气候干燥引起地面蒸发加剧,导致土壤板结而造成。我国盐渍化土地约有1亿hm2,主要分布在西北、东北和华北的干旱、半干旱地区。叶绿素是植物光合作用过程中吸收光能的重要色素,叶绿素荧光直接反映光合作用的实际及最大光合效率、反应中心开放程度和植物热耗散等情况[2]。盐胁迫可能会导致叶绿体结构损伤、光合色素含量减少,因此抑制植物的生长发育。李学孚等[3]研究发现,高浓度NaCl处理下葡萄‘鄞’幼苗的叶绿素含量、光系统II(photosystem II, PS II)最大光化学效率(maximal photochemical efficiency,Fv/Fm)、PSⅡ潜在活性(potential activities of PS II,Fv/F0)、光合电子传递效率(photosynthetic electron transfer efficiency, ETR)以及光化学淬灭(photochemical quenching, qP)均下降,而非光化学淬灭(non-photochemical quenching, qN)增大。盐胁迫也会引起植物细胞水分缺失,通过渗透胁迫影响各种代谢活动,造成活性氧如过氧化氢(hydrogen peroxide, H2O2)等的积累[4]。例如,盐胁迫改变了植物组织中多胺代谢过程,导致二胺氧化酶(diamine oxidase, DAO)和多胺氧化酶(polyamine oxidase, PAO)活性增强,通过氧化腐胺和亚精胺产生H2O2[5- 6]。
茶多酚(tea polyphenols, TP)是茶叶中以儿茶素为主要成分的多酚类化合物,又名茶鞣质[7]。TP的基础结构是α -苯基苯丙吡喃,具有抗衰老、抗辐射、抗肿瘤、抗菌等特殊的生理功能,被广泛应用于动物医学研究[8]。研究表明,TP能够清除活性氧,减少活性氧的生成,还可通过猝灭活性氧,增强抗氧化酶活性[9]。因此,TP作为一种新型天然的抗氧化剂在食品保鲜和植物抗逆等方面也得以应用。李翠英等[10]报道,低浓度的茶多酚处理对杏果实在贮藏期抗氧化酶系统有一定的激活作用,有利于杏果实的贮藏。于明革[11]研究发现,TP处理明显改善了铅处理下茶树的生长发育,使干物质积累量增加,而茶树体内铅的含量降低。我们在前期的研究中发现,TP有效地缓解了盐诱导的小麦根中渗透性调节物的积累和钙元素含量的减少[12]。
小麦是世界范围种植的重要粮食作物之一。近年来,由于种植业结构的调整,小麦种植面积减少,但小麦的消费量及消费水平有增无减[13]。土壤盐渍化会引发土壤肥力下降导致土地荒芜,限制植物生存降低作物产量,进而制约农业可持续发展。然而,盐碱地没有被化肥、农药污染,可作为我国耕地的后备资源。因此,改良小麦品种,提高小麦在干旱及盐碱地的生存能力及产量具有重要的现实意义。春小麦新品种“陇春30号”由甘肃省农科院小麦研究所选育,主要种植在甘肃河西走廊酒泉、张掖、武威等部分干旱、盐碱地区[14]。有关该小麦在盐环境中生存的生理生态特性的相关研究较少。此外,未见TP对盐胁迫植物叶绿素荧光特性及多胺代谢酶DAO和PAO活性影响的相关报道。本研究主要分析了TP与NaCl单独或复合胁迫对小麦“陇春30号”幼苗叶绿素含量、叶绿素荧光参数等生理特性的影响,为进一步阐明并揭示TP改变盐胁迫植物生理特性的调控机制提供理论依据,为发现并研究揭示TP对植物盐胁迫损害的缓解作用及机制奠定基础。
1 材料与方法
1.1 材料与处理
春小麦(TriticumaestivumL.)“陇春30号”购自甘肃省农科院,TP由甘肃特色植物有效成分制品工程技术研究中心提供。小麦种子用0.1%的氯化汞表面消毒10 min,流水冲洗后置于温度为25℃的黑暗状态下萌发24 h。挑选萌发一致的种子放入培养皿,置于25℃、12 h/12 h (300 μmol m-2s-1光照/黑暗)的培养箱培养。分别用以下方法处理对照用1/4 Hoagland营养液培养,150 mmol/L NaCl、25 mg/L TP、100 mg/L TP、150 mmol/L NaCl+25 mg/L TP 和150 mmol/L NaCl+100 mg/L TP的处理用1/4 Hoagland营养液配制。每个处理均设置3个重复,每两天更换一次处理液,待幼苗生长6 d后,取叶片测定各项指标。
1.2 生理指标的测定1.2.1 叶绿素含量的检测
取0.5 g小麦叶片加入4 mL 95%的乙醇研磨,11000g离心10 min,取上清液,在沉淀中加入等体积的提取液混匀再次离心,然后将两次的上清液用25 mL容量瓶定容。用紫外分光光度计测定663 nm和646 nm处的吸光值,按Lichtenhale[15]的方法计算叶绿素含量[mg/g FW(鲜重, fresh weight) ]。
1.2.2叶绿素荧光参数的检测
参考Demmig-Adams和Adams[16]的方法并用叶绿素荧光成像仪IMAGING-PAM测定。在温度为25℃±2℃、湿度为45%±3%的环境下,所测幼苗材料暗适应30 min后,测量初始荧光(the minimum fluorescence yield in the dark-adapted state,F0)和最大荧光(the maximum fluorescence yield in the dark-adapted state,Fm),计算暗适应下PS II潜在Fv/Fm=(Fm-F0)/Fm。当所测材料在作用光的实时荧光(the relative steady-state fluorescence,Fs)达到稳态后20 s打开饱和脉冲光,测得最大荧光(the maximum fluorescence yield in the light-adapted state,Fm′),然后在远红光下测定光适应下叶片的最小荧光(the minimum fluorescence yield in the light-adapted state,F0′)。从仪器中直接导出光适应下PS II的实际光量子产量[actual light quantum yield,Y(II)]、qP、NPQ、ETR等参数[2]。
1.2.3H2O2含量的测定
参照Yin等[17]的方法。植物材料0.5 g加入5 mL 0.1% (m/V)的三氯乙酸冰浴研磨,12000g离心30 min,取上清液加入10 mmol/L的磷酸缓冲液(phosphate buffer, PBS)和1 mol/L的碘化钾,测波长在390 nm处的吸光值。
1.2.4细胞壁过氧化物酶(cell wall-peroxidase, cw-POD)、DAO、PAO活性的检测
参照Lee与Lin[18]的方法提取细胞壁,取小麦叶片0.5 g,加入2 mL 50 mmol/L PBS (pH 5.8)提取液冰浴研磨,1000g离心10 min,沉淀重悬浮洗涤,洗涤3次,收集沉淀加入2 mL 1 mmol/L NaCl溶液,30℃摇床孵育2 h,1000g离心10 min,取上清酶液备用。
参照Dos Santos等[19]的方法测定cw-POD活性。100 μL酶液加入2.9 mL含7.2 mmol/L愈创木酚的50 mmol/L PBS (pH 8.5),以11.8 mmol/L H2O2启动反应,在470 nm处以20 s为时间间隔扫描2 min。
DAO活性的检测参照Naik等[20]的方法。1 g小麦叶片加入含有20 mmol/L愈创木酚的50 mmol/L PBS (pH7.0)提取液,冰浴研磨后16000g离心20 min,取上清酶液加入含10 mmol/L腐胺和0.1 mmol/L磷酸吡哆醛的50 mmol/L PBS (pH7.8),30℃孵育1 h,然后加入1 mL 20% 的三氯乙酸终止反应,放置30 min后5000g离心15 min,取上清加入1 mL茚三酮复合物(250 mg茚三酮溶于6 mL乙酸和4 mL磷酸),沸水浴30 min后加入1 mL冰乙酸,测定510 nm处吸光值。
参照Asthir等[21]的方法检测PAO活性。取新鲜小麦叶片1 g加入2 mL含有5 mmol/L二硫苏糖醇的100 mmol/L PBS (pH7.0)中冰浴研磨,16000g离心20 min,取沉淀加入含1 mmol/L NaCl的100 mmol/L PBS (pH7.0)再次提取后,16000g离心20 min,取450 μL酶液加入300 μL反应液[50 U 过氧化氢酶(catalase, CAT)和0.1% 2-氨基苯甲醛],以250 μL内含10 mmol/L亚精氨的50 mmol/L PBS (pH6.0)启动反应,30℃孵育3 h后加入1 mL 10%高氯酸终止反应,6500g离心10 min,取上清于430 nm处测定吸光值。
1.3 数据的处理与分析
数据的处理利用SPSS 17.0进行统计分析,采用单因素(one-way ANOVA)和Duncan法进行方差分析和多重比较,各处理组均设3个重复,结果用平均值(X)±标准误(SE)表示。采用Origin 7.5 软件作图,用不同小写字母表示显著性差异(P<0.05)。
2 结果与分析
2.1 不同处理对小麦幼苗叶绿素含量的影响
由表1可知,150 mmol/L NaCl处理下小麦幼苗叶片Chla(叶绿素a, chlorophyll a)、Chlb(叶绿素b, chlorophyll b)和总叶绿素含量与对照比,分别降低约34%、60%和42%,叶绿素a/b (ratio of chlorophyll a and chlorophyll b, Chla/b)值显著增大,不同浓度TP(25 mg/L和100 mg/L)处理下以上参数与对照比无显著变化。与NaCl单独处理相比,25 mg/L TP的添加不影响Chlb的含量与Chla/b值,而Chla和总叶绿素含量显著增加;不同的是,150 mmol/L NaCl+100 mg/L TP处理下这些指标较盐单独处理分别增加约28%、50%和34%。同时,25 mg/L TP不影响盐诱导的Chla/b变化,而100 mg/L TP则使该比值显著减小。
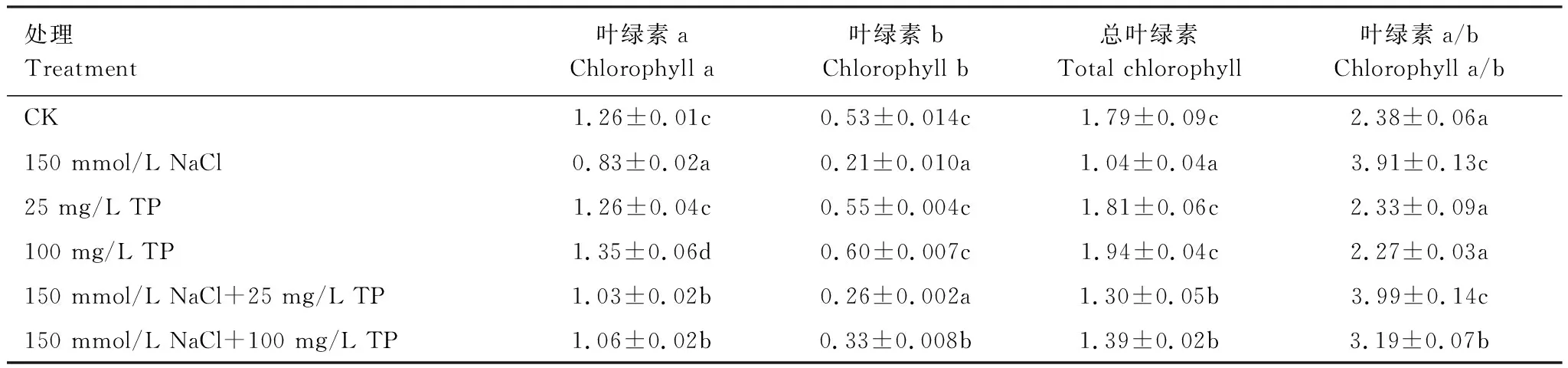
表1 不同处理下小麦幼苗叶中叶绿素含量(mg/g FW)的变化
2.2 不同处理对小麦幼苗叶光系统Fv/Fm与Y (II)的影响
Fv/Fm是暗适应下植物叶绿体PS II潜在的最大光化学效率,是研究光抑制或各种环境胁迫影响光合作用的重要指标[22]。图1显示,150 mmol/L NaCl处理下小麦幼苗叶中的Fv/Fm较对照显著降低约25%,而25 mg/L TP或100 mg/L TP单独处理不影响该参数。此外,不同浓度TP的添加诱导盐胁迫小麦叶片Fv/Fm显著升高,与单独盐处理相比分别增加约1.19倍和1.18倍。
Y(Ⅱ)表示光化学能量转换的有效量子产量,被称为光适应下PS Ⅱ的实际光量子产量[22]。从图1中可以看出,Y(II)值在150 mmol/L NaCl处理下与对照相比显著降低约23%,25 mg/L或100 mg/L TP处理下该参数较对照的变化均未达到显著水平。25 mg/L和100 mg/L TP不影响盐处理对小麦幼苗叶片光系统Y(II)的抑制作用。

图1 不同处理对小麦幼苗叶Fv/Fm与Y (II)的变化(数值为平均数±标准误差)Fig.1 Changes of Fv/Fm and Y (II) in wheat leaves under different treatments(mean±SE)Fv/Fm:最大光化学效率Maximal photochemical efficiency; Y (II):实际光量子产量 Actual light quantum yield; CK:对照 Control; 150 NaCl、25 TP (茶多酚 Tea polyphenols)、100 TP、25 TP+和100 TP+分别表示: 150 mmol/L NaCl、25 mg/L TP、100 mg/L TP、150 mmol/L NaCl+25 mg/L TP和150 mmol/L NaCl+100 mg/L TP; 不同小写字母表示各处理间差异显著(P<0.05)

图2 不同处理下小麦幼苗叶qP与NPQ的变化(数值为平均±标准误差)Fig.2 Changes of qP and NPQ in wheat leaves under different treatments(mean±SE)qP:光化学淬灭 Photochemical quenching; NPQ:非光化学淬灭 Non-photochemical quenching; 150 NaCl、25 TP、100 TP、25 TP+和100 TP+分别表示: 150 mmol/L NaCl、25 mg/L TP、100 mg/L TP、150 mmol/L NaCl+25 mg/L TP和150 mmol/L NaCl+100 mg/L TP; 不同小写字母表示各处理间差异显著(P<0.05)
2.3 不同处理对小麦幼苗叶光系统qP与NPQ的影响
qP可以反映光合作用反应中心的开放程度[23]。从图2中可以看出,150 mmol/L NaCl处理下qP较对照减小约53%,而25 mg/L或100 mg/L TP处理对小麦幼苗叶该参数无影响。与盐单独处理相比,25 mg/L或100 mg/L TP的添加使NaCl处理小麦幼苗叶的qP均呈显著性增大,分别增加约57%和83%(图2)。
NPQ反映了PS II天线色素吸收的光能以热能的形式耗散掉而不能用于光合电子传递的光能[24]。如图2所示,与未处理的小麦幼苗相比,150 mmol/L NaCl处理下NPQ显著增加为对照的2.15倍,而25 mg/L或100 mg/L TP处理下NPQ均无明显变化。150 mmol/L NaCl+25mg/L TP和150 mmol/L NaCl+100 mg/L TP处理下小麦叶片NPQ与盐单独处理相比分别减少约19%和28%。
2.4 不同处理对小麦幼苗叶光系统ETR的影响
ETR反映的是实际光照条件下表观电子传递速率[23]。NaCl处理下小麦幼苗光系统ETR与对照比显著降低约23%,而不同浓度TP单独处理不影响小麦叶ETR(图3)。与单独盐处理相比,150 mmol/L NaCl+25 mg/L TP或150 mmol/L NaCl+100 mg/L TP处理使ETR显著增大约12%和15% (图3)。
2.5 不同处理对小麦幼苗叶H2O2含量的影响
如图4所示,150 mmol/L NaCl或25 mg/L TP处理诱导小麦叶H2O2含量分别增加为对照的1.53倍、1.14倍,100 mg/L TP不影响H2O2含量;25 mg/L或100 mg/L TP缓解了盐诱导的小麦幼苗叶中H2O2的积累,与NaCl单独处理相比使H2O2产生分别减少约14%和25%。

图3 不同处理下小麦幼苗叶光合电子传递效率(Photosynthetic electron transfer efficiency, ETR)的变化(数值为平均数±标准误差)Fig.3 Change of ETR in wheat leaves under different treatments(mean±SE)150 NaCl、25 TP、100 TP、25 TP+和100 TP+分别表示:150 mmol/L NaCl、25 mg/L TP、100 mg/L TP、150 mmol/L NaCl+25 mg/L TP和150 mmol/L NaCl+100 mg/L TP; 不同小写字母表示各处理间差异显著(P<0.05)

图4 不同处理下小麦叶过氧化氢(Hydrogen peroxide, H2O2)含量的变化(数值为平均数±标准误差)Fig.4 Change of H2O2 content in wheat leaves under different treatments(mean±SE) 150 NaCl、25 TP、100 TP、25 TP+和100 TP+分别表示: 150 mmol/L NaCl、25 mg/L TP、100 mg/L TP、150 mmol/L NaCl+25 mg/L TP和150 mmol/L NaCl+100 mg/L TP; 不同小写字母表示各处理间差异显著(P<0.05)
2.6 不同处理对小麦幼苗叶cw-POD、DAO和PAO活性的影响
如表2所示,与未处理幼苗相比,150 mmol/L NaCl或25 mg/L TP处理下小麦叶片cw-POD活性显著升高约189%和28%,而100 mg/L TP处理不影响该酶活性。不同浓度(25 mg/L和100 mg/L) TP的添加使NaCl处理小麦幼苗叶cw-POD活性显著降低,与单独NaCl处理相比分别降低约38%和54%。
与对照相比,盐胁迫诱导小麦幼苗叶片DAO和PAO活性分别增加约14%和31%;25 mg/L TP处理下DAO活性无明显变化,而PAO活性升高约16%;100 mg/L TP处理下DAO和PAO活性均降低约为对照的66%和73%,且差异均达到显著性水平。低浓度TP缓解了盐诱导的DAO和PAO活性的增加,与单独NaCl处理相比分别降低约33%和31%,而100 mg/L TP的添加不影响盐诱导的两种酶活性的变化。

表2 不同处理下小麦幼苗叶中cw-POD、DAO和PAO (U/mg protein)活性的变化
3 讨论
叶绿素是植物进行光合作用的重要色素。盐胁迫使菜豆幼苗叶片和沙枣苗木的叶绿素a、叶绿素b和总叶绿素含量均降低[22, 24],这可能是由于Na+和Cl-直接对叶绿体有一定的损害[25],或盐胁迫增强了植物体内叶绿素酶的活性从而加剧了叶绿素的降解[26]。Chla和Chlb是光系统天线复合体的重要组成成分,大部分Chla和全部Chlb的作用是吸收与传递光能,只有少部分的Chla具有转化光能的作用[27]。本研究中,NaCl单独处理导致小麦幼苗叶绿素含量减少,而Chla/b值增大,表明盐胁迫造成了叶绿素的降解,且对Chlb的破坏作用强于对Chla的作用,从而减弱盐胁迫下小麦叶片对光能的吸收和传递。相似,海水结合二硫苏糖醇处理的菠菜叶片[28]和水分胁迫下地枫皮[29]叶绿素含量降低,而Chla/b值却增大。另据报道,铅锌单独或复合胁迫下山苍子幼苗叶绿素b、叶绿素a+b含量均呈先升后降的趋势,而叶绿素a/b值均低于对照[30]。不同的是,TP单独处理不影响小麦叶片光合色素含量(表1)。由此可见,逆境胁迫下叶绿素含量的变化与植物种类、胁迫类型及胁迫程度等因素有关。稳定的光合色素有利于植物正常的光合作用和提高植物的耐盐性[26]。Chla/b值在一定范围内越小,表明对植物光能的吸收率越高[31]。我们在研究中还发现,不同浓度TP能够有效缓解盐胁迫下小麦叶绿素的降解,这有利于增强盐胁迫小麦幼苗对光能的吸收和传递,有利于光合作用的进行,从而提高了小麦对盐环境的适应性。此外,100 mg/L TP的加入使NaCl处理幼苗的Chla/b值减小,表明100 mg/L TP加入对Chlb破坏的缓解作用强于对Chla。
在正常环境中,叶绿素吸收的光能主要通过光合电子传递、叶绿素荧光发射和热耗散等途径消耗。叶绿素荧光参数反映了植物叶片吸收、传递、耗散和分配光能的能力[23],常被用来判断逆境胁迫下植物叶片光系统的受损程度。有文献报道,NaCl胁迫导致菜豆幼苗和假单胞藻PS II的Fv/Fm、Y(II)、qP和ETR显著减小,而NPQ显著增大[22,32]。另据报道,盐胁迫抑制了鞭金藻的光合活性,使Fv/Fm、qP和ETR降低,而NPQ在鞭金藻3011增加却在鞭金藻8701呈先增大后减小的变化趋势[33]。Fv/Fm值的降低是光抑制发生的重要特征[28],qP值减小反映了PS II天线色素吸收的光能用于光化学电子传递的份额减少[34]。NPQ反映了PS II天线色素吸收的光能以热能的形式耗散掉而不能用于光合电子传递的光能。未见TP影响植物叶绿素荧光特性的相关研究报道。与前人研究部分结果相似,NaCl单独处理下小麦幼苗Fv/Fm、Y(II)、qP和ETR均减小,而NPQ显著增大,但TP单独处理下这些指标无显著变化。这些结果表明NaCl单独处理明显降低了小麦叶片对光能的吸收效率,使PS II传递电子的能力下降,部分光能无法用于光反应,以热形式耗散掉的比例显著增高。有研究者认为,盐胁迫诱导qP减小而NPQ增大,说明在光合作用过程中破坏性过度能量可通过热能的形式耗散[35],减少对光合机构的损伤。因此,本研究结果同时也表明,NaCl胁迫下小麦幼苗可能通过提高NPQ,消耗PS II不能利用的过剩光能,从而使PS II反应中心免受因吸收过多光能而引起的光氧化和光抑制伤害。此外,TP的加入使NaCl处理小麦幼苗Fv/Fm、qP和ETR显著增大,而NPQ显著减小。由上可知,NaCl胁迫显著降低了小麦幼苗叶片PS II对光能的利用率,增大了对光能的热耗散;TP的添加有效地提高了盐胁迫小麦幼苗PS II在光下的运行速率及接受和传递电子的能力,增强了光合活性,减少了光能的热耗散。
植物在逆境胁迫下,由于活性氧代谢加剧导致体内ROS过度积累,且植物光合能力的降低可能与ROS包括H2O2的产生有关。因为H2O2作为一种强氧化剂可以穿过质膜直接攻击叶绿体使其功能受阻[36]。有文献报道,耐盐品种水稻在盐胁迫下叶绿素含量降低可能与ROS介导的叶绿素降解有关[37]。蒋明义等甚至认为,渗透胁迫降低植株叶片色素含量的主要原因是ROS的氧化作用[38]。本研究中,NaCl或25 mg/L TP单独处理均诱导小麦幼苗叶片H2O2含量显著增加,且盐胁迫的诱导效应更强,相比较25 mg/L TP的诱导效应弱,而100 mg/L的TP不影响H2O2的产生。H2O2产生的这些变化趋势结合相应处理下叶绿素含量的变化似乎表明,盐胁迫诱导过多H2O2的积累可能与小麦幼苗叶绿素含量的减少有关,而盐胁迫引起的Fv/Fm、Y(Ⅱ)、qP和ETR减小是否涉及H2O2的积累有待进一步的研究。相似,陈新斌等的研究表明,菠菜叶片中活性氧大量积累,导致光合色素降解加剧[28]。镉的积累也可通过触发植物体内过量的ROS产生,引起重要的细胞结构如膜功能紊乱,破坏叶绿体结构[39]。我们在本研究中还发现,两种浓度TP的加入可缓解NaCl处理诱导的小麦叶片H2O2的积累,与此同时盐胁迫对叶绿素的破坏作用也减弱,这进一步说明盐胁迫诱导的小麦幼苗叶片叶绿素含量减少可能与H2O2的积累有关。因此,TP通过抑制NaCl处理小麦幼苗叶片H2O2的产生,进而减弱NaCl处理对小麦幼苗叶绿素的破坏及对叶绿体结构的损害,提高NaCl处理小麦幼苗的光合能力。逆境胁迫诱导植物ROS过多的产生会对植物产生伤害甚至细胞的死亡[40]。本研究中,TP的添加缓解了盐胁迫诱导的H2O2的产生,从而减弱了因活性氧积累而对植物造成的伤害,增强了小麦幼苗对盐环境的适应能力。
植物细胞壁上的cw-POD是植物体内H2O2产生酶之一,主要通过质外体NADH的氧化而产生H2O2[41]。除此之外,植物多胺代谢途径中的PAO和DAO两种酶也可能参与H2O2的产生,其中DAO在催化腐胺(Put)去氨基化的过程中生成H2O2,PAO在催化精胺和亚精胺氧化脱氨最终生成Put的过程中产生H2O2[42]。有文献报道,NaCl处理下水稻幼苗离子结合态cw-POD活性与H2O2的产生均增强[43]。另据报道,盐胁迫使药用人参中DAO活性显著增加,而PAO活性呈现先增强后减弱的变化趋势[44]。本实验中,NaCl处理诱导小麦叶片cw-POD、PAO和DAO活性显著升高,25 mg/L TP单独处理下cw-POD活性增强,而100 mg/L TP处理显著抑制PAO和DAO活性。有研究者通过组织化学染色和电镜观察并结合酶活性分析表明,ABA处理诱导了玉米叶片cw-POD及质外体PAO活性的升高,且这两种酶均参与了ABA诱导的H2O2的积累[45]。相似的结果在以大蒜幼苗玻璃质化为材料的研究中也被观察到[46]。另据报道,盐处理下水稻根中DAO活性与H2O2的积累有关[43],番茄H2O2的产生依赖于PAO活性[5],而NH4Cl处理下水稻DAO活性与H2O2的积累无关[43]。更为重要的是,本研究中NaCl处理对cw-POD、PAO和DAO活性的诱导效应更强,且伴随着更多H2O2的产生,而25 mg/L TP单独处理对cw-POD和PAO活性的诱导效应较弱。结合他人的研究,可以推测NaCl或25 mg/L TP单独处理诱导的cw-POD、PAO和/或DAO活性升高可能与H2O2的积累有关。我们在本实验中还发现,25 mg/L TP的使用显著地减弱了盐胁迫对小麦幼苗叶cw-POD、PAO和DAO活性的诱导作用,而100 mg/L TP只对盐胁迫诱导的cw-POD活性的升高有缓解作用,这些可能是TP的加入导致NaCl处理下小麦叶H2O2产生减少的原因。尽管已有的研究表明,逆境胁迫下cw-POD、DAO和PAO活性可能与H2O2积累有关,然而依赖于这三种酶的H2O2积累是否涉及逆境胁迫改变植物叶绿素含量及其荧光特性,有待于进一步研究。
综上所述,盐胁迫导致小麦幼苗叶绿素含量减少,光系统Fv/Fm、Y(Ⅱ)、qP和ETR减小,NPQ增大,而单独TP处理不影响这些指标。TP的添加有效地减弱了盐胁迫诱导的这些效应,导致叶绿素含量增加,光合电子传递效率和光化学反应速率增大,对光能利用率增强而热耗散减弱,增强了NaCl处理小麦幼苗的光合活性,同时降低了盐处理小麦幼苗叶片的cw-POD、DAO和PAO活性,减少了H2O2的产生,从而减弱了盐胁迫对小麦幼苗的伤害作用,提高了小麦幼苗对盐环境的耐受性。

