浓香型白酒窖泥中放线菌的发酵特性研究
姚亚林,郑若欣,程铁辕,邓杰,任志强,卫春会,黄治国,*
(1.四川轻化工大学酿酒生物技术及应用四川省重点实验室,四川宜宾644000;2.四川国检检测有限责任公司,四川泸州646000;3.宜宾海关,四川宜宾644000)
中国白酒发酵是多菌复合的开放式固态发酵,其本质就是多种微生物通过复杂的代谢活动及相互作用形成了白酒独特的风味物质[1-2]。窖泥是酒体生香功能微生物的繁殖载体,而浓香型白酒生产与窖泥中的微生物密切相关[3]。目前,对窖泥微生物的研究热点主要在细菌,而窖泥中的放线菌却较少报道。
放线菌,是一类具有分枝状菌丝体的高(G+C)含量的革兰氏阳性菌,其次生代谢产物丰富[4]。当前对放线菌研究报道主要着重于抗生素[5-7]等方面,而对于窖泥中放线菌在酿造过程中的发酵特性研究较少,大部分针对放线菌的分类培养[8-10]和窖泥中放线菌的群落分布[11-13]进行研究。李东等[14]发现放线菌中链霉菌产生土味素对白酒的酒质有一定影响,初步探索了放线菌对浓香型白酒生产可能的影响;裴乐乐等[15]过荧光定量PCR方法定量检测窖泥中放线菌的原始Copies数,发现放线菌对窖泥质量的影响可能受窖池中多种生物和非生物因素的影响;王涛等[16]通过从酿造环境中分离的123株放线菌的挥发性产物分析,发现其能够产生一些酯类、醇类等重要的浓香型白酒的呈香成分。研究文献表明[17],浓香型白酒窖泥中存在大量放线菌,值得继续研究。
本试验以浓香型白酒窖泥中分离的3株放线菌为试验对象,探究其发酵特性,进行小型固态发酵产酒试验,最后通过综合分析酒醅的一系列理化指标和挥发性成分特征,分析该3株放线菌对白酒酿造可能产生的影响,以期为窖泥中放线菌后续的研究提供指导和经验。
1 材料与方法
1.1 材料
1.1.1 菌种
白色链霉菌(Streptomyces albus)A1、桑氏链霉菌(Streptomyces sampsonii)A2、鲁地链霉菌(Streptomyces rutgersensis)A3:浓香型白酒窖泥中分离的3株放线菌,在实验室用液体石蜡保藏于4℃。
空气芽孢杆菌(Bacillus aerius):共酵实验菌,丁酸菌,来源于四川轻化工大学酿酒生物技术及应用四川省重点实验室。
1.1.2 原料
大曲:宜宾六尺巷酒业有限公司;高梁、糠壳:市售。
1.1.3 主要设备
SW-ZJ-2D超净工作台:苏州苏洁净化设备有限公司;PR205740RCN 生化培养箱、MaxQ400 摇床、Pi-Co21台式高速离心机:Thermo Scientific科技公司;MX-S混匀仪:大龙兴创实验仪器(北京)有限公司;LS-I201微生物培养箱、LS-O610干燥箱:LabServ赛默飞世尔科技公司;Super Alcomat,Gibertini Elettronica SRL酒精浓度计:上海点将精密仪器公司;5975B-7890A气相色谱质谱联用仪:安捷伦科技中国有限公司;50 μm/30 μm DVAB/CAR/PDMS 固相微萃取头:美国Supelco公司。
1.1.4 主要试剂
葡萄糖、硝酸钾、氯化钠、磷酸二氢钾、硫酸镁、硫酸亚铁、醋酸钠、可溶性淀粉(分析纯):成都市科龙化工试剂厂;蛋白胨、牛肉膏、酵母粉、麦芽汁浸粉、琼脂:北京奥博星生物技术有限责任公司;丁酸钠,生物试剂(分析纯):上海朝瑞生物科技有限公司;L-半胱氨酸盐酸盐(食品级):河南喜莱客化工有限分司;乙酸丁酯(色谱纯):美国Sigma公司。
1.1.5 培养基
高氏Ⅰ号培养基、酵母膏-麦芽膏(YEME)培养基、牛肉膏蛋白胨培养基、麦芽汁培养基;强化梭菌培养基:参考文献[18-19]方法配制。
固态发酵培养基:麸皮50 g,100 mL复合无机盐溶液(氯化钠0.5%,硝酸钾1%,磷酸氢二钾0.5%,硫酸镁0.5%,硫酸亚铁0.01%,氢氧化钠0.8%)。配制3份,装入250 mL三角瓶,手摇振荡混匀,润料1 h后121℃,灭菌20 min。灭菌后及时打散。
1.2 试验方法
1.2.1 产酶特性研究
1.2.1.1 菌种液制备
在无菌条件下,分别将3株放线菌接种于装有100mL高氏Ⅰ号液体培养基的三角瓶中,然后于28℃,150 r/min,摇床培养。A1、A2、A3 培养 7 d。
1.2.1.2 麸曲制作
在无菌条件下,各加入30 mL菌种液于固态发酵培养基中,手摇振荡混匀,28℃恒温培养7 d,每天振匀打散一次。
1.2.1.3 酶活力测定
糖化酶活力、蛋白酶活力、酯化酶活力测定方法同《酿酒分析与检测》[18]。
1.2.2 共酵试验
1.2.2.1 菌株单独培养
将放线菌菌株于高氏1号培养基中,28℃,120r/min,培养3 d。50 mL强化梭菌培养基于蓝盖瓶中培养丁酸菌,密封瓶盖,30℃,50 r/min培养3 d。
1.2.2.2 共培养
将菌株A1、A2、A3的发酵液分别混合至丁酸菌液中,每瓶加50 mL。旋紧瓶盖,30℃,50 r/min培养10 d。
1.2.2.3 丁酸含量测定
利用乙醚萃取发酵液中的有机酸[20]。取20 mL发酵液加入带盖试管中,每管加3 mL乙醚,旋涡振荡5 min,静置10 h。然后转移至50 mL离心管中,5 000 r/min离心10 min。吸取1.5 mL乙醚萃取液,加入10 μL 20 mg/mL的乙酸丁酯内标进行半定量。使用气相色谱与质谱联用仪测定,进样量1 μL。
气相色谱条件[20]:毛细管色谱柱为J&W 122-7062,规格为 60.0 m×250 μm×0.25 μm;手动分流进样,分流比为12∶1;进样口温度250℃;起始温度:60℃,维持2 min,然后以5℃/min升温至200℃,维持1 min,再以20℃/min升温至250℃,维持2 min;以He为载气,流量为1 mL/min。
质谱条件[20]:电离方式EI,电子能量70 eV,离子源温度230℃,四极杆温度100℃,恒压10 Pa,全扫描。
1.2.3 固态发酵产酒试验
以大曲为主要糖化发酵剂,添加放线菌菌液进行小型模拟固态发酵产酒试验。
1.2.3.1 酿酒操作流程
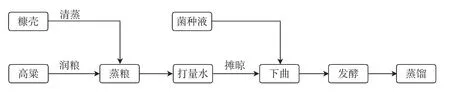
使用2 L陶坛模拟酿酒发酵容器,参照浓香型大曲酒的配料参数准备原料[21],高粱、大曲与糠壳的质量配比为 5∶1∶1。
将密封好的陶坛置于阴凉处自然发酵。发酵45 d后,取出缓慢蒸馏,测定酒醅理化指标和酒醅挥发性成分。
1.2.3.2 理化指标测定
酒醅的酸度、还原糖含量、淀粉含量及酒精度测定同文献[18-19]方法操作。
1.2.3.3 酒醅挥发性成分分析
采用顶空固相微萃取法(headspace solid-phase microextraction,HS-SPME)提取高粱固态醅的挥发性成分。称取高粱醅5.0 g/瓶,并加入5 μL 20 mg/mL的乙酸丁酯标品进行半定量分析。于60℃恒温条件下平衡20 min,萃取40 min,进样通过气相色谱-质谱联用仪(gas hromatography-mass spectrometer,GC-MS)分析。
1.3 数据处理及分析
每组试验重复3次,试验结果用平均值±标准差表示。使用SPSS软件对数据进行分析,同时采用Excel对数据进行编辑绘图。
2 结果分析与讨论
2.1 3株放线菌的糖化酶活力、蛋白酶活力和酯化酶活力比较
糖化酶是淀粉质原料被转化为可发酵性糖的重要的酶,糖化酶活力越高,越能提高对发酵原料的利用率,一般浓香型大曲的糖化酶活力为600 U/g~700 U/g左右[22]。本试验比较研究了3株放线菌的糖化酶活力,结果如图1所示。
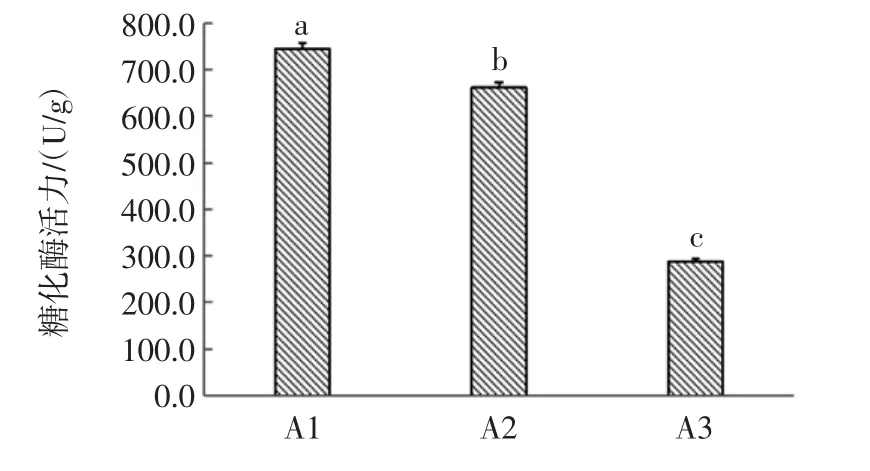
图1 3株放线菌的糖化酶活力比较Fig.1 Comparison of glucoamylase activity of three strains of actinomycetes
A1、A2 的糖化酶活力分别为 (774.2±13.6)、(661.8±10.2)U/g。可见放线菌菌株 A1、A2具有较高的产糖化酶的能力;而A3的糖化酶活力相比A1、A2差异显著(P<0.05),对原料的利用率较差。
蛋白酶在白酒酿造的环境中,将原料蛋白质分解成氨基酸,而氨基酸是许多香味物质的前体物质,既可在微生物或酶作用下生成高级醇,也可与还原糖结合发生美拉德反应生成各种含氮有机物,有利于白酒的风味形成[21]。本试验比较研究了3株菌的蛋白酶活力,结果如图2所示。
A1、A2的蛋白酶活力都达到100 U/g以上,且A2的蛋白酶活力显著高于A1(P<0.05),而A3蛋白酶活未检出。与周敬波的研究结果[23]相比,此2株菌蛋白酶活力相对较低,可能是选用的试验菌株不同。
酯化酶活力是评价大曲生香能力的重要指标。酯化力越高,表明在白酒酿造中能够生成更多的酯类化合物。本试验比较研究了3株菌的酯化酶活力,结果如图3所示。
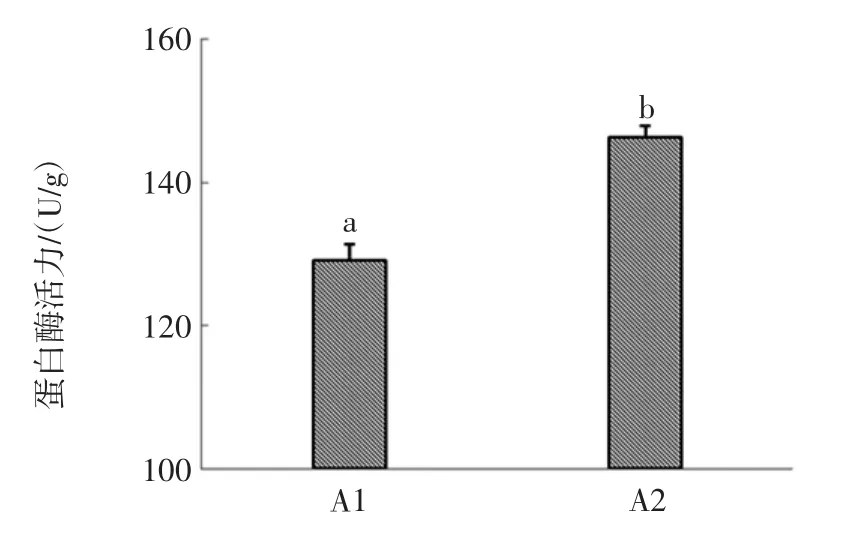
图2 2株放线菌的蛋白酶活力比较Fig.2 Comparison of protease activity between two strains of actinomycetes

图3 3株放线菌的酯化酶活力比较Fig.3 Comparison of esterification enzyme activity of three strains of actinomycetes
A2麸曲的酯化力为(26.0±0.8)mg/(g·100 h),显著高于 A1、A3的酯化力(P<0.05);表明 A2菌株制作的麸曲更有利于白酒生香。
2.2 3株放线菌与丁酸菌共酵产酸结果比较
丁酸是丁酸乙酯的前体物质,窖内的丁酸可以与乙醇酯化生成丁酸乙酯(白酒中四大酯之一),丁酸含量的增加能够提高白酒中丁酸乙酯的含量;同时丁酸也是己酸合成的中间产物[24]。
本试验比较研究了3株放线菌与丁酸菌共酵后的丁酸产量,对共酵培养液中的丁酸含量利用气相色谱质谱联用仪以乙酸丁酯为内标,半定量测定,结果如图4所示。
由图4可知,在添加放线菌菌液后,试验组的丁酸含量都超过1 000 mg/L,并且A1、A2、A3试验组丁酸含量都显著高于对照组(P<0.05),说明放线菌的共培养可以促进丁酸菌产酸。
2.3 添加放线菌液的固态发酵结果分析
2.3.1 酒醅酒精含量分析
不同试验组酒醅酒精含量测定结果见图5。

图4 对照组与试验组共酵液的丁酸含量比较Fig.4 Comparison of butyric acid content between control group and experimental group
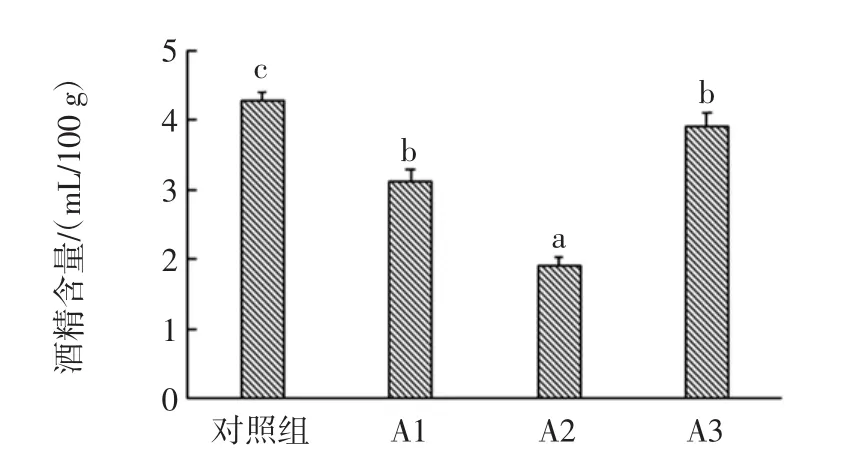
图5 对照组与试验组的酒精含量比较Fig.5 Comparison of alcohol content between control group and experimental group
由图5可知,试验组的酒精度均显著低于对照组(P<0.05),试验组酒精度的下降可能是由于放线菌的抑菌作用,而使酵母菌产酒精代谢受到抑制,酒精含量明显降低,这与杜海[25]的研究结果一致。杜海发现,同一酿造环境中,链霉菌的生长代谢对酿造功能微生物有不同程度的抑制作用,如对酿酒酵母、异常毕赤酵母等具有明显抑制作用。即链霉菌对产酒有一定的抑制作用。而与刘鸿[26]研究结果有所区别,可能是选用的试验菌株和菌液添加量不同导致的。
2.3.2 酒醅酸度分析
多种有机酸是白酒中重要呈香呈味物质及前体物质,酸类物质的增加有利于提高酯类含量,但酸度过高也会有不利的影响[27]。本试验研究了添加放线菌对酒醅酸度的影响,试验测得的酸度为总酸度,反映的是窖(坛)内发酵产生有机酸的情况。结果如图6所示。
由图6可知,3个试验组的酒醅酸度都显著高于对照组(P<0.05),且各试验组均差异显著。结合酸度与酒精度分析发现,两者对应试验组的酸度和酒精度含量呈相反状态,表明产酒精代谢途径被抑制,但可能变相促进了酸的形成。这与共酵结果相似,说明添加放线菌可能能够提高共酵菌株产酸能力。
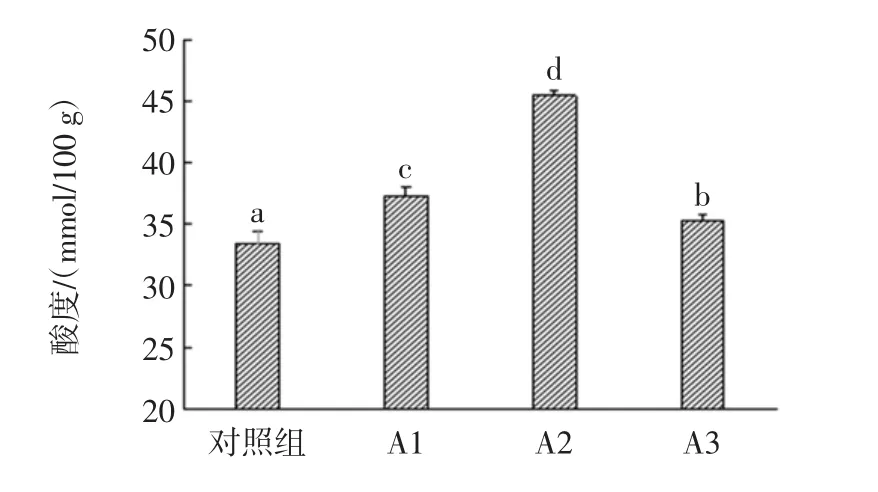
图6 对照组与试验组的酸度比较Fig.6 Comparison of acidity between control group and experimental group
2.3.3 酒醅还原糖与淀粉含量分析
对照组与试验组的还原糖含量比较见图7;对照组与试验组的淀粉含量比较见图8。
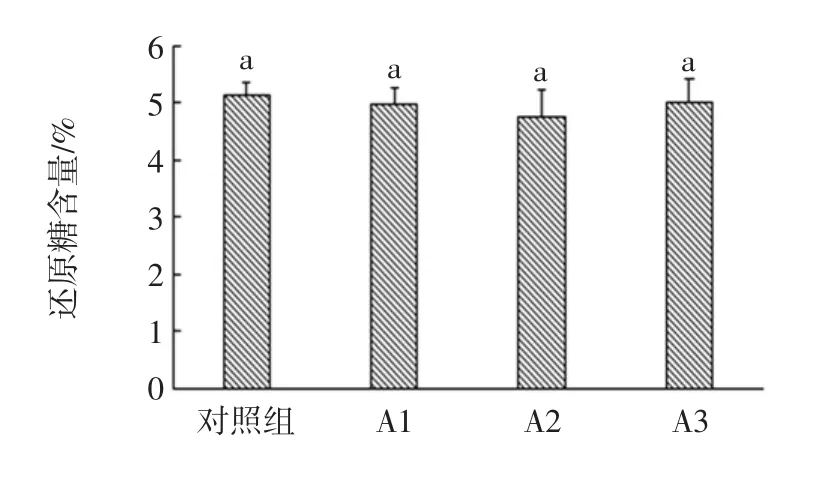
图7 对照组与试验组的还原糖含量比较Fig.7 Comparison of reducing sugar content between control group and experimental group
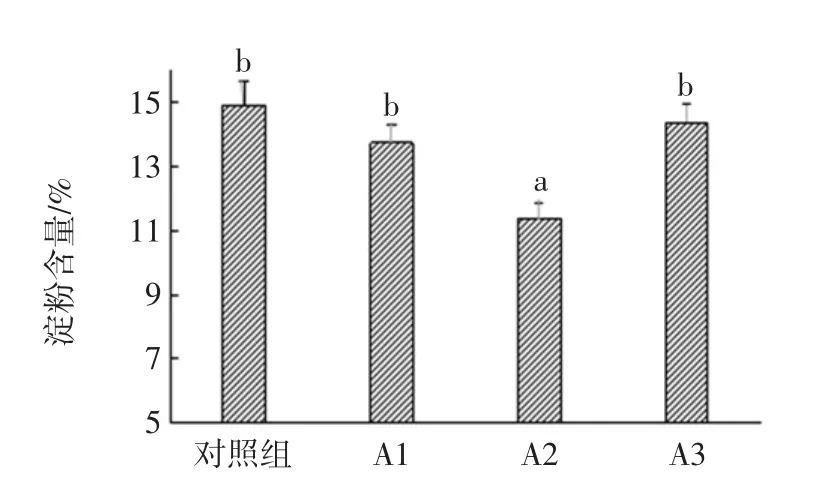
图8 对照组与试验组的淀粉含量比较Fig.8 Comparison of starch content between control group and experimental group
在发酵过程中,原料中的淀粉首先被大曲中的或微生物产生的糖化酶水解成可发酵性糖,可发酵性糖再被微生物利用,生长代谢产生醇、酸、醛、酯等物质。由图7和图8可知:各组试验还原糖差异不显著(P>0.05),A2 组淀粉含量较对照组差异显著(P<0.05),而其他3组的淀粉含量差异不显著。对于这一现象,结合酒精度和酸度分析:A2的酶活较强,能够更多地降解淀粉生成可发酵性糖;放线菌链霉菌属有一定的抑制产酒的作用[25],使得实验组产酒率降低;在抑制产酒的基础上,可发酵性糖被酸代谢途径转化成大量的酸类物质,同时在酯化酶作用下酸醇酯化,消耗酸与醇生成各种酯类物质。
2.3.4 酒醅挥发性产物分析
通过固相微萃取提取酒醅中的挥发性成分,并用气相色谱质谱联用仪进行检测,以乙酸丁酯为内标进行半定量测定挥发性成分含量,检测结果见表1。
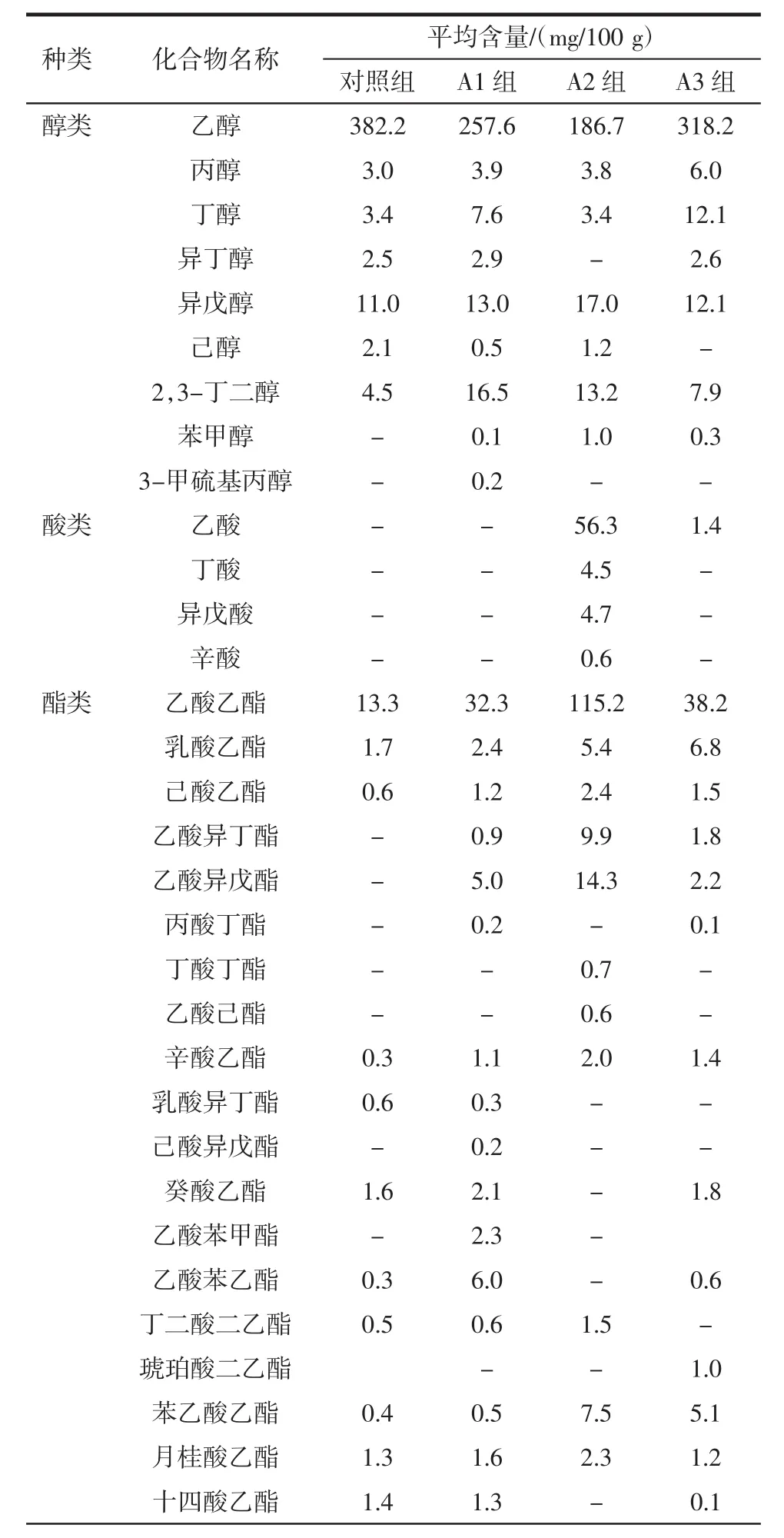
表1 酒醅挥发性成分种类与含量Table 1 The species and content of volatile components in fermented grains
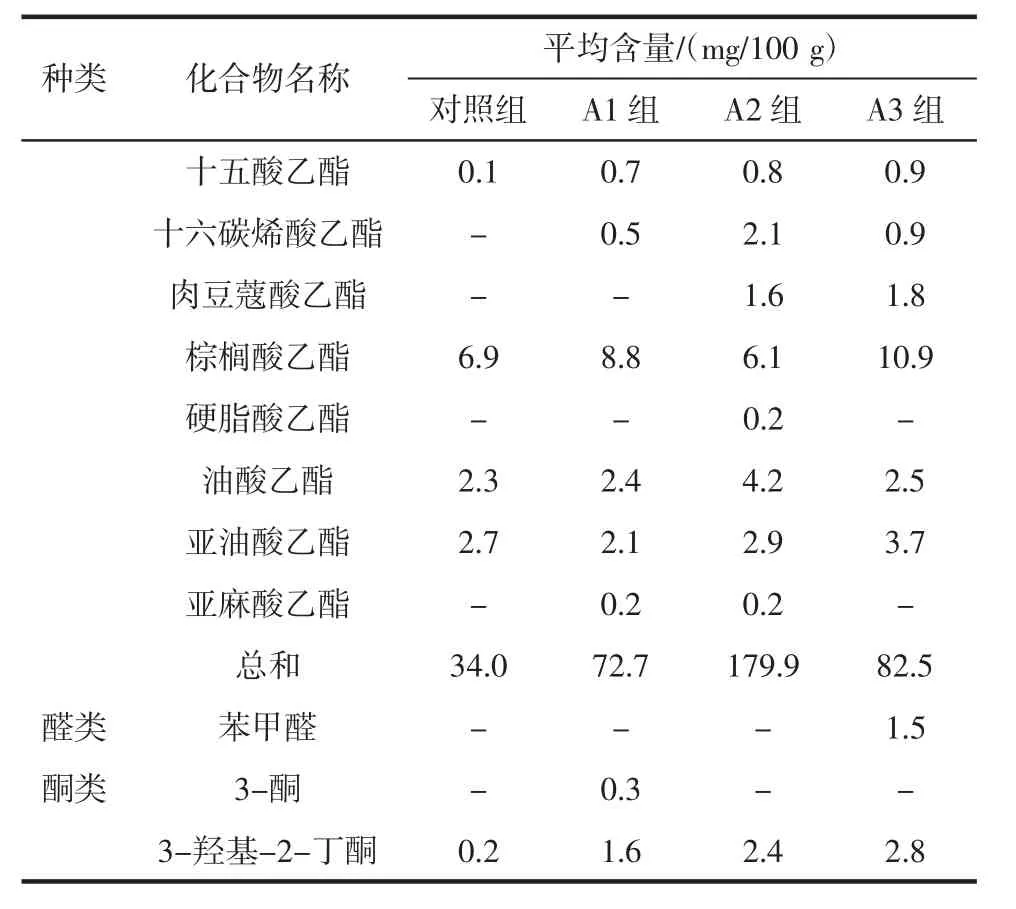
续表1 酒醅挥发性成分种类与含量Continue table 1 The species and content of volatile components in fermented grains
由表1可知,添加了放线菌液的酒醅挥发性成分种类都多于未添加菌液的对照组:A1组>A2组>A3组>对照组。
总酯是衡量浓香型大曲酒基酒质量的重要指标,主要是由己酸乙酯、乙酸乙酯、乳酸乙酯构成,其中己酸乙酯是主体香味成分[28]。可以看出添加放线菌后乙酸乙酯、乳酸乙酯、己酸乙酯含量都显著高于对照组(P<0.05),A2 组更为明显,其乙酸乙酯、乳酸乙酯、己酸乙酯含量分别为115.2、5.4、2.4 mg/100 g,这可能是由于添加放线菌后窖内酸度的增加或者是放线菌产生的酯化酶的作用使得酯类物质含量增加。并且A2组的总酯含量最高,对白酒的香味贡献更加明显。
3-羟基-2-丁酮与2,3-丁二醇是白酒中重要的风味成分,是体现浓香型基酒品质的重要指标。3-羟基-2-丁酮与2,3-丁二醇的含量越高,会使得白酒更加醇厚、香甜。此外,高含这两种成分的基酒可以用作调味酒[29]。试验组中两种成分的含量都显著高于对照组(P<0.05)。且各组试验均未检出土味素,可能是由于后期坛内空气被消耗,酸度升高而使放线菌的生长受到抑制,未进入后期的次级代谢过程[14]。
对照组与试验组的乙酸乙酯与总酯含量比较见图9。
对照组与试验组的乳酸乙酯和己酸乙酯含量比较见图10。
对照组与试验组的3-羟基-2-丁酮含量和2,3-丁二醇含量比较见图11。
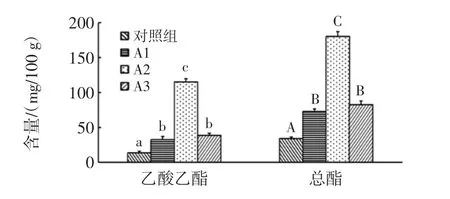
图9 对照组与试验组的乙酸乙酯与总酯含量比较Fig.9 Comparison of ethyl acetate and total ester content between control group and experimental group
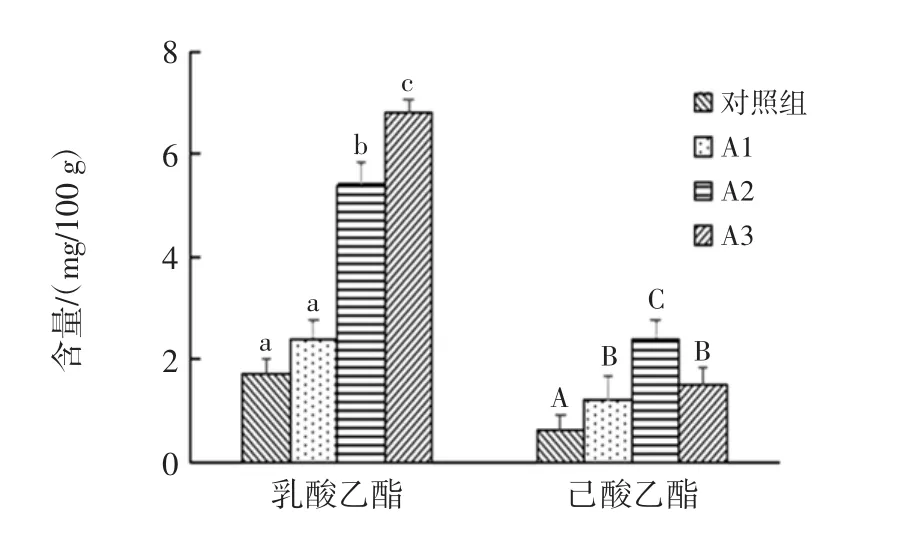
图10 对照组与试验组的乳酸乙酯和己酸乙酯含量比较Fig.10 Comparison of ethyl lactic acid and ethyl caproate between control group and experimental group
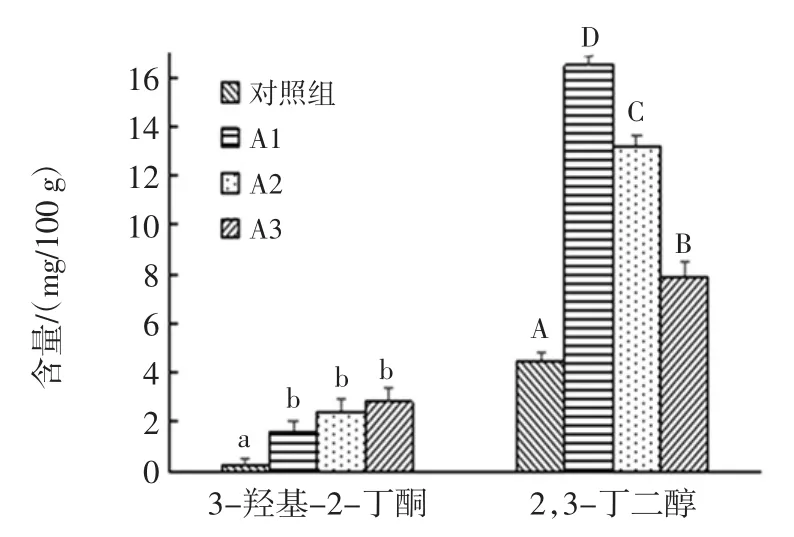
图11 对照组与试验组的3-羟基-2-丁酮含量和2,3-丁二醇含量比较Fig.11 Comparison of 3-hydroxyl-2-butanone content and 2,3-butanediol content between the control group and the experimental group
3 小结
对3株放线菌的产酶能力进行研究,结果表明,窖泥中的放线菌具备一定产酿酒相关酶的能力。白色链霉菌A1、桑氏链霉菌A2的麸曲糖化酶活力分别为(774.2±13.6)、(661.8±10.2)U/g,蛋白酶活力分别达到了(129.1±2.3)、(146.3±1.6)U/g,表明白色链霉菌和桑氏链霉菌有较强的淀粉水解和蛋白质分解能力,应用于生产可能能够提高原料的利用率[23]。桑氏链霉菌的麸曲酯化酶活力达到(26.0±0.8)mg/(g·100 h),产酯化酶能力显著高于其他菌株,在生产中可能可以提高基酒的酯类含量。
共酵试验发现,放线菌能显著促进丁酸菌产酸(P<0.05),对于调节窖内酸度以及提供酒体香味前体物质有重要作用。通过固态发酵产酒试验综合考察3株放线菌对白酒酿造的影响,结果发现添加放线菌菌种液的试验组酒醅挥发物成分高于未添加菌种的酒醅,酸类和酯类等香味成分更为丰富,如3-羟基-2-丁酮与2,3-丁二醇的含量都显著大于对照组(P>0.05);试验组酒精含量显著低于对照组(P<0.05),但试验组酸度更高,并且总酯、乙酸乙酯、乳酯乙酯、己酸乙酯含量均显著提高,可能是放线菌对酵母有抑制产酒的作用,这与杜海[25]的研究结果相符合,另外,可能是在酯化酶的作用下,醇酸酯化,使得乙醇被消耗。在酒醅成分分析中,没有发现土味素,可能是随着发酵进行,乙醇浓度与酸度升高,产土味素机制被抑制[30]。
本研究表明,放线菌在白酒酿造过程起一定作用,能够提高白酒的风味与品质。相对而言,桑氏链霉的发酵性能更好,能够生成更多的香味成分,总酯含量最高,使得基酒酒体香味浓郁,对白酒香型形成可能有更多的贡献价值。本研究为放线菌在白酒酿造中的特性研究及应用提供了一定的参考,但放线菌在白酒酿造中的具体代谢途径与能量循环,还需要进一步探索。

