雪莲培养物保健食品的抗氧化功能研究
廉翠翠,查圣华,王俊亮,张宏
(北京同仁堂健康药业股份有限公司研发中心,北京100085)
自由基可导致人体亚健康状态并引发多种疾病[1],因此,适当补充抗氧化食品,清除自由基,是目前保健食品的市场热点。研究表明,雪莲能有效去除自由基,起到抗疲劳、调节免疫的作用[2-4]。雪莲培养物是以天山雪莲为种子,运用细胞培养技术生产,与天然雪莲化学成份相似,功效相近[5],含有大量的抗氧化类物质,如黄酮和多酚等[6],具有较强的抗炎、镇痛、抗疲劳等作用[7]。目前有关雪莲培养物的抗氧化研究,多数是以单一的雪莲培养物为原料,研究仅限于动物实验,而雪莲培养物保健食品在人体内的抗氧化作用少有研究。
本文针对雪莲培养物与其他具有抗氧化功能的原料:海洋鱼胶原蛋白、针叶樱桃、透明质酸钠,复配制成保健食品。其中,海洋鱼胶原蛋白是以海洋鱼皮为原料,用酶解法生产的海洋胶原低聚肽混合物。研究表明[8],海洋生物活性肽具有抗氧化、降血压、降低胆固醇等多种生理活性,因小分子低聚肽易被人体消化、吸收和利用,在人体氧化平衡和脂质代谢体系中的功能显著。透明质酸(hyaluronic acid,HA)是一种天然的高分子直链黏多糖,商品HA一般为其钠盐。透明质酸具有很好的抗氧化性。研究发现[9],体内产生的过量自由基可通过HA的降解来清除,保护机体免受其害。西印度樱桃,又名针叶樱桃,维生素C的含量高达1 215 mg/100 g~3 024 mg/100 g,是番石榴、木瓜及草莓等水果的10倍~50倍,为极佳的天然维生素C来源[10]。维生素C作为天然的自由基清除剂,可以直接或间接消除自由基[11],起到抗氧化的作用。基于以上分析,此保健食品各原料协同作用,可充分增强超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶活性,减少自由基生成,从而发挥良好的抗氧化作用,具有生产工艺简单、质量稳定、吸收好和服用量小的优点,为雪莲培养物保健食品的抗氧化功能研究提供参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
雪莲培养物抗氧化保健食品,规格10 g/袋,置阴凉干燥处保存。
1.1.2 试剂
生理盐水、血液过氧化脂质(malondialdehyde,MDA)、蛋白质羰基、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽(glutathione,GSH)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测定试剂盒:南京建成生物工程研究所。
1.2 仪器与设备
URIT-800半自动生化分析仪:桂林优利特电子集团有限公司;FA1604N电子分析天平:上海菁华科技仪器有限公司;TG16KR低温离心机:长沙东旺实验仪器有限公司;WB-2010A恒温水浴箱:天津奥特赛恩斯仪器有限公司;Vortex-Genie2旋涡混匀器:美国Scientific Industries公司;iE 12数字式心电图机:深圳邦健电子有限公司;DHT01医用X线透视机:上海东和电器技术有限公司;KX2800全数字B型超声诊断仪:徐州市凯信电子设备有限公司;BC-2800血球计数仪:深圳迈瑞生物医疗电子股份有限公司;YXY-61医用电子血压计:北京东华原医疗设备有限公司。
1.3 方法
1.3.1 试验对象
1.3.1.1 实验动物及环境
选用广西医科大学动物中心繁殖的SPF级10月龄以上 SD 种雄性大鼠 40只,体重(561.3±39.6)g,实验动物生产许可证号:SCXK(桂)2009-0002,实验动物质量合格证号:0006691。动物实验室为屏障系统,使用许可证号:SYXK(桂)2011-0005。动物实验室温度22℃~25℃,相对湿度:55%~70%。
1.3.1.2 人体试食试验受试对象
受试者纳入标准为年龄在40岁~65岁,身体健康状况良好,志愿受试并保证配合者。本次试验初始共有120位复合纳入条件者志愿参加试验。受试者排除标准:妊娠或哺乳期妇女及对本品过敏者;合并有心、脑血管、肝、肾和造血系统等严重疾病及精神病患者;短期内服用与受试功能有关的物品,影响到对结果的判断者;不符合纳入标准,未按规定使用受试样品,无法判定功效或资料不全影响功效或安全性判断者。
1.3.2 服用剂量
人口服推荐用量为每人(成人)每日1次,每次1袋,成人体重按60 kg计算,折合剂量为166.7 mg/kg BW。
1.3.3 试验分组设计
1.3.3.1 动物实验剂量选择与受试物给予方式
根据样品的人体推荐量设3 334、1 667、834 mg/kg BW(分别相当于人体推荐用量的20、10、5倍)3个剂量组,同时设一个阴性对照组,每组10只动物。称取雪莲培养物抗氧化保健食品66.68、33.34、16.68 g,各加纯水至 200 mL,混匀,配成 333.4、166.7、83.4 mg/mL 浓度混悬液,采用经口方式,分别给予相应剂量组动物灌胃,灌胃体积为1.0 mL/100 g BW,阴性对照组给予等体积的纯水,每天灌胃1次,连续灌胃30 d。
1.3.3.2 人体试食试验设计与分组
采用自身和组间两种对照设计。以受试者血液丙二醛含量为主,兼顾超氧化物歧化酶和谷胱甘肽过氧化物酶活性进行分层,然后随机分为试食组和对照组,每组各60人;尽可能考虑影响结果的主要因素如年龄、性别、生活饮食习惯等,进行均衡性检验,以保证组间的可比性。试食组试食样品每人每日服食1次,每次1袋,连续服用3个月,对照组采用空白对照。试验期间两组人群原生活、饮食习惯不变。
1.4 功效指标测定
1.4.1 动物实验指标测定
受试老龄大鼠在SPF级动物实验室内喂养观察7 d,未见异常后眼内眦取血测定血清丙二醛含量。根据MDA含量将大鼠随机分成4个组,每组10只,并适当调整,使各组的平均体重也尽可能的均衡。按1.0 mL/100 g BW的体积,分别给予各剂量组动物灌胃相应浓度的样品溶液,阴性对照组给予等体积的纯水,每天灌胃1次,连续灌胃30 d,然后处死动物,取血、肝、脑组织进行观察指标测定。
1)大鼠血清及肝、脑组织匀浆液中LPO含量测定(以MDA含量计)。
2)大鼠血清及肝、脑组织匀浆液中蛋白质氧化产物(蛋白质羰基)含量测定。
3)大鼠血清及肝、脑组织匀浆中抗氧化酶(SOD)活力测定。
4)大鼠血清及肝、脑组织匀浆中抗氧化物质(GSH)含量测定。
1.4.2 人体试食试验功效性指标
1.4.2.1 过氧化脂质含量
观察试验前后MDA的变化及MDA下降百分率。

1.4.2.2 超氧化物歧化酶活性
观察试验前后SOD的变化及SOD升高百分率。

1.4.2.3 谷胱甘肽过氧化物酶活性
观察试验前后GSH-Px的变化及GSH-Px升高百分率。

1.5 数据统计
实验数据用方差分析进行统计处理。自身对照资料采用配对t检验,两组均数比较采用成组t检验。百分率用χ2检验进行检验。在实验前两组间比较差异无显著性的前提下,可进行试验后两组间比较。
2 结果与分析
2.1 动物实验结果
2.1.1 样品对大鼠体重的影响
各组大鼠的体重变化见表1。
表1 各组大鼠的体重变化(±s)Table 1 Change of rat weight in each group(±s)
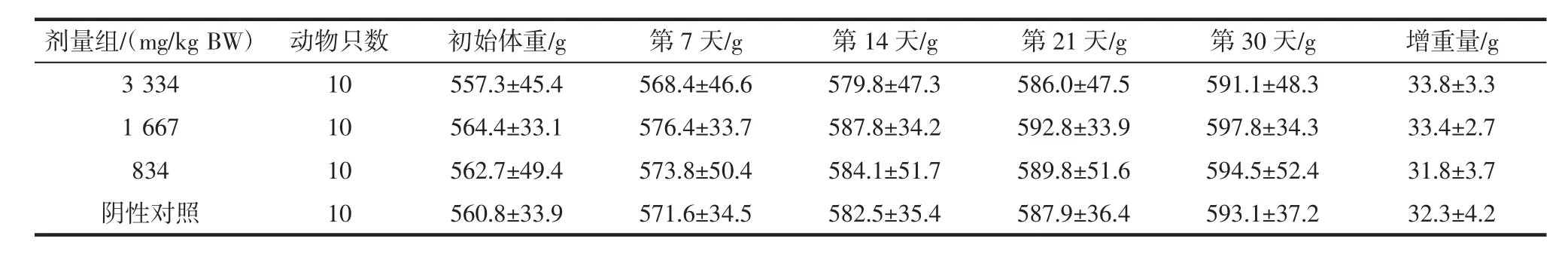
表1 各组大鼠的体重变化(±s)Table 1 Change of rat weight in each group(±s)
注:表中各组大鼠的体重及增重量比较,差异均无显著性(P>0.05)。
剂量组/(mg/kg BW)动物只数初始体重/g第7天/g第14天/g第21天/g第30天/g增重量/g 3 334 10 557.3±45.4 568.4±46.6 579.8±47.3 586.0±47.5 591.1±48.3 33.8±3.3 1 667 10 564.4±33.1 576.4±33.7 587.8±34.2 592.8±33.9 597.8±34.3 33.4±2.7 834 10 562.7±49.4 573.8±50.4 584.1±51.7 589.8±51.6 594.5±52.4 31.8±3.7阴性对照 10 560.8±33.9 571.6±34.5 582.5±35.4 587.9±36.4 593.1±37.2 32.3±4.2
由表1可知,实验前各组大鼠的体重无明显差异,实验结束样品各剂量组的大鼠体重及增重量与阴性对照组比较,差异均无显著性(P>0.05),表明该样品对老龄大鼠体重无明显影响。
2.1.2 样品对大鼠血清及组织过氧化脂质(LPO)含量的影响
各组大鼠的血清和脑、肝组织过氧化脂质含量见表2。
表2 各组大鼠的血清和脑、肝组织过氧化脂质(LPO以MDA计)含量(±s)Table 2 Lipid peroxide(LPO,calculated as MDA)content in serum,brain and liver tissues of rats in each group(±s)

表2 各组大鼠的血清和脑、肝组织过氧化脂质(LPO以MDA计)含量(±s)Table 2 Lipid peroxide(LPO,calculated as MDA)content in serum,brain and liver tissues of rats in each group(±s)
注:*表示具有显著性差异(P<0.05)。
剂量组/(mg/kg BW)动物只数试验前血清LPO/(nmol/mL)试验终肝组织LPO/(nmol/g组织)3 334 10 4.96±0.64 5.41±0.57* 158.2±31.9 479.8±67.8*1 667 10 4.50±0.43 5.92±0.49 155.7±40.5 504.1±92.4 834 10 5.09±0.65 6.23±0.77 172.3±49.6 540.4±107.1阴性对照 10 5.05±0.56 6.33±0.77 186.3±46.1 598.3±77.7试验终血清LPO/(nmol/mL)试验终脑组织LPO/(nmol/g组织)
由表2可知,实验前各组动物的血清LPO含量均衡,各组之间差异无显著性(P>0.05)。试验终末,样品各剂量组大鼠的血清、脑及肝组织的过氧化脂质(LPO)含量均低于阴性对照组,其中高剂量组的血清及肝组织的LPO含量与阴性对照组的差异具有显著性(P<0.05),表明该样品具有降低老龄大鼠血清和肝组织中的过氧化脂质含量的作用。
2.1.3 样品对大鼠血清及组织蛋白质羰基含量的影响
各组大鼠的血清和脑、肝组织蛋白质羰基含量见表3。
表3 各组大鼠的血清和脑、肝组织蛋白质羰基含量(±s)Table 3 Protein carbonyl content in serum,brain and liver tissues of rats in each group(±s)

表3 各组大鼠的血清和脑、肝组织蛋白质羰基含量(±s)Table 3 Protein carbonyl content in serum,brain and liver tissues of rats in each group(±s)
剂量组/(mg/kg BW)动物只数血清蛋白质羰基/(nmol/mgprot)脑组织蛋白质羰基/(nmol/mgprot)肝组织蛋白质羰基/(nmol/mgprot)3 334 10 2.64±0.84 8.99±1.30 10.89±2.07 1 667 10 2.96±0.65 9.34±1.75 11.39±3.50 834 10 3.13±0.73 10.07±1.30 12.15±2.89阴性对照 10 3.20±0.57 10.36±1.59 13.11±2.16
由表3可知,样品各剂量组大鼠的血清、脑及肝组织的蛋白质羰基含量均低于阴性对照组,但各剂量组的血清、脑及肝组织的蛋白质羰基含量与阴性对照组的比较差异均无显著性(P>0.05),表明该样品对老龄大鼠血清及组织中的蛋白质羰基含量无明显的影响。
2.1.4 样品对大鼠血清及组织中超氧化物歧化酶(SOD)活力的影响
各组大鼠的血清及肝、脑组织SOD活性见表4。
表4 各组大鼠的血清及肝、脑组织SOD活性(±s)Table 4 SOD activity in serum,liver and brain tissues of rats in each group(±s)

表4 各组大鼠的血清及肝、脑组织SOD活性(±s)Table 4 SOD activity in serum,liver and brain tissues of rats in each group(±s)
注:*表示具有显著性差异(P<0.05)。
剂量组/(mg/kg BW)动物只数血清SOD/(U/mL)脑组织SOD/(U/g组织)肝组织SOD/(U/g组织)3 334 10 235.6±30.8* 950.5±53.2 1 321.6±105.9*1 667 10 214.6±25.3 934.2±71.7 1 200.8±171.8 834 10 197.8±41.7 925.4±50.2 1 159.8±221.5阴性对照 10 184.9±49.3 884.4±132.8 1 097.0±116.6
由表4可知,试验终末,样品各剂量组大鼠的血清、肝及脑组织中的SOD活力均高于阴性对照组,其中的高剂量组血清和肝组织的SOD活力与阴性对照组的差异具有显著性(P<0.05),表明该样品可以提高老龄大鼠的血清和肝组织中的超氧化物歧化酶(SOD)的活性。
2.1.5 样品对大鼠血清及组织中谷胱甘肽(GSH)含量的影响
各组大鼠的血清及脑、肝组织GSH含量见表5。
由表5可知,试验终末,样品各剂量组大鼠的血清、肝及脑组织中GSH含量均高于阴性对照组,且高剂量组血清和脑组织的GSH含量与阴性对照组的差异具有极显著性(P<0.01),表明该样品具有提高老龄大鼠血清和脑组织中的谷胱甘肽(GSH)含量的作用。
表5 各组大鼠的血清及脑、肝组织GSH含量(±s)Table 5 GSH content in serum,brain and liver tissues of rats in each group(±s)

表5 各组大鼠的血清及脑、肝组织GSH含量(±s)Table 5 GSH content in serum,brain and liver tissues of rats in each group(±s)
注:**表示具有极显著差异(P<0.01)。
剂量组/(mg/kg BW)动物只数血清GSH/(μmol/L)脑组织GSH/(μmol/g组织)肝组织GSH/(μmol/g组织)3 334 10 60.14±13.85** 1.55±0.19** 5.58±0.71 1 667 10 49.44±14.68 1.45±0.13 5.45±0.75 834 10 42.68±14.16 1.38±0.16 5.08±0.81阴性对照 10 10.99±9.10 1.31±0.10 4.88±0.87
2.1.6 动物实验小结
分别以3 334、1 667、834 mg/kg BW剂量(分别相当于人体推荐用量的20、10、5倍)的雪莲培养物抗氧化保健食品给予老龄大鼠连续灌胃30 d,能降低大鼠血清和肝组织中过氧化脂质(LPO)含量,提高大鼠血清和肝组织中的超氧化物歧化酶(SOD)的活性,提高大鼠血清和脑组织中的谷胱甘肽(GSH)的含量,对大鼠的体重无明显影响。动物实验结果判定:过氧化脂质含量、蛋白质羰基、抗氧化酶活性、抗氧化物质4项指标中3项指标阳性,可判定该受试样品抗氧化实验结果阳性。据此判定,该样品具有抗氧化功能。
2.2 人体试食试验结果
2.2.1 一般情况
试食前两组人群基本情况见表6。
表6 试食前两组人群基本情况(±s)Table 6 General information of the two groups before the test(±s)

表6 试食前两组人群基本情况(±s)Table 6 General information of the two groups before the test(±s)
组别人数性别年龄/岁血液MDA/(nmol/mL)血液SOD/(U/mL)血液GSH-Px(U/mL)男 女对照组 58 30 28 54.5±6.8 4.59±0.76 46.8±8.0 118.9±16.3试食组 56 28 28 54.1±7.6 4.58±0.80 47.1±9.2 117.5±18.9
由表6可知,实验中失访6例,失访率为5.0%,最终对照组和试食组分别58例和56例进入有效统计。试食前,试食组与对照组人群的年龄、精神状况、睡眠状况、饮食情况等基本一致;两组人群的胸部透视、心电图及腹部B超检查结果均未见明显异常。试食前两组人群的血液过氧化脂质含量、超氧化物歧化酶活性和谷胱甘肽过氧化物酶活性比较,均没有明显差异(P>0.05)。
2.2.2 样品对血液过氧化脂质含量的影响
试食前后两组人群的血液过氧化脂质含量变化见表7。
由表7可知,试食前两组人群的血液过氧化脂质(MDA)含量无明显差异(P>0.05)。试食后,试食组MDA含量平均下降13.93%,极显著大于对照组的-0.65%(P<0.01);试食组自身前后比较及试食后与对照组的组间比较差异均有极显著性(P<0.01);对照组自身比较差异则无显著性(P>0.05),表明该样品具有降低试食者的血液过氧化脂质含量的作用。
表7 试食前后两组人群的血液过氧化脂质含量变化(±s)Table 7 Change in blood lipid peroxide content in the two groups before and after the test(±s)

表7 试食前后两组人群的血液过氧化脂质含量变化(±s)Table 7 Change in blood lipid peroxide content in the two groups before and after the test(±s)
注:**表示试食组与对照组组间比较,具有极显著差异(P<0.01);##表示试食组自身前后比较,具有极显著差异(P<0.01)。
组别人数试食前MDA/(nmol/mL)试食后MDA/(nmol/mL)MDA下降值/(nmol/mL)下降率/%对照组 58 4.59±0.76 4.61±0.77 -0.03±0.18 -0.65±4.12试食组 56 4.58±0.80 3.94±0.69**## 0.64±0.28** 13.93±5.23**
2.2.3 样品对血液超氧化物歧化酶(SOD)活性的影响
试食前后两组人群的血液超氧化物歧化酶活性变化见表8。
由表8可知,试食前两组人群的血液超氧化物歧化酶(SOD)活性无明显差异(P>0.05)。试食后,试食组SOD活性平均升高10.39%,极显著大于对照组的0.03%(P<0.01);试食组自身前后比较及试食后与对照组的组间比较差异均具有极显著性(P<0.01);对照组自身比较差异则无显著性(P>0.05),表明该样品具有升高试食者血液SOD活性的作用。
表8 试食前后两组人群的血液超氧化物歧化酶活性变化(±s)Table 8 Change in blood superoxide dismutase activity in the two groups before and after the test(±s)

表8 试食前后两组人群的血液超氧化物歧化酶活性变化(±s)Table 8 Change in blood superoxide dismutase activity in the two groups before and after the test(±s)
注:**表示试食组与对照组组间比较,具有极显著差异(P<0.01);##表示试食组自身前后比较,具有极显著差异(P<0.01)。
组别人数试食前SOD/(U/mL)试食后SOD/(U/mL)SOD升高值/(U/mL)升高率/%对照组 58 46.8±8.0 46.9±7.9 0.09±0.92 0.30±2.12试食组 56 47.1±9.2 52.0±10.1**## 4.85±1.90** 10.39±3.71**
2.2.4 样品对血液谷胱甘肽过氧化物酶(GSH-Px)活性的影响
试食前后两组人群的血液谷胱甘肽过氧化酶活性变化见表9。
由表9可知,试食前两组人群的血液谷胱甘肽过氧化物酶(GSH-Px)含量无明显差异(P>0.05)。试食后,试食组GSH-Px活性平均升高9.92%,极显著大于对照组的-0.14%(P<0.01);试食组自身前后比较及试食后与对照组的组间比较差异均有极显著性(P<0.01),对照组自身比较差异则无显著性(P>0.05),表明该样品具有升高试食者血液GSH-Px活性的作用。
表9 试食前后两组人群的血液谷胱甘肽过氧化酶活性变化(±s)Table 9 Change in blood glutathione peroxidase activity in the two groups before and after the test(±s)

表9 试食前后两组人群的血液谷胱甘肽过氧化酶活性变化(±s)Table 9 Change in blood glutathione peroxidase activity in the two groups before and after the test(±s)
注:**表示试食组与对照组组间比较,具有极显著差异(P<0.01);##表示试食组自身前后比较,具有极显著差异(P<0.01)。
组别人数试食前GSH-Px/(U/mL)试食后GSH-Px/(U/mL)GSH-Px升高值/(NU/mL)升高率/%对照组 58 118.9±16.3 118.8±16.5 -0.15±1.34 -0.14±1.16试食组 56 117.5±18.9 129.1±20.8**## 11.59±4.52** 9.92±3.50**
2.2.5 样品对人体各项指标的影响
试验前后,试食样品组人群的血红细胞数、白细胞数、血红蛋白、大小便常规、血清总蛋白、白蛋白、谷草转氨酶、谷丙转氨酶、尿素氮、肌酐、血糖等各项检查结果均在正常值范围内,且试验前后无明显变化,表明该样品对受试者健康无不良影响。试验过程中试食样品者均未出现恶心、胀气、腹泻及过敏等不良反应。
2.2.6 人体试食试验小结
试食组人群连续服用雪莲培养物抗氧化保健食品3个月后,血液MDA含量平均下降13.93%,极显著大于对照组的-0.65%(P<0.01),试食组自身前后比较及试食后与对照组的组间比较差异均有极显著性(P<0.01);试食组人群血液中SOD活性平均升高10.39%,极显著大于对照组的 0.30%(P<0.01),试食组自身前后比较及试食后与对照组的组间比较差异均有极显著性(P<0.01);试食组人群血液GSH-Px活性平均升高9.92%,极显著高于对照组的-0.14%(P<0.01),试食组自身前后比较及试食后与对照组的组间比较差异均有极显著性(P<0.01);而对照组人群的MDA、SOD及GSH-Px,试验前后自身比较差异均无显著性(P>0.05)。人体试食试验结果判定:各功效观察指标试验前后自身比较和试食后组间比较有统计学意义,方可判定该指标阳性。过氧化脂质含量、超氧化物歧化酶活性、谷胱甘肽过氧化物酶活性3项指标中任两项实验结果阳性,可判定该受试样品具有抗氧化功能。据此判定,该样品具有抗氧化功能。
3 结论
本文针对雪莲培养物与海洋鱼胶原蛋白、针叶樱桃、透明质酸钠复配制成的保健食品的抗氧化功能进行研究。其中,海洋鱼胶原蛋白具有很好的羟基自由基清除能力、超氧阴离子自由基清除能力及还原能力[8];针叶樱桃果粉含有的大量维生素C具有清除自由基、保护细胞膜完整性、维持酶活性的功能,可促进机体有氧代谢的进行[11];雪莲培养物能升高细胞中谷胱甘肽过氧化物酶(GSH-Px)活性和超氧化物歧化酶(SOD)活性,能显著降低细胞中的脂质氧化终产物丙二醛(MDA)和自由基[5];透明质酸钠在体内通过自身的降解,清除过量的自由基[6]。并且这几种原料都为食品级原料,在食品、保健品等领域已被广泛使用,安全性和有效性都已被证实。动物实验证明:分别以3 334、1 667、834 mg/kg BW剂量的雪莲培养物抗氧化保健食品给予老龄大鼠连续灌胃30 d,能降低大鼠血清和肝组织中过氧化脂质(LPO)含量,提高超氧化物歧化酶(SOD)的活性,提高大鼠血清和脑组织中的谷胱甘肽(GSH)的含量。人体试验证明:口服用量每日1次,每次1袋(10 g/袋),连续服用3个月后,试食组人群血液MDA含量平均下降13.93%,血液中SOD活性平均升高10.39%,血液GSH-Px活性平均升高9.92%,试食组自身前后比较及试食后与对照组的组间比较差异均有极显著性(P<0.01)。综上所述,本研究验证了雪莲培养物保健食品的抗氧化功能,并为雪莲培养物保健食品的开发提供了参考依据。

