广西典型高砷区蜈蚣草根围丛枝菌根真菌多样性研究
蔡榕树,王艳,孟德凯,赵宁宁,顾明华,王学礼*
1.广西大学农学院/广西农业环境与农产品安全重点实验室,广西 南宁 530004;2.广西农业科学院生物技术研究所,广西 南宁 530007
砷污染是中国突出且亟待解决的环境问题,其污染现状十分严峻(史振环等,2015)。广西南丹县砷总储量和采出量均居全国前列,砷渣存量2.7×105t,占地面积高达4.1×105m2,导致大范围的土壤砷污染,农产品安全出现问题,威胁人类生命安全,砷污染治理刻不容缓(Sarwar et al.,2017;胡志刚等,2018)。植物修复技术因具有经济有效、生态协调、环境友好等特点而颇受青睐(段志斌等,2016),蜈蚣草(Pteris vittataL.)是砷超富集植物,具有生长快、生物量大、地理分布广、适应性强的特点,在砷污染环境的修复方面具有良好的应用前景(陈同斌等,2002),但如何提高蜈蚣草的修复效率是当前面临的主要问题。许多研究表明丛枝菌根真菌(arbuscular mycorrhizal fungi)可以提高蜈蚣草的生物量及对砷的吸收转运,提高其在中轻度砷污染土壤上提取效率(赵宁宁等,2017)。搞清楚矿区特别是高砷矿区及周边蜈蚣草根区土壤AM真菌的资源状况,可为筛选出促进蜈蚣草生长及砷吸收的优良AM真菌菌株打下基础。
针对AM真菌资源调查及多样性研究方面国内已有报道。李东伟(2012)、康前(2018)在矿区植物根际中均发现了较高的AM真菌孢子密度和物种丰度,在高浓度重金属环境中,AM真菌与植物依旧可以形成良好共生关系。且但多样性调查的对象主要为当地常见的优势植物如硬毛南芥(Arabis hirsuta),白檀(Symlocos paniculata)、倒挂刺(Rosa longicuspis)等植物根区的AM真菌,国内对砷污染区AM真菌资源多样性调查鲜见报道,对于高砷地区蜈蚣草-这种特殊的超富集植物根区的 AM 真菌物种丰度、多样性等尚不清楚。因此本研究对广西南丹县砒霜厂旧址周边地区蜈蚣草根围土壤中AM真菌的多样性及群落组成进行调查,以期明确蜈蚣草根区AM真菌资源状况,研究结果将为南亚热带地区优良AM真菌菌株的筛选、重金属污染土壤的植物-微生物联合修复提供指导。
1 材料与方法
1.1 样品采集与处理
采样地点位于广西南丹县砒霜厂旧址及周边地区。属于属亚热带季风气候,年均气温16.9 ℃,年均降水量1400 mm左右。2017年6月在砒霜厂旧址及周边地区选取5个样地采集蜈蚣草系及其根围土壤。从样地1—5的海拔高度分别为802、517、567、456、462 m。样地1(S1)为对照样地,位于距砒霜厂旧址58 km的上风向区域,蜈蚣草长势良好。样地2(S2)位于三宜尾矿库旧址,蜈蚣草长势良好,根际土壤伴有少量碎石。样地3(S3)位于大福楼尾矿库,样地4(S4)位于芭林尾矿库旧址,样地5(S1)位于灰乐尾砂堆,这3个样地土壤中的砷浓度依次升高,虽然蜈蚣草长势良好,但植株较矮小,根际土壤伴有较多砂砾。每个样地3个重复,3个重复之间两两相距约50 m,每个重复随机选取3株相距3—5 m且长势良好的蜈蚣草,去掉地表大块砂石和其他杂物,用酒精消毒过的小铲沿宿主植物周围向下挖,采集土层深度为 0—20 cm范围的根系和根围土样约500 g,每个重复的根土样混合,封口标记。根样用自来水洗净保存在FAA固定液中用于测定AM真菌侵染率。根围土风干后过2 mm筛用于土壤理化性质测定、孢子分离、孢子密度统计和AM真菌鉴定。
1.2 理化性质测定
根据《土壤农化分析》(鲍士旦,2008)中所述方法测定土壤基本理化性质:土壤pH值采用酸度计(梅特勒-托利多SevevMulti型pH计)进行测定;土壤全氮采用半微量凯氏法测定;全磷采用NaOH熔融-钼锑抗比色法测定;全钾采用NaOH熔融-火焰光度法测定;土壤As总量、有效态砷含量和蜈蚣草植株As含量采用王水消解-氢化物发生原子荧光光谱法(HG-AFS,AF-610A原子荧光光谱仪,北京瑞利仪器公司)测定。
1.3 AM真菌侵染率测定
蜈蚣草根系染色处理:取出保存在 FAA固定液中的根系,用自来水冲洗,剪成0.5—1.0 cm的根段,放入10 cm带塞试管中,加20% KOH溶液,90 ℃恒温水浴1 h。去掉碱液,用自来水冲洗根段,加新配的碱性双氧水(3 mL氨水、30 mL 10% H2O、567 mL去离子水)室温下45 min,用自来水冲洗根段,加2% HCl溶液酸化5 min,去掉酸液后滴加5%醋酸墨水溶液(95 mL食醋、5 mL北京牌蓝黑墨水)于90 ℃恒温水浴30 min,倒掉染液,加清水浸泡过夜。挑选100条大小相近的根段制片,在显微镜下镜检,采用根段法进行侵染率(Ri)测定(Biermann et al.,1981):
式中,I0表示没有被侵染的总根段数,I1表示侵染率为10%的总根段数,I2—I10依次类推。
1.4 AM真菌孢子分离与密度测定
用湿筛倾析法分离AM真菌孢子。取25 g风干土样置于大烧杯中,加500 mL水,搅拌均匀,静置10 s左右,过3层筛(0.8—0.25—0.038 mm)保留下层筛面物;用清水反复冲洗下层筛面物,将筛子上的残留物收集于直径10 cm,底部标有小方格的培养皿中。在体视显微镜下统计每克风干土样中所含的AM真菌孢子数量,测定孢子密度(王幼珊等,2012)。
1.5 AM真菌孢子形态学鉴定
将经过湿筛倾析法分离的孢子进行制片,显微镜下观察孢子形态和大小、孢子的聚集方式、孢壁结构以及连孢菌丝特征,参考《VA菌根真菌鉴定手册》(Schenck et al.,1990)、国际AM真菌保藏中心(INV AM)和《中国丛枝菌根真菌资源与种质资源》(王幼珊等,2012)以及最新分类系统等的鉴定方法,对AM真菌进行种属鉴定及分类。
1.6 统计分析方法
通过分析AM真菌的孢子密度、分离频度、相对丰度、物种丰度、香农-威纳指数等来揭示AM真菌的多样性情况。
孢子密度(Spore Density,SD):

式中,m表示土壤质量;N表示孢子个数。
分离频度(Frequency,F):

式中,St表示AM真菌某属或种出现的次数;n表示土样个数。
物种丰度(Species Richness,SR):

式中,S表示AM真菌种类数目;St表示土样样本总数,即50 g蜈蚣草根际土壤样本中AM真菌的种类数。
相对丰度(Relative Abundance,RA):

式中,NS表示AM真菌某属或某种孢子数;Nt表示AM真菌总孢子数。
Shannon-Wiener指数(H):

式中,S指某样地中AM真菌的种数;Pi指某种AM真菌的孢子数占该样地所有孢子数的百分比。
实验数据的处理以及图表等由Microsoft Excel 2013完成,由SPSS 17.0统计软件进行数据统计,采用Duncan检验法进行多重比较检验处理间的差异显著性。
2 结果与分析
2.1 样地土壤及蜈蚣草的理化性质
如表1所示。从S1—S5土壤总砷含量呈递增趋势,土壤有效态砷含量也呈同样递增趋势。不同样地的土壤pH有较大差异,S2 pH为5.11,是强酸性土壤,除S2外的样地土壤呈为碱性或弱碱性。S2全氮含量显著高于其他4个样地。样点S5全磷和全钾含量均最高;样点 S1全磷和全钾含量均最低。砷污染样地的蜈蚣草砷含量显著高于对照样地,整体上随着土壤砷污染浓度的升高而升高。
2.2 AM真菌的侵染状况及孢子密度
2.2.1 AM真菌的侵染状况
如图1所示,不同样地间,蜈蚣草菌根侵染率有较大差异,其中样地1和样地5侵染率较高,分别为76.60%和82.00%;其次为样地2和样地4,侵染率依次为28.67%和20.67%;样地3侵染率最低,仅为 16.67%。从样地 1—5,菌根侵染率先降低后升高。
2.2.2 AM真菌孢子密度
如图2所示,不同样地间孢子密度差异较大,样地4孢子密度最高,为12.98 ind·g-1,依次是样地 2:6.56 ind·g-1、样地 3:3.87 ind·g-1、样地 1:2.72 ind·g-1,样地 5 孢子密度最低,仅为 0.68 ind·g-1。样地1—4孢子密度分别是样地5孢子密度的4.00、9.65、5.69、19.09倍。
2.3 AM真菌的形态学鉴定及样地分布
2.3.1 AM真菌孢子形态学分类

图1 不同样地蜈蚣草侵染率(Ri)Fig.1 The infection rate of Pteris vittata L.in different sites(Ri)
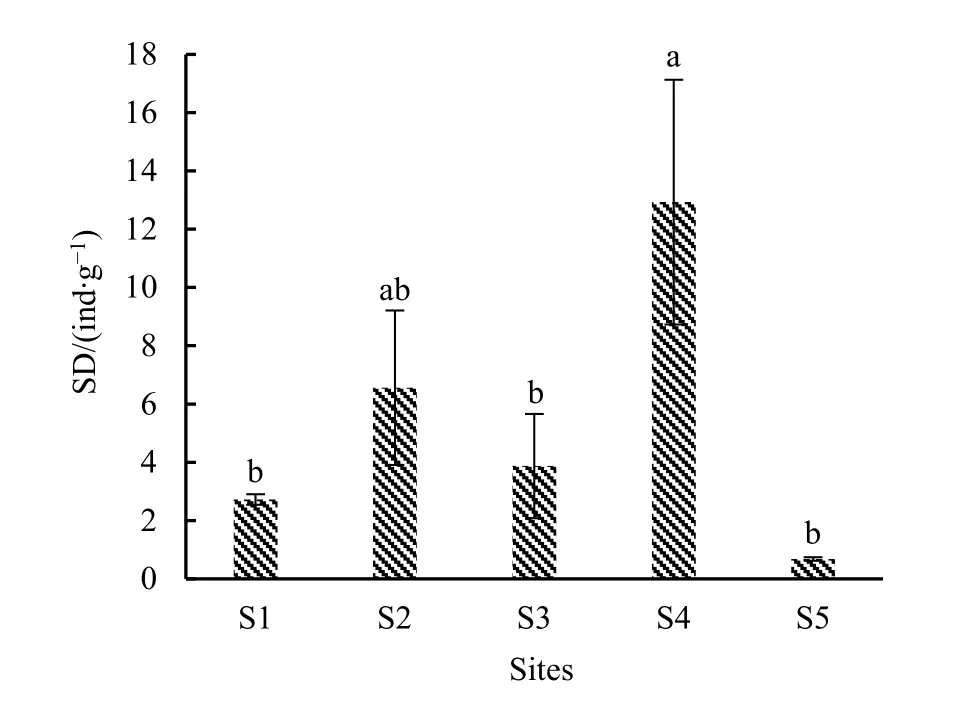
图2 不同样地蜈蚣草根围土壤AM真菌的孢子密度(SD)Fig.2 Spore density in rhizosphere soil of Pteris vittata L.in different sites (SD)
如表2所示在采集的所有土壤样品中,共分离鉴定出2目3科4属10种AM真菌。其中7种属于球囊霉属Glomus,分别为聚丛球囊霉G.aggrega、白色球囊霉G.albidum、沙荒球囊霉G.deserticila、黄孢球囊霉G.flavisporum、团集球囊霉G.glomerulatum、网状球囊霉G.reticulatum和地表球囊霉G.versiforme。1种属于管柄囊霉属Funneliformis,为缩球囊霉F.constricum。1种属于近明囊霉属Claroideoglomus,为近明球囊霉C.claroidem。1种属于盾巨孢囊霉属Scutellospora,为黑盾聚孢囊霉S.nigra。

表1 样地土壤及蜈蚣草的理化性质Table 1 Soil and Pteris vittata L physicochemical properties of sites

表2 南丹蜈蚣草根围AM真菌形态学多样性Table 2 Morphological diversity of AM fungi in Pteris Vittata L.root area of nandan
2.3.2 蜈蚣草根围土壤AM真菌分布状况
不同样地蜈蚣草根围土壤中AM真菌的分布情况见表3。在分离鉴定出的10种AM真菌种中,近明球囊霉、团集球囊霉和地表球囊霉分离频度最高,为100.00%。聚丛球囊霉、缩球囊霉、沙荒球囊霉、黄孢球囊霉和网状球囊霉分离频度最低,均为 20.00%。其中聚丛球囊霉和缩球囊霉为样地 2的特有种,沙荒球囊霉、黄孢球囊霉和网状球囊霉为样地4的特有种。
同一AM真菌物种在不同样地相对丰度有较大差异。近明球囊霉在样地1、样地2和样地5均有较高的分布,分别占样地1、样地2和样地5的32.35%、28.46%和35.29%;近明球囊霉在样地3和样地4有较低的分布,分别占样地3和样地4的8.97%和4.64%。

图3 孢子形态图Fig.3 The spore morphological

表3 不同样地蜈蚣草根围土壤中AM真菌的分布情况Table 3 AM fungi’s distribution in rhizosphere soil of Pteris vittata L.in different sites
团集球囊霉在样地3和样地4有较高的分布,分别占样地3和样地4的47.59%和29.79%;团集球囊霉在样地1、样地2和样地5均有较低的分布,分别占样地1、样地2和样地5的13.24%、8.94%和7.84%。不同样地间相对多度最高的AM真菌也是不同的。近明球囊霉在样地1和样地2有最高的分布,为样地1和样地2的优势种;团集球囊霉在样地3和样地4有最高的分布,为样地3和样地4的优势种;地表球囊霉在样地5有最高的分布,为样地 5的优势种。黑盾聚孢囊霉在不同样地间均具有较低的分布,分别占样地2和样地4的0.81%和0.62%。
2.3.3 蜈蚣草根围土壤AM真菌多样性
如图4所示,样地2和样地4物种丰度最高,均为4.33;其次为样地1和样地3,物种丰度分别为4.00和2.67;样地5物种丰度最低,为2.00。样地2和样地4的物种丰度是样地5物种丰度的2.17倍。
Shannon指数反映样地AM真菌多样性状况,数值越大,多样性越高。如图 5所示,样地 1的Shannon指数最高,为1.21;其次为样地4、样地2和样地3,Shannon指数依次为1.18、1.02和0.81;样地5的Shannon指数最低,为0.66。除样地4外,样地1—5 Shannon指数依次降低。
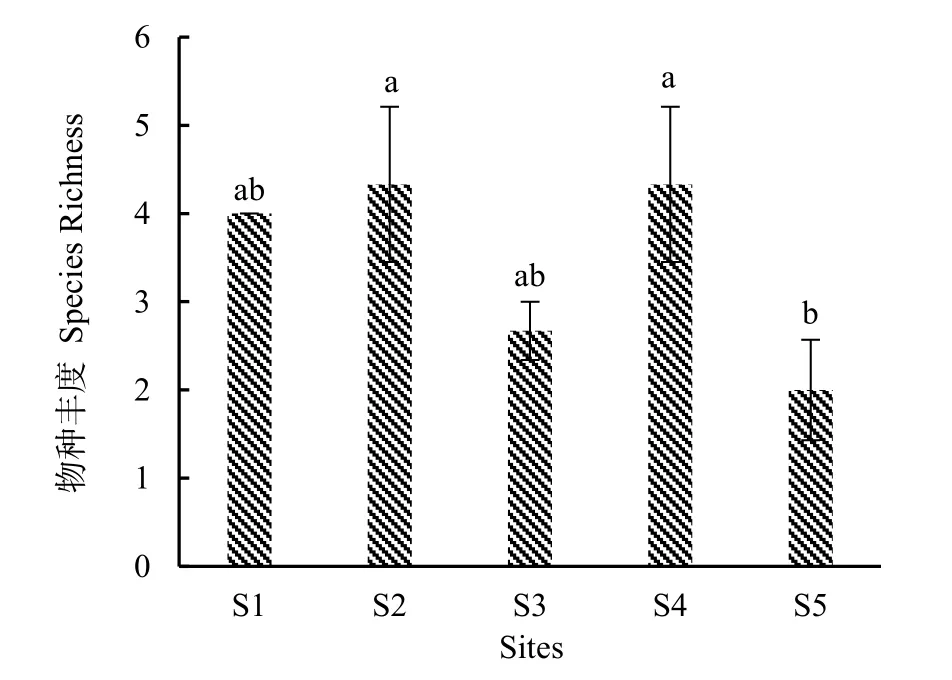
图4 不同样地蜈蚣草根围土壤AM真菌的物种丰度Fig.4 Species Richness of AM fungi in rhizosphere soil of Pteris vittata L.in different sites
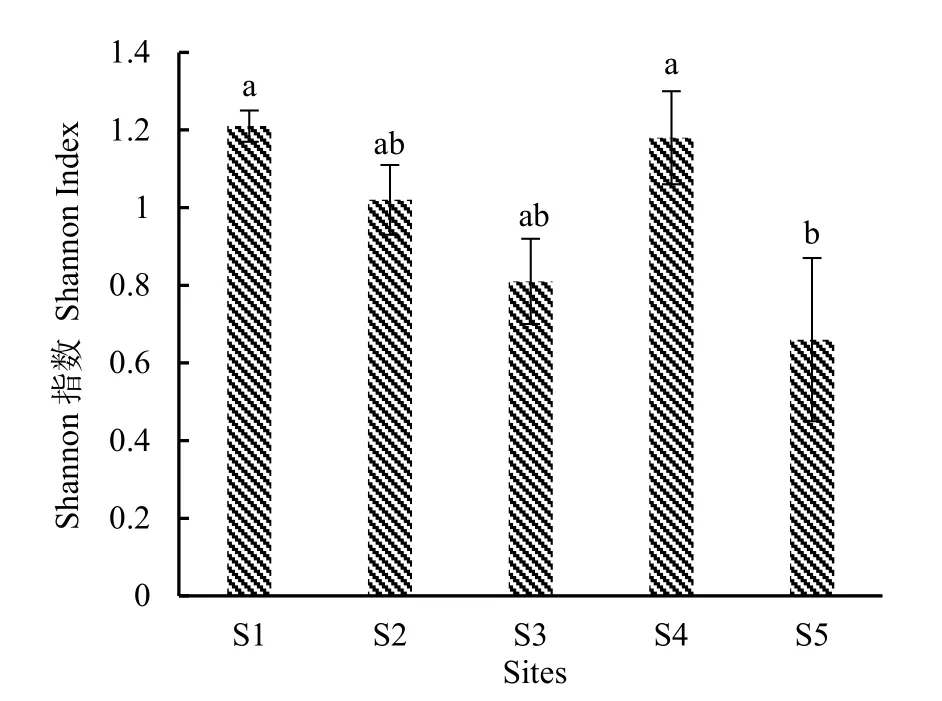
图5 不同样地蜈蚣草根围土壤AM真菌的Shannon指数Fig.5 Shannon Index of AM fungi in rhizosphere soil of Pteris vittata L.in different sites
3 讨论
本研究所调查的5个不同程度砷污染样地中的蜈蚣草均能被AM真菌侵染,分离出AM真菌4属10种,但与Schneider et al.(2013)在巴西砷污染土种分离出6属23种相比,AM真菌的物种丰度相对较低。这是采用单一宿主植物蜈蚣草作为研究对象的缘故,因为AM真菌对宿主植物具有一定的选择性(包玉英,2004),宿主植物多样性在一定程度上决定了AM真菌的多样性(何斐,2016)。同时重金属污染土壤中的AM真菌物种多样性水平相对较低(Khan,2001)。
本研究分离的10种AM真菌中,球囊霉属7种,管柄囊霉属1种,近明囊霉属1种,盾巨孢囊霉属1种,球囊霉属占各个土壤样本的75.31%—99.80%。球囊霉属是该调查区域的优势属,这与 Wei et al.(2015)在锑污染地区苎麻根区土壤的AM真菌多样性调查结果一致。这一结果可能的原因是球囊霉属为AM真菌类型最大的群体,生活范围较宽,可以形成一个庞大的菌丝网络系统,在胁迫环境下重建菌丝网络能力强,对环境胁迫有更强的适应性(Providencia et al.,2005;Wu et al.,2009)。相较于其它AM真菌仅能通过孢子繁殖,球囊霉属AM真菌可以通过菌丝片段和菌根根段繁殖(Hassan et al.,2011),更高的产孢能力以及更强的侵染植物的能力提高了其繁殖能力,提高了球囊霉属AM真菌在重金属胁迫环境下的竞争力,促进根外菌丝在重金属污染土壤中快速生长(Daniell et al.,2011)。
一般认为,植物根围土壤中AM真菌的物种多样性与孢子密度应是一致的,在重金属污染严重的矿区,植物根区土壤中AM真菌的孢子密度与物种丰度之间也表现出了这种相关性,即孢子密度值较大的土壤,其物种丰度也较高(肖艳萍等,2008)。本研究的侵染率结果是 S5的侵染率最高,为84.00%,但其孢子密度仅为0.68 ind·g-1,远低于其他4个样地;同时S5样地的物种丰度和物种多样性也最低,分别为2.00和0.66。侵染率高,但孢子密度低是因为一定量的土壤重金属虽不能抑制AM真菌与植物形成AM真菌共生体,但对AM真菌的产孢能力具有明显的影响(梁昌聪等,2007)。高浓度的砷阻碍了AM真菌的生长繁殖,只有少数抗压能力较强菌种的孢子可以抵抗这个不利因子从而在土壤中存活,如本研究结果中的近明球囊霉、地表球囊霉等,这部分优势AM真菌的孢子具有很强的保护机制和外部菌丝的产生和更新能力,可以适应高浓度的重金属环境(Patricia et al.,2016),菌丝的快速生长更新能力也使得其具有更高的侵染率。S1中总砷和有效态砷含量都很低,所以推测蜈蚣草根系侵染最高主要受土壤磷影响,因 S1土壤中的全磷为0.45 g·kg-1,远低于其他4个样地,而低磷可以刺激AM真菌孢子萌发和菌丝生长从而促进 AM 真菌的侵染(张淑彬等,2017);同时S1样地的孢子密度最低可能也受到高海拔的影响,S1的海拔为802 m,显著高于其他4个样地(S2—S5海拔高度为462—567 m),海拔升高会影响AM真菌的生长和产孢,明显低AM真菌孢子密度(Gai et al.,2012)。
AM真菌对环境的适应能力很大程度决定了它的物种丰度及物种多样性。除S4之外,S1—S5的物种丰度与多样性总体呈下降趋势,S4的物种丰度和多样性分别为4.33和1.21,为S5的2倍左右,孢子密度是5个样地中最高的,为6.56 ind·g-1。这可能与S4的孢子形态有关,AM真菌孢子的形态差异也影响孢子对砷污染的适应能力。S4的孢子如黑盾巨孢囊霉、沙荒球囊霉等颜色深或表面纹饰丰富的孢子多,5个样地中,团集球囊霉和地表球囊霉等适应性较强的菌种分离频度均达到了100%,相对丰度更高,颜色深、表面网纹间隔致密的AM真菌对砷污染的有更强的抵御能力,颜色深的AM真菌孢子黑色素含量高,砷浓度高的样地中团球囊霉、地表球囊霉和缩球囊霉的AM真菌孢子的颜色相对砷含量低的样地偏深,表面网纹更密,对其在矿区污染环境下的生存有利,网纹间隔致密的特征更有利于其抵御外界污染物的入侵,减少对其的损害,从而使AM真菌孢子具有更高的活力(李华健等,2019)。
4 结论
不同程度砷污染土壤中生长的蜈蚣草均能被AM 真菌侵染,随着砷浓度的增加物种多样性总体呈下降趋势。无污染土壤中的AM真菌侵染率和孢子密度主要受土壤磷和海拔的影响。低磷促进孢子萌发和菌丝生长,从而提高侵染率,而海拔升高会导致孢子密度降低。但随着土壤砷污染水平的增加,砷浓度逐渐成为主要影响因子,使侵染率上升,孢子密度下降。孢子密度和物种丰富的变化趋势一致。
共分离出的4属10种AM真菌,管柄囊霉属、近明囊霉属、盾巨孢囊霉属各1种,其余7种均为球囊霉属,球囊霉属是该调查区域的优势属。AM真菌孢子的形态直接影响的其适应能力,颜色深、表面网纹间隔致密的AM真菌抗逆性更好,近明球囊霉、团集球囊霉和地表球囊霉等适应性较强的菌种分离频度达到了100%,相对丰度也相对较高。

