增温对青藏高原草地生态系统土壤球囊霉素含量的影响
杨梅,石兆勇,2,3*,卢世川,张梦歌,王旭刚,徐晓峰
1.河南科技大学农学院,河南 洛阳 471000;2.洛阳市共生微生物与绿色发展重点实验室,河南 洛阳 471000;3.中国科学院山地表生过程与生态调控重点实验室,四川 成都 610041
土壤作为陆地生态系统中最大的碳库,是大气碳库的3.3倍、生物碳库的4.5倍,是全球碳循环的重要组成部分,是大气CO2的源和汇(Lal,2004),土壤有机碳的贮量可达整个陆地生态系统的 2/3,在全球碳循环中发挥着重要作用(薛丽佳等,2011;Schlesinger,1990)。丛枝菌根(AM)真菌可以和绝大多数的微管植物根系形成互惠共生体(Chen et al.,2012;刘海跃等,2018),植物根系AM真菌侵染率则是通过侵染状况反映植物与丛枝菌根真菌形成共生关系的重要标志,孢子密度则反映了丛枝菌根真菌的群落特征。而球囊霉素是由丛枝菌根真菌(AMF)分泌的一种含金属离子的糖蛋白物质,按照提取的难易程度可将这种蛋白分为总提取球囊霉素(Total glomalin)和易提取球囊霉素(Easily extractable glomalin)(Wright et al.,1996;Wright et al.,1998),其在真菌孢子和菌丝衰亡降解后,释放到土壤中(Comis,2002),成为土壤有机碳的重要组成和来源(郭亚楠等,2017)。球囊霉素是土壤稳定有机碳库的重要组成部分(Steinberg et al.,2003)。Wright et al.(1998)研究表明,球囊霉素含碳量可达土壤有机碳库的30%—40%。Rillig et al.(2003)则认为球囊霉素是土壤碳库的重要来源。Miller et al.(1995)研究表明,在热带沙漠土壤中,球囊霉素的含碳量占到土壤总碳的4%—5%,高于微生物生物量碳。谢靖等(2012)研究表明,在黄土高原,球囊霉素是土壤有机碳的重要来源。许伟等(2015)研究表明,在塞北荒漠草原,球囊霉素是土壤有机碳的重要组成和来源。郭亚楠等(2017)研究表明,在蒙古荒漠地区,球囊霉素是土壤有机碳的重要来源和组成成分。可见,在不同生态系统中,球囊霉素都作为土壤碳库的重要组成部分。鲁青原等(2016)就证实球囊霉素能促进土壤碳固定,其机制是通过固定土壤微粒,形成团聚体,从而保护了土壤有机质。田慧等(2009)进一步证实了球囊霉素不仅影响到土壤团聚体的结构和形成,且能增加土壤团聚体的稳定性。
通常,气温增加能导致土壤有机碳的分解,因此,引起了广泛关注。研究表明,温度每升高1 ℃,全球土壤有机碳将分解 11—34 Gt,释放出更多的CO2,从而又会加剧全球变暖(Rousk et al.,2015)。侯颖等(2008)研究也表明,全球气候变暖能够导致土壤微生物活动的增强,从而致使土壤有机质加速分解。可见,全球变暖后的温度升高会使土壤有机碳加剧分解,导致其含量降低;而球囊霉素作为土壤碳库的重要组成部分,其含量随气温增加的变化,却罕见报道。因此,本文选择对气候变化较为敏感的青藏高原地区,研究了模拟增温对球囊霉素含量的影响。
青藏高原对全球气候变化十分敏感(Shi et al.,2015)。这种独特的地理环境为各种自然科学研究的开展提供了天然的“实验室”(田玉强等,2009)。因此,本研究在此地展开,旨在探讨土壤球囊霉素对全球增温的响应及其贡献,为丛枝菌根真菌生态功能的研究提供数据支撑。
1 材料与方法
1.1 样地概况
研究地点在 29°20′—30°20′N 和 101°30′—102°15′E之间的青藏高原的东部,海拔高度为3000—4500 m。自然生态系统类型多样,保存完好,受人类干扰程度低,有利于研究根际土壤和根系的采集。
1.2 试验设计与样品采集
在青藏高原3000、3500、3800、4170 m的4个海拔梯度上均设置了20 m×20 m的样地,每个样地分成25个4 m×4 m的样方,然后随机抽取10个不相邻的样方,在中心区域设置1 m×1 m的样方,其中,5个作为对照,另5个进行OTC增温处理。OTC增温是最简单和普遍使用的增温方式,和其他增温方式相比,可保证土壤基本不受到破坏和干扰,且操作简单,成本低,易重复,十分适合野外观测实验的进行(张相锋等,2018;Klein et al.,2004)。其顶部和底部均为六边形,且均为开放式,侧面为6块梯形形状的有机玻璃组成。增温一年后发现,总体上温度增加了1.4 ℃,在4个海拔梯度上的温度动态变化范围为0.6—2.4 ℃。采样时在随机抽取的 5个对照样方中用打孔器采集直径为 2 cm,深度为0—20 cm的土柱,将5个土柱混合作为一个样品,重复5次。OTC增温样方取样方法同上。然后,将土壤与根系分离开,并分别用自封袋进行封装。整体上看,对照处理土壤含氮量为0.75%,增温处理的土壤含氮量为0.53%。从不同海拔上看,对照处理的土壤含氮量在0.41%—1.48%之间,增温后的土壤含氮量在0.44%—0.64%之间。
1.3 指标的测定
AM真菌侵染率按照Phillips et al.(1970)的方法进行测定,将采集的须根清洗干净置于质量分数为10%的KOH溶液中,用90 ℃的水浴锅水浴30 min,当根相对透明时,用自来水冲去碱液并置于体积分数为5%的醋酸溶液中浸泡5 min,然后放入体积分数为 5%的醋酸墨水溶液中经 90 ℃水浴加热30 min进行染色,再用自来水洗净并置于乳酸中,30 min后将根剪为1 cm长度制成玻片并在显微镜下进行观察,最后计算侵染率的大小。
孢子密度按Gerdemann et al.(1963)的方法称取 15 g的风干土采用湿筛倾析——蔗糖离心法筛取孢子然后在显微镜下进行观察,并统计孢子数量。孢子密度采用每克风干土中的孢子数来表示。
球囊霉素按照Wright(1996)和David(2008)的方法分别测定了总提取球囊霉素和易提取球囊霉素。
总提取球囊霉素测定方法为取1 g风干土于试管中,加入8 mL柠檬酸钠(50 mmol·L-1,pH=8.0)在 103 kPa、121 ℃下浸提 60 min,再重复提取 2次,然后在6000 r·min-1下离心15 min并收集其上清液。易提取球囊霉素测定方法与总提取球囊霉素提取方法相似,只是柠檬酸钠浓度为20 mmol·L-1,pH=7.0,浸提时间为90 min,然后离心,收集其上清液。然后分别吸取0.5 mL上清液加入5 mL考马斯亮蓝G-250染色剂,用分光光度计在595 nm波长下比色。用牛血清蛋白作为标准液,考马斯亮蓝法显色,绘制标准曲线,即可求出球囊霉素含量。
1.4 数据分析
本研究统计检验采用SPSS 19.0进行单因素方差分析和 Spearman相关系数分析,进行不同海拔梯度下,OTC增温和对照处理中侵染率、孢子密度、总提取球囊霉素、易提取球囊霉素、总提取球囊霉素和易提取球囊霉素的比值的差异性以及土壤球囊霉素与其影响因素之间的关系。
2 结果分析
2.1 增温对球囊霉素的影响

图1 增温对TG的影响Fig.1 Effect of warming on TG
通过测定4个不同海拔高度增温和对照的总提取球囊霉素(TG)和易提取球囊霉素(EEG)含量发现,不论是总提取球囊霉素还是易提取球囊霉素在增温后都没有发生明显变化。在总提取球囊霉素中(图1),4个不同海拔的对照和增温的平均总提取球囊霉素的含量分别为 4.27 mg·g-1和 4.35 mg·g-1。在对照处理中,其总提取球囊霉素含量在3.96—4.59 mg·g-1范围内,且最大值和最小值分别出现在海拔3500 m处和海拔4170 m处;而在增温处理中,总提取球囊霉素含量在 4.25—4.43 mg·g-1范围内,且最大值和最小值分别出现在海拔3800 m处和海拔4170 m处。可见,无论是在增温还是对照处理中,总提取球囊霉素含量的最低值都出现在4170 m海拔处,且增温处理的最低值比对照处理的最低值要略微高一些,但并不显著。并且,通过比较每个海拔的增温和对照处理发现,二者在每个海拔都差异不显著。表明增温并没有降低总提取球囊霉素的含量,也就是说,增温条件下,总提取球囊霉素的含量并未受到不利影响。

图2 增温对EEG的影响Fig.2 Effect of warming on EEG
在易提取球囊霉素的结果中发现(图2),增温后4个不同海拔的易提取球囊霉素的平均值有所下降,但并不显著。4个海拔的对照和增温的易提取球囊霉素的含量的平均值分别为1.62 mg·g-1和1.52 mg·g-1。综合考虑4个不同的海拔梯度增温和对照处理时,发现其易提取球囊霉素含量在对照处理中处于1.51—1.75 mg·g-1范围内,其最大值和最小值分别出现在海拔4170 m处和海拔3800 m处;而在增温处理中,易提取球囊霉素含量处于 1.35—1.71 mg·g-1范围内,其最大值和最小值分别出现在海拔3000 m处和海拔3800 m处,增温前后易提取球囊霉素的最小值均出现在3800 m处。但在增温和对照处理中,易提取球囊霉素含量在4个海拔中都差异不显著(图2)。说明增温并没有降低易提取球囊霉素的含量,即增温对易提取球囊霉素的含量并没有产生不利影响。
我们还进一步比较了4个不同海拔高度增温和对照的易提取球囊霉素与总提取球囊霉素含量的比值,结果表明(图3),4个不同海拔的对照和增温的平均比值分别为0.38和0.36。对于4个不同的海拔梯度而言,综合考虑增温和对照处理时,对照处理中,其比值最高为 0.46,出现在海拔 4170 m处,而最低为0.35,出现在海拔3800 m处;而在增温处理中,其比值最高为0.40,出现在海拔3000 m处,最低为0.31,出现在海拔3800 m处。进一步比较每个海拔增温和对照的差异状况,发现二者在海拔4170 m处差异显著,而在其他3个海拔都差异不显著(图3)。

图3 增温对EEG 和TG的比值的影响Fig.3 Effect of warming on the ratio of EEG and TG
2.2 增温对AM真菌侵染的影响

图4 增温对丛枝菌根侵染率的影响Fig.4 Effect of warming on arbuscular mycorrhizal colonization
植物根系菌根侵染率是植物与丛枝菌根真菌形成共生关系的重要标志,因此测定了4个不同海拔高度增温和对照的菌根侵染率(图4)。结果表明,无论是增温还是对照处理,其菌根侵染频率都很高;4个不同海拔的对照和增温的平均侵染率分别为85.28%和88.38%。可见,增温并不会降低植物的菌根侵染率,也就是说,增温条件下,植物菌根共生关系的形成并未受到不利影响。对于4个不同的海拔梯度而言,综合考虑增温和对照处理时,其侵染率最高为96.53%,出现在海拔3000 m的增温处理;而最低也为79.04%,则出现在海拔4170 m的对照处理。进一步比较每个海拔增温和对照的差异状况,发现二者在每个海拔都差异不显著(图4)。
2.3 增温对孢子密度的影响
孢子密度反映了丛枝菌根真菌的群落特征,因此,测定了4个不同海拔高度增温和对照的孢子密度(图5)。结果发现,4个不同海拔的对照和增温的平均孢子密度相差并不明显,分别为19 ind·g-1和20 ind·g-1。可见,增温并不会降低植物的孢子密度,也就是说,增温条件下,其繁殖能力并未受到不利影响。综合考虑增温和对照处理时,在对照处理中,其孢子密度最高为 27 ind·g-1,最低为 14 ind·g-1;而在增温处理中,孢子密度最高为24 ind·g-1,最低为15 ind·g-1,发现增温并没有使孢子密度发生明显变化。通过进一步比较每个海拔的增温和对照的差异状况,发现二者在每个海拔都差异不显著(图5)。
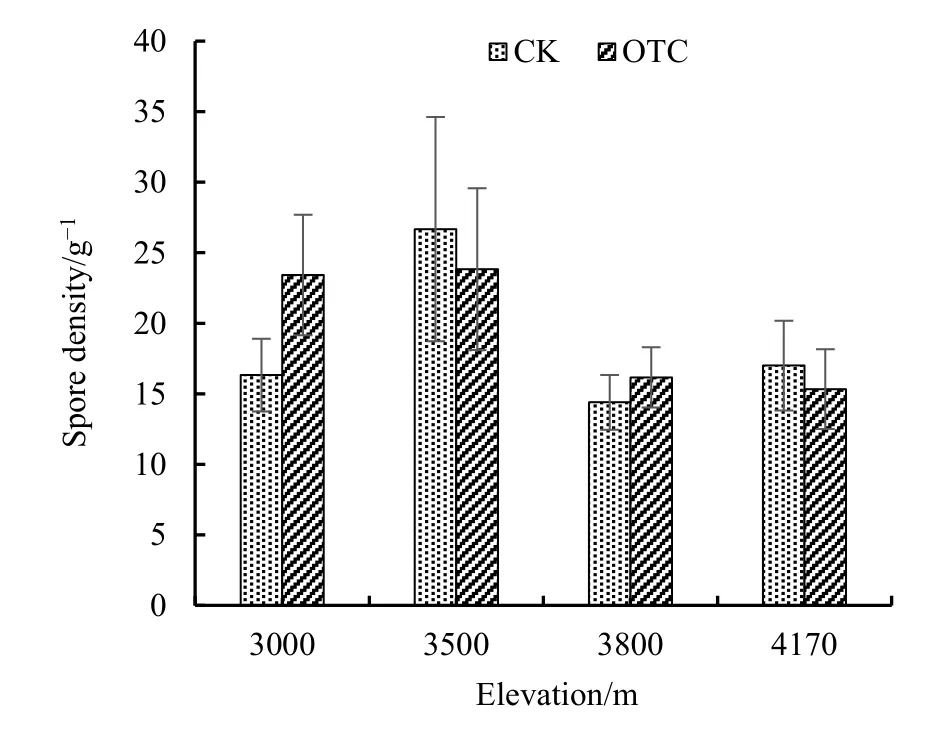
图5 增温对孢子密度的影响Fig.5 Effect of warming on spore density
2.4 增温对土壤碳的影响
从总体上看,OTC增温后,土壤碳有所降低,从对照的7.35%,在增温后降低为6.96%。从4个海拔梯度上看,在对照中,土壤碳最高为4170 m海拔处的8.46%,最低为3000 m海拔处的5.36%;而在增温后,土壤碳最高为3800 m海拔处的8.20%,最低为3000 m海拔处的5.80%。从4个海拔梯度的整体来看,在3000 m和3800 m海拔处,OTC增温后,土壤碳有所增加,但并不显著。在3500 m和4170 m海拔处,OTC增温后,土壤碳呈现减少趋势,但也不显著(图6)。
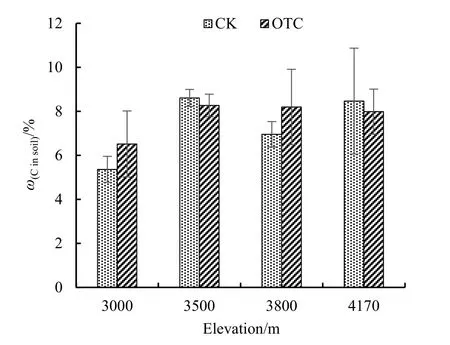
图6 增温对土壤碳的影响Fig.6 Effect of warming on C in soil
增温后,总提取球囊霉素与土壤碳的比值在3000 m海拔和 4170 m海拔处有所增加,但不显著,在3500 m海拔和3800 m海拔处却有所下降,但也不显著(图7)。增温后,土壤易提取球囊霉素与土壤碳的比值在4个海拔梯度中都有所减少,但都并不显著(图8)。说明球囊霉素对土壤碳库有所贡献,且总提取球囊霉素对土壤碳库的贡献略大于易提取球囊霉素。

图7 增温对TG和土壤碳的比值的影响Fig.7 Effect of warming on the ratio of TG and C in soil

图8 增温对EEG和土壤碳的比值的影响Fig.8 Effect of warming on the ratio of EEG and C in soil
2.5 土壤球囊霉素与其影响因素之间的关系
在对照处理中,土壤碳与总提取球囊霉素(TG)、易提取球囊霉素(EEG)呈负相关关系(表1),与丛枝菌根侵染率、孢子密度呈正相关关系;而在增温处理中,土壤碳与总提取球囊霉素和丛枝菌根侵染率呈负相关关系,与易提取球囊霉素和孢子密度呈正相关关系。在对照处理中,总提取球囊霉素与易提取球囊霉素呈正相关关系,且具有显著性(P=0.025),与孢子密度也呈正相关关系,但不显著,与丛枝菌根侵染率呈负相关关系;而在增温处理中,总提取球囊霉素与易提取球囊霉素和丛枝菌根侵染率呈正相关关系,与孢子密度呈负相关关系。在对照处理中,易提取球囊霉素与丛枝菌根侵染率和孢子密度都呈负相关关系;而在增温处理中,易提取球囊霉素与丛枝菌根侵染率始终保持负相关关系,但和孢子密度呈正相关关系。在对照处理中,丛枝菌根侵染率与孢子密度呈正相关关系;而在增温处理中,丛枝菌根侵染率与孢子密度呈负相关关系。
3 讨论
全球气候变暖,土壤碳库分解速度加快,而球囊霉素又是土壤碳库的一部分。综合模拟增温后总提取球囊霉素和易提取球囊霉素含量变化的研究结果发现,在模拟增温条件下,青藏高原不同海拔的土壤球囊霉素含量没有发生明显变化,说明球囊霉素在全球变暖的条件下并没有起到加速土壤碳分解的作用,而是对土壤碳库起到了稳定的作用。这与王建等(2016)的研究表明土壤球囊霉素可以促进土壤中碳存储的结论相似等。和钟思远等(2018)研究的球囊霉素可促进土壤碳固持的结论相似。且Rillig et al.(2001)的研究也表明由AMF分泌的球囊霉素可以进行较慢的碳循环来抵消土壤碳中的快速循环。本研究还对易提取球囊霉素与总提取球囊霉素含量的比值进行了分析,结果发现,增温导致易提取球囊霉素与总提取球囊霉素含量的比值在3800 m和4170 m海拔处呈现出略微降低的趋势,在3000、3500 m海拔处呈现出略微升高的趋势,但结果都不显著,而在4170 m海拔处呈现出显著降低,这说明在4170 m海拔处易提取球囊霉素的含量与总提取球囊霉素的含量相比较多,但只有在较高的4170 m海拔处显著,其他3个海拔都没有明显影响,此数据不具有代表性,还需要进一步深入探讨研究。
因为侵染率能反映出植物与AM真菌之间的共生关系,侵染率越高,说明植物与AM真菌之间的共生关系越密切;侵染率越低,说明植物与AM真菌的共生关系不够密切。因此本研究对AM真菌的侵染率进行了研究,研究发现,增温导致丛枝菌根对植物的侵染率在3500 m海拔处呈现出略微降低的趋势,在3000、3800、4170 m海拔处呈现出略微升高的趋势,且变化幅度为3.1%。这表明增温后侵染率并没有表现出明显的变化,说明增温并没有影响到植物与AM真菌之间的共生关系。出现这种原因可能与Carvaiho et al.(2015)报道的相似,其研究表明温度对侵染率的影响主要在于实验时间的长短以及温度的最低温取值。而球囊霉素含量之所以没有受到增温的影响,可能是丛枝菌根真菌对增温的不敏感所导致的。
本研究还测定了丛枝菌根根际土壤的孢子密度的大小,孢子是菌根真菌储存营养的重要器官和繁殖体(杜善周等,2008)。而土壤有机碳又是影响孢子密度的主要因素(Liu et al.,2017)。通过本研究发现:增温导致丛枝菌根根际土壤的孢子密度在3500 m和4170 m海拔处呈现出略微降低的趋势,在3000 m和3800 m海拔处呈现出略微升高的趋势,但结果都不显著。这表明丛枝菌根根际土壤的孢子密度的大小在增温后并没有发生明显的变化,说明增温并没有影响到其繁殖能力。
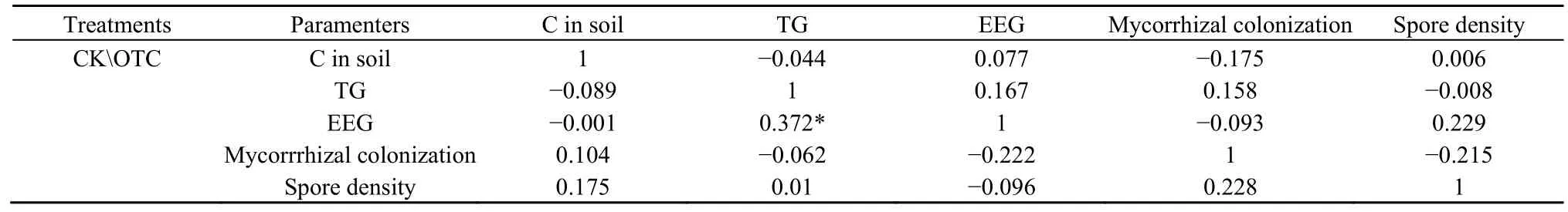
表1 土壤碳、丛枝菌根侵染率、孢子密度、总提取球囊霉素和易提取球囊霉素相关性系数Table 1 Correlation coefficients of C in soil, mycorrhizal colonization, spore density, TG and EEG
研究发现,在3000 m和3800 m海拔处增温后土壤碳增加,但不显著,而3500 m和4170 m海拔处土壤碳呈现出下降的趋势,且也不显著。说明增温对土壤碳并没有明显的影响,且对土壤碳库起稳定作用的球囊霉素也没有影响。这与Wang et al.(2014)所研究认为的增温对土壤总碳、有机碳含量没有显著影响结论相似。增温后,TG与土壤碳的比值有略微的升高或降低,但都不显著;且增温后,EEG与土壤碳的比值在 4个海拔梯度中都有所下降,但并没有呈现出显著性,说明增温并没有影响球囊霉素对土壤碳库的贡献,且总提取球囊霉素对土壤碳库的贡献略大于易提取球囊霉素。
土壤全碳、丛枝菌根侵染率、孢子密度、总提取球囊霉素和易提取球囊霉素之间的相关关系在增温后都有略微的变化,但只有总提取球囊霉素和易提取球囊霉素之间呈现显著性(P=0.025)。
4 结论
本研究通过在青藏高原草地生态系统模拟增温发现,从 4个海拔上来说,增温不但没有降低球囊霉素的含量,反而在 3个海拔中球囊霉素的含量都有略微增加;而增温后易提取球囊霉素与总提取球囊霉素的比值在低海拔处有略微增加,在高海拔处却降低;且增温没有降低植物与丛枝菌根的共生关系以及孢子密度;不仅如此,在各个海拔处,增温也都没有降低总提取球囊霉素对土壤碳库的贡献。

