甘肃民勤荒漠区两种主要固沙植物影响下的土壤细菌群落分布特征研究
吕燕红,赵瑛,张艳萍
甘肃省农业科学院生物技术研究所,甘肃 兰州 730070
沙漠化是由于人为因素和自然因素综合作用于脆弱的生态环境,造成植被破坏,出现风蚀、粗化、斑点状流沙和低矮灌丛沙堆,造成的土壤生产力下降或丧失的现象。沙漠化是一个严重的全球性环境问题(Andrew et al.,2012)。中国深受沙漠化的严重影响,中国荒漠化土地面积为262.2万km2,占国土面积的27.4%,这些沙漠化区域主要集中在中国东北地区西部和西北地区(Zhang et al.,2013;Li et al.,2013)。尤其是在中国西北地区,由于腾格里沙漠的外围扩张,以及巴丹吉林沙漠至石羊河下游流域水资源日益减少,导致民勤县的沙漠化问题日益严重(Du et al.,2010)。日益严重的荒漠化问题,已引起人们越来越多的关注。
国内已从不同的角度进行了荒漠化治理问题研究。在中国北方干旱地区,固定沙丘向半固定、流动沙丘的转变是土地退化的主要形式(Wang et al.,2005)。在民勤沙漠化地区,固定、半固定和流动沙地均有分布,各沙地的植被种类和密度不尽相同,已有大量的研究关注了该区域植被的生理特征(Zhang et al.,2013)。但对该区域土壤微生物群落结构受重要固沙植物的影响研究甚少,特别是对民勤沙漠化地区的植被相关微生物群落特征的研究仍然不足(Marasco et al.,2012)。虽然已经报道了很多微生物群落结构的影响因素,然而在我们的研究中,这些因素对微生物群落结构的相对贡献还存在着争议。本研究的目的是明确位点特异性,沙地类型(固定沙地、半固定沙地或流动沙地),土壤性质(pH值、土壤养分含量或土壤粒度),还是生物因素(不同宿主植物)是造成微生物群落变异的关键因素,分析研究该区域土壤细菌群落受优势固沙植物影响下的分布特征,为该区域的为民勤沙漠化地区的生态恢复提供重要的理论依据。
1 材料与方法
1.1 研究区概况及样品采集
民勤县是中国严重的沙漠化地区,地处甘肃省河西走廊东北部,石羊河流域下游,北临巴丹吉林沙漠,东临腾格里沙漠(Chang et al.,2006)。民勤县位居 101°49′41″—104°12′10″E、38°3′45″—39°27′37″N之间,最低海拔1298 m,最高海拔1936 m,平均海拔 1400 m,属温带大陆性干旱气候区,东西北三面被腾格里和巴丹吉林两大沙漠包围,大陆性沙漠气候特征明显,冬冷夏热、气候干燥、降水稀少、蒸发强烈、风大且频繁(Zhao,2014)。光照充足、昼夜温差大,年均降水量为127.7 mm,年均蒸发量2623 mm,昼夜温差15.5 ℃,年均气温8.3 ℃,日照时数为3073.5 h,无霜期162 d。此区由沙漠、低山丘陵和平原3种基本地貌组成。风沙地貌为研究区内绿洲外围的主要地貌类型,按覆被程度,可分为流动沙丘、半固定沙丘和固定沙丘等。
按照生态学野外调查的原则和方法,根据区域生态地理和水热条件进行采样条带设置。本研究中的土壤样品均采集自民勤县。
1.2 方法
通过描述与两种优势固沙植物白刺(Nitraria tangutorum Bobr,N)和梭梭(Haloxylon ammodendron,H)相关的细菌群落多样性与丰度之间的关系来调查民勤沙漠化区域的细菌群落。这两种植物在固定沙地(A)、半固定沙地(B)及流动沙地(C)均有分布。从9个位点(每个位点有3个重复)收集土壤样本,这些样本来自于两种优势的固沙植物和其对照:民勤沙漠化区域固定沙地(A)、半固定沙地(B)及流动沙地(C)的白刺(N)和梭梭(H)。2014年5月进行样品的采集。
根际土壤的采集:沿成熟生长期的白刺或梭梭主根向下挖掘20—50 cm,并分离该土层根附近的土壤,取质地较为均匀的土壤收集到无菌铝盒中(约400 g),每个位点随机选取长势接近的3株植物以同样方法采集根际土壤作为重复。
非根际土壤的采集:在采集根际土壤的植物附近大约200 cm的范围内随机选取3个位点,分别采集20—50 cm土层质地均匀的土壤装入无菌铝盒中(约400 g)。
所有样品采集后立刻装入冰盒并运送至实验室,将样品分装并保藏于-20 ℃或-80 ℃冰箱中,分别用于土壤理化性质的测定或DNA的提取。
利用 MiSeq高通量测序的方法从以下几个密切相关的目标对细菌群落进行评估:(1)探讨和比较本地区细菌群落在分类学多样性上的异同;(2)揭示影响细菌群落分布的主要因素;(3)分析两种灌木的分布和生长状况与细菌群落的关系;(4)从细菌角度解释为什么这两种优势固沙植物在相对恶劣的条件下生长状况更好。研究为民勤地区脆弱生态系统的恢复及优势固沙植物的适应机制提供理论依据。
1.3 土壤理化性质测定
对所有土壤样品进行了土壤全碳(STC)、土壤全氮(STN)、土壤全磷(STP)、土壤有机碳(SOC)、pH、电导率(EC)、土壤总含水量、钾离子(K+)、钙离子(Ca2+)及钠离子(Na+)的测定。将土壤悬液(m∶V=1∶5)摇匀,静置30 min后用pH计测定土壤pH值。利用元素分析仪(VarioEL III,Germany)测定土壤全碳(STC)和全氮(STN)。利用重铬酸钾氧化法测定土壤有机碳(SOC),并计算出土壤有机质含量(SOM)。利用磷酸钼锑抗比色法测定土壤全磷(STP)。采用火焰光度法测定土壤钾离子(K+)、钙离子(Ca2+)和钠离子(Na+)。测定方法参照Smith(1983)。
1.4 土壤DNA提取及高通量测序
利用E.Z.N.A土壤DNA提取试剂盒(OMEGA,USA)从5 g湿土中提取总DNA。提取的DNA稀释于 TE 缓冲液(10 mmol·L-1Tris-HCl,1mmol·L-1EDTA,pH=8.0)中置于-20 ℃备用。从纯化的DNA中取50 ng作为扩增模板,使用连接了标签的通用引物 F515(GTGCCAGCMGCCGCGG)和 907R(CCGTCAATTCMTTTRAGTTT)对细菌16S rRNA的V4—V5区进行扩增,每个样品在50 mL的反应体系下进行扩增,并设有3个重复,反应体系如下:94 ℃下变性 30 s,55 ℃退火 30 s,72 ℃延伸 30 s,30循环后在 72 ℃延伸 10 min。PCR产物利用Agarose Gel DNA纯化试剂盒(TaKaRa)纯化,并在质量为 2%的琼脂糖凝胶上电泳检测。利用Illumina Miseq PE250对所得 DNA片段进行测序(MajorbioBioPharm Technology Co.,Ltd.,Shanghai,China)。高通量测序所得序列随后进行过滤、质量控制及生物信息分析(Edgar,2013;Ni et al.,2017)。
1.5 数据分析
高通量数据使用Trimmomatic软件对原始测序序列进行质控,并利用FLASH软件进行拼接。使用UPARSE 软件(version 7.1 http://drive5.com/uparse/),根据97%的相似度对序列进行OTU聚类,并将其中的单序列和嵌合体在聚类的过程中去除。使用 RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,在 Silva数据库(SSU123)中进行比对,比对阈值通常设置为 70%。使用 R语言(veganpackagein)进行PCA、RDA分析。数据的标准化处理及作图分别使用Excel 2013和Origin 8.0完成。采用因子分析、信度分析、单因素方差分析及皮尔逊积差相关对数据进行统计学分析(P=0.05)。所有统计学分析均使用SPSS 18.0软件完成。
2 结果与分析
2.1 环境因子与土壤细菌群落的关系
研究土壤pH值在8.07—9.23之间。土壤STC和STN分别在2.93—9.21 g·kg-1及0.13—0.45 g·kg-1之间变化。土壤 Na+含量介于 103.21—512.47 mg·kg-1之间。土壤质地中绝大部分为沙土。所有的理化性质表明,民勤沙漠土壤具有偏碱性、高盐度、低营养的特点。
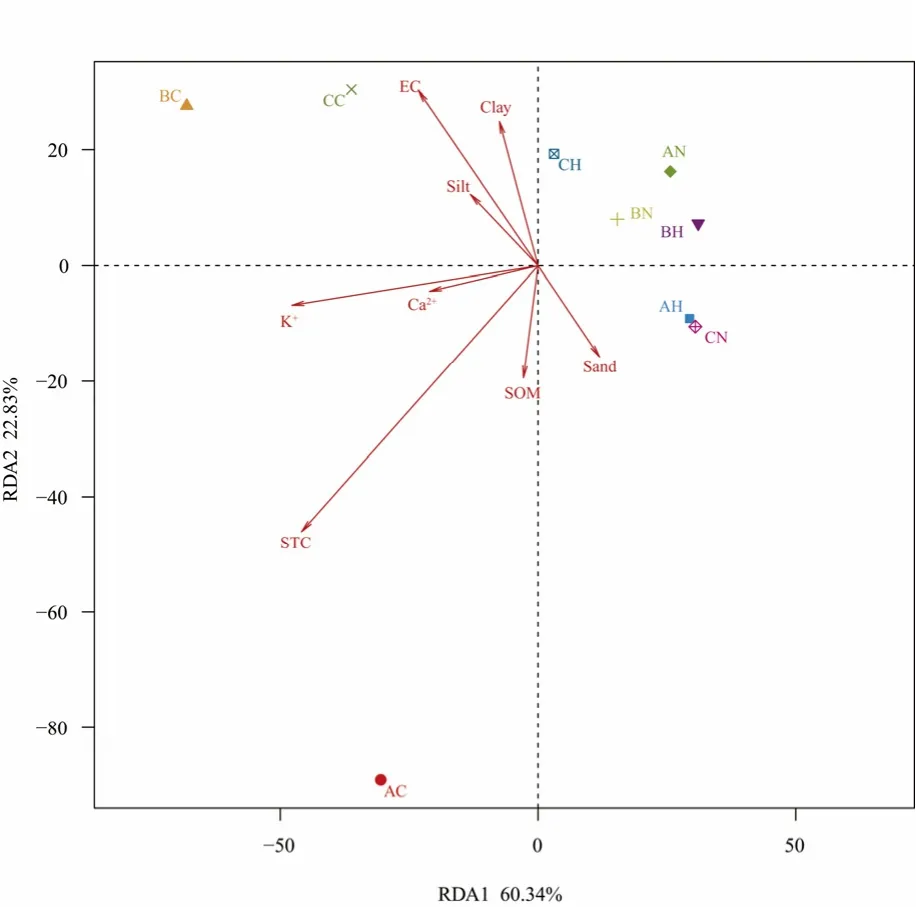
图1 细菌群落与主要环境因子的冗余分析(RDA)Fig.1 Redundancy analysis (RDA) of bacterial community and major environmental factors
对所有样品细菌群落与主要环境因子的基于OTU水平的冗余分析(RDA),见图 1。图中首要的两轴共解释了83.17%的变异。结果显示3个沙丘的根际土壤样品聚为一簇,并与K+、Ca2+离子呈负相关。而非根际土壤发生了显著的分离,并与沙土及电导率呈正相关,结果表明土壤性质及细菌群落结构受不同类型沙丘的影响发生了显著改变,植物的定植使土壤性质和细菌群落结构发生了转变,且不同类型沙丘上的植物根际土壤性质及细菌群落结构趋于接近。
2.2 测序结果的α多样性指数分析
物种积累曲线代表了随着样本数的增加有多少新的 OTU被积累到分析中,从而被用来确定我们的实验中是否观察到了细菌的总体多样性。随着我们研究中样本量的增加,OTU的数量趋于平稳,这表明我们的结果在很大程度上可以代表土壤细菌群落的真实多样性,见图2。
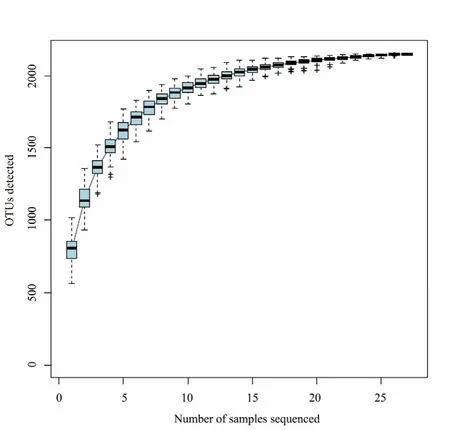
图2 所有样品的物种积累曲线Fig.2 Species accumulationcurve of all samples
2.3 细菌群落的分布特征
目前对于植物相关微生物群落的研究方法主要有传统的基于培养的方法,以及以高通量测序为代表的分子生物学方法。利用可培养的方法研究微生物群落具有较大的局限性(Cui et al.,2015),高通量测序方法则可以对微生物群落结构提供更为全面的认知(Buée et al.,2009)。本研究利用高通量测序技术来测定民勤不同沙地类型土壤细菌多样性,研究结果为:在所有27个土壤样品中,我们共得到了382306条有效序列,每个样品所得的序列数在10505—17126条(平均14159条)。序列读出长度在396.22—397.15 bp之间(平均396.50 bp)。
放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)、绿弯菌门(Chloroflexi)酸杆菌门(Acidobacteria)及Candidate_division_TM7在所有土壤样品中均为优势菌群(相对丰度>5%),这些菌群的相对丰度占总量的94%以上(图3a)。Caldiserica、Candidate_division_OD1、Tenericutes、Thermotogae、WCHB160、Deferribacteres、Fibrobacteres、TM6、BHI80-139、Caldiserica、SHA-109、Elusimicrobia、JL-ETNP-Z39、Chlorobi及 Nitrospirae在所有样品中的相对丰度较低(相对丰度<5%),但是它们在所有样品中分布广泛且占有一定比例(相对丰度>0.1%)。厚壁菌门在土壤样品BC和CC中的相对丰度最高,然而放线菌门在其他土壤样品中均占最高相对丰度。与其他土壤样品相比,CN中的拟杆菌门具有较高的相对丰度。
本研究中的优势菌属为乳球菌属(Lactococcus)、芽孢杆菌属(Bacillus)、节细菌属(Arthrobacter)、Subgroup_6_norank、Nitrosomonadaceae_uncultured、类诺卡氏菌属(Nocardioides)、土壤芽孢杆菌属(Solibacillus)等(图3b)。
2.4 细菌群落与根际及沙地的关系
对细菌群落基于 OTU水平的主成分分析(PCA)如图 4所示,结果显示所有根际样品聚为一簇,而非根际土壤聚为一簇,即根际与非根际土壤细菌群落发生了显著分离。白刺与梭梭根际样品之间则距离接近,表明它们之间的细菌群落差异不大。非根际土壤在不同沙地类型的影响下其细菌群落也较为接近。
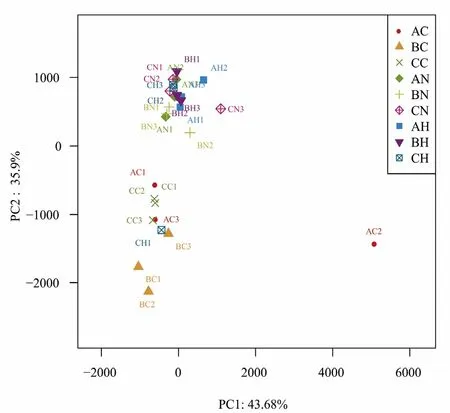
图4 细菌群落的主成分分析(PCA)Fig.4 Principal component analysis (PCA) of bacterial community
2.5 根际与非根际土壤细菌群落的比较分析
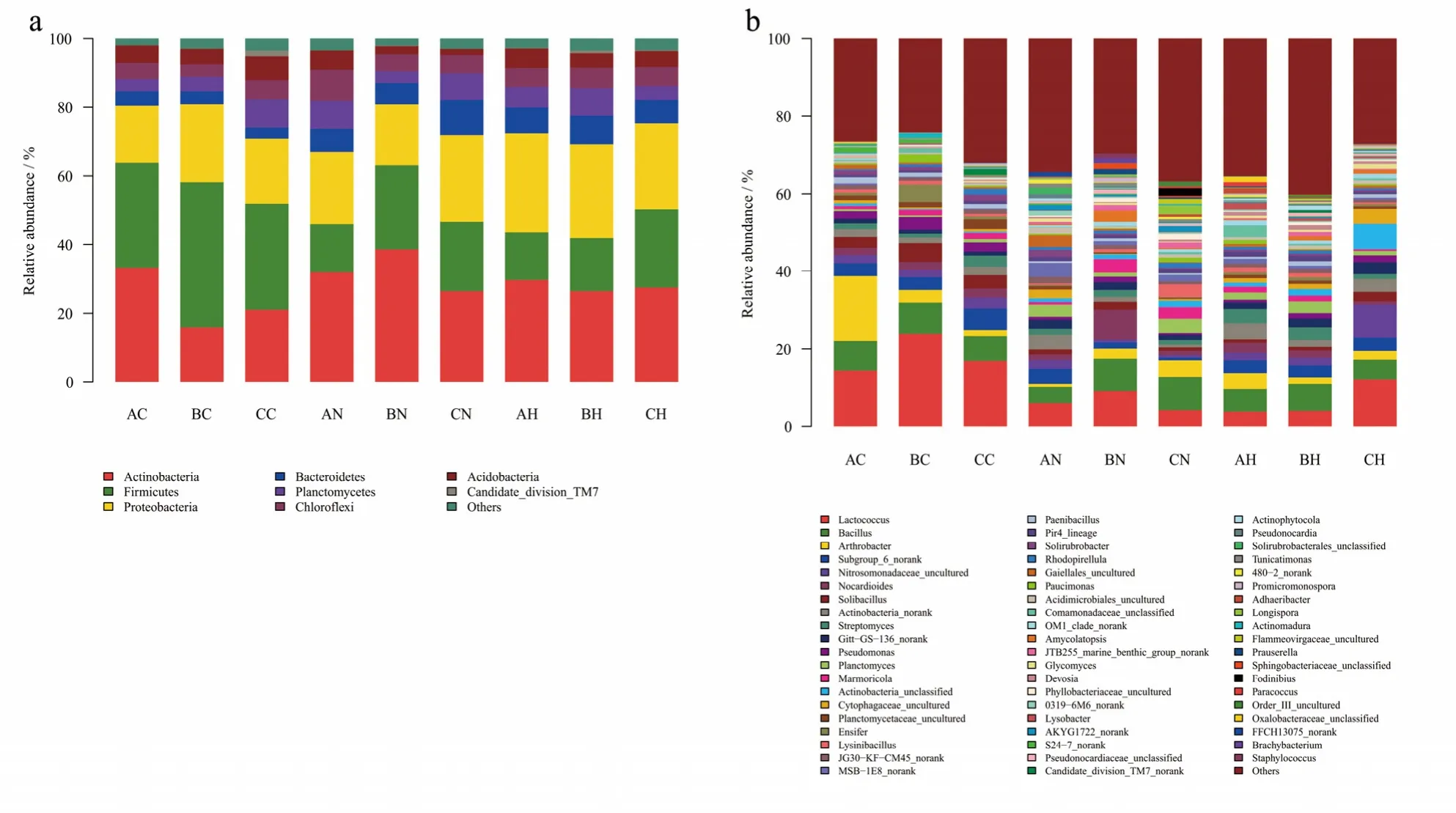
图3 优势细菌群落在所有样品的相对丰度Fig.3 Relative abundances of the dominant bacterial groupsin all samples
白刺(NitrariatangutorumBobr)和梭梭(Haloxylonammodendron)具有很强的抗旱抗沙埋能力,是民勤沙漠化地区的优势固沙植物(Zhao et al.,2005)。对根际与非根际土壤细菌群落的比较分析表明:白刺根际与非根际独有的 OTU数分别为414和273,而共有的OTU有1347个(图5a),这占到了总数的66.2%。变形菌门和拟杆菌门在白刺根际与非根际之间的相对丰度具有显著差异(图5b)。梭梭根际有431个独有OTU,这一数量在非根际为 184,且根际与非根际之间同样具有大量共有OTU(1436个),占OTU总数的70.01%(图5c)。与非根际相比,根际土壤中具有更高丰度的放线菌门、拟杆菌门和变形菌门,而非根际土壤中的浮霉菌门相对丰度高于根际土壤(图5d)。
3 讨论
3.1 沙地土壤性质与细菌群落的关系
研究结果表明民勤荒漠化地区的土壤养分分布不平衡,土壤有机质(SOM)含量在不同类型沙地间,以及两种优势固沙植物根际间存在显著差异,这主要是受到了K+和STN的影响。我们的研究符合半固定和流动沙地的资源岛假说,并依赖于灌木的生长状况,特别是流动沙地的白刺根际土壤中SOM值达到了最高。这主要是由于植物根系分泌物向土壤中释放了大量的养分所致(Franco-Otero et al.,2012)。然而在固定沙地上两种植物的根际土壤中SOM值均低于非根际土壤。已有研究表明在固定沙地的表层沉积了厚厚的结皮及砂质土层,从而阻碍了灌木对水分和养分的吸收,并发现灌木的覆盖度和生产力在建立 20年后均有所下降,这可能是由于深层土壤含水率下降所致(Li et al.,2004)。此项研究很好地解释了为什么在固定沙地上不符合资源岛假说,甚至白刺和梭梭种群在固定沙地上面临着退化的威胁。本项研究认为不同类型沙丘上植物根际是改变土壤性质及细菌群落的首要因素,这对于治理沙丘由流动向半固定、固定转变具有重要意义。
3.2 土壤细菌群落多样性

图5 根际与非根际土壤样品的比较分析Fig.5 Comparison of the rhizosphere and bulk soil samples
研究发现放线菌门、厚壁菌门、变形菌门、拟杆菌门、浮霉菌门、绿弯菌门及酸杆菌门是优势菌群,这与在其他沙漠土壤中的研究结果相一致(Andrew et al.,2012)。在腾格里沙漠的研究中变形菌门是非常优势的菌门(Zhang et al.,2012),然而本研究中厚壁菌门和放线菌门是最优势的菌门,这可能是由于我们的样品是在旱季采集,而厚壁菌门和放线菌门在干旱和寡营养的土壤中丰度较高(Vanessa et al.,2013)。在研究中,一些菌门,如Thermotogae、Caldiserica和Deinococcus-Thermus一直被认为具有良好的耐热性和耐辐射性,而这些菌群在大多数沙漠地区都有发现(Chanal et al.,2006;Saul-Tcherkas et al.,2013)。拟杆菌门和变形菌门在土壤中所占比例越大,在一定程度上代表了土壤越肥沃,在一些黑土地及半湿润地区的土壤中拟杆菌门和变形菌门往往是优势菌群(Liu et al.,2014)。变形菌门和拟杆菌门在流动沙地的白刺和半固定沙地的梭梭根际土壤中具有较高丰度,在本研究中这两处样地的植物生长状态最好。我们推测拟杆菌门和变形杆菌门中具有更多的植物促生菌,而植物通过根际向土壤中分泌的根系分泌物对这类菌群具有选择效应。厚壁菌门在非根际土壤中丰度最高,因为许多厚壁菌门可以产生内生孢子,从而能够在极端条件下存活。这一现象表明,灌木根系分泌物改变了其根际细菌群落的组成,使其相关的细菌群落得以更好的存活。
3.3 沙地类型和植物位点对细菌群落的影响
重复采样方法的结果表明,土壤细菌群落的形成主要取决于在研究位点是否定植有植物,而沙地类型是次要因素。这一结果与近期在中国北方其他荒漠区不同类型沙丘上的研究结果相一致(Gao et al.,2019a)。一些土壤性质,特别是土壤pH和碳含量与细菌群落多样性显著相关(Andrew et al.,2012;Vanessa et al.,2013)。固定沙地和半固定沙地梭梭根际的栖热菌门、变形菌门、拟杆菌门等占优势,而白刺根际则与之相反。这些群落的微生物群落分布与两种灌木的生长状态相一致,这些细菌群落丰度越高,其寄主植物的生长状态也越好。我们研究结果清楚地表明白刺与梭梭的生长条件存在显著差异,可能是因为白刺的生长模式很容易形成土包,所以形成了一个相对不太恶劣的微生物生存微环境。虽然沙丘的流动性对土壤细菌群落起到了一定的影响,然而植物在流动的沙丘上定植后产生的根系分泌液进一步改善了土壤性质,为根际细菌提供了充足的养分,同时提供了相对稳定的栖息条件(Berg et al.,2008)。结合近期的研究,我们认为这些菌群很可能对其寄主植物的生长及抗逆起到显著的促进作用(Gao et al.,2019b)。
3.4 细菌群落受复杂相互作用的影响
土壤微生物群落多样性和分布在不同的生态系统中存在着明显的差异,这种差异可能与一系列土壤非生物和生物因素有关(Garbeva et al.,2004)。许多研究表明环境因素,如土壤养分(Hillebrand et al.,2001)、pH(Rousk et al.,2010)、植物根际(Xiong et al.,2010)、微生物特异分布(Whitaker et al.,2003)和生境异质性(Martiny et al.,2006)均可影响微生物群落结构。目前普遍认为细菌群落在土壤中受到复杂的相互作用影响(Marschner et al.,2001)。一些研究认为植物种类起到了关键作用(Stanlotter et al.,2001;Kowalchuk et al.,2002),也有一些研究认为土壤类型起到了更为重要的作用(Citlali et al.,2016;Hartmann et al.,2017)。在中国北方其他区域已有研究显示固沙植物根际细菌多样性对于流动沙丘向半固定及固定沙丘的转变至关重要,根际细菌中包含有大量植物促生菌能够促进植物在不同类型沙丘上的定植(Gao et al.,2019a;Gao et al.,2019b)。此外,沙漠灌木可能会对相关的微生物产生促进或抑制的作用,在提供养分资源的同时产生生长抑制化合物,改变微生物群落的分布比例,甚至出现一些非根际土壤没有的类群(Andrew et al.,2012)。
本研究利用高通量测序的方法揭示了大量以前未被发现的细菌群落,并阐明这些类群对极端环境的潜在重要性。与当地土壤对优势类群的影响相比,植物类型对微生物群落的影响较小,这表明该环境中极端的物理因素对细菌群落的形成起着关键作用,根际改善了营养资源,改变了细菌群落的分布,但寄主植物类型对根际细菌群落的影响不大。我们的研究结果为揭示影响民勤沙漠地区土壤细菌群落分布特征的重要环境因子提供了理论依据,该结果有助于保持该地区土壤微生物多样性与推动生态环境修复。
4 结论
(1)民勤荒漠化地区土壤养分贫瘠,具有偏碱性、高盐度、低营养的特点。不同类型沙地土壤性质的转变造成了固沙植物根际土壤性质的差异。
(2)放线菌门、厚壁菌门、变形菌门、拟杆菌门、浮霉菌门、绿弯菌门及酸杆菌门在所有土壤样品中均为优势菌群。厚壁菌门、放线菌门、拟杆菌门具有较高的相对丰度。
(3)固沙植物可以通过根系分泌物对其根际土壤细菌群落进行调节,并体现出了对特定菌群的选择作用。与非根际相比,根际土壤中具有更高丰度的放线菌门、拟杆菌门和变形菌门,而非根际土壤中的浮霉菌门相对丰度高于根际土壤。
(4)研究位点是否定植有固沙植物是决定土壤细菌群落形成的首要因素,而沙地类型是次要因素,而寄主植物类型的影响不显著。

